
江苏省扬州市扬州大学附属中学东部分校2023-2024学年高二下学期期中考试 化学试卷
展开
这是一份江苏省扬州市扬州大学附属中学东部分校2023-2024学年高二下学期期中考试 化学试卷,文件包含高二期中考试试卷第二学期docx、高二化学期中考试选修答案docx等2份试卷配套教学资源,其中试卷共8页, 欢迎下载使用。
总分100分 时间75分钟 命题人史晓军 审题人:梁雪峰
可能用到的相对原子质量:C-12 H-1 O-16
单项选择题:本题包括13小题,每小题3分,共计39分。每小题只有一个选项符合题意。
1.化学与社会、科学、技术、生活等密切相关,下列说法正确的是
A.“天和”核心舱腔体使用的氮化硼陶瓷基复合材料,氮化硼陶瓷属于新型无机非金属材料
B.在元素周期表中金属和非金属交界处寻找催化剂和耐高温、耐腐蚀的合金材料
C.利用CO2和H2合成淀粉有助于实现碳达峰、碳中和,该过程中C的化合价不变
D.载人飞船采用了刚性太阳能电池阵,将化学能转化为电能供飞船使用
2. 下列说法正确的是
A. 的名称:3-乙基-1,3-二丁烯 B. H2O的VSEPR结构模型为:
C. H2O2是由极性键和非极性键构成的非极性分子 D. 四氯化碳空间填充模型可表示为:
3.下列物质中不能用来鉴别乙醇和乙酸的是( )。
A.紫色石蕊溶液 B.溴水C.锌粒D.碳酸氢钠溶液
4.下列有关有机物的性质与应用对应关系正确的是
A. 葡萄糖含有醛基有还原性,可用于制银镜
B. 乙二醇易溶于水,可用作汽车防冻液
C. 乙炔有可燃性,可用于制导电聚乙炔
D. 苯的密度比水小,可用于萃取碘水中的碘
阅读下列资料,完成5~7题。
硫酸是重要的化工原料。稀硫酸具有酸的通性;浓硫酸具有吸水性、脱水性和强氧化性,能氧化大多数金属单质和部分非金属单质。金属冶炼时产生的含SO2废气经回收处理、催化氧化、吸收后可制得硫酸。
2SO2(g)+O2(g) 2SO3(g);ΔH=-196.6 kJ·ml-1
工业制硫酸尾气中的SO2可用氨水吸收,吸收液经处理后释放出的SO2又可循环利用。
5. 下列有关SO2、SO3、SOeq \\al(\s\up1(2-),\s\d1(4))、H2SO4的说法正确的是
A. SO2转化为SO3时没有破坏共价键
B. SO3的空间构型为三角锥形
C. 硫酸的结构为: ,可以推测H2SO4分子间能形成氢键
D SOeq \\al(\s\up1(2-),\s\d1(4))与SO3中的键角相等
6. 在指定条件下,下列选项所示的物质间转化能实现的是
A. 浓H2SO4 eq \(――→,\s\up7(Cu(s)),\s\d5(△)) SO2(g) B. 稀H2SO4(aq) eq \(――→,\s\up7(蔗糖(s))) C(s)
C. FeS2(s) eq \(――→,\s\up7(O2(g)),\s\d5(高温)) SO3(g) D. SO2(g) eq \(――→,\s\up7(氨水)) (NH4)2SO4(aq)
7. 对于反应2SO2(g)+O2(g)2SO3(g),下列说法正确的是
A. 反应的ΔS>0
B. 反应的平衡常数可表示为K= eq \f(c2(SO2)·c(O2),c2(SO3))
C. 增大体系的压强能提高SO2的反应速率和转化率
D. 使用催化剂能改变反应路径,提高反应的活化能
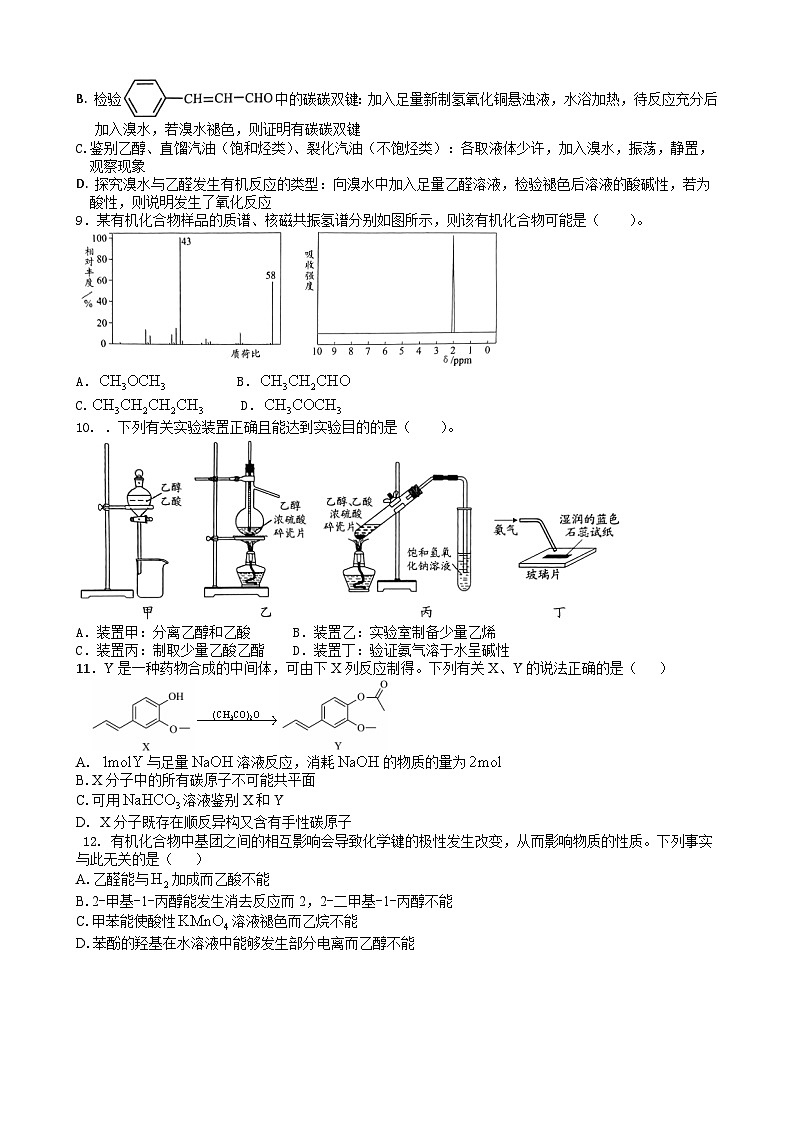
8. 下列有关溴水的实验方案设计正确的是
A. 除去苯中的苯酚:加入浓溴水后过滤
B. 检验中的碳碳双键:加入足量新制氢氧化铜悬浊液,水浴加热,待反应充分后加入溴水,若溴水褪色,则证明有碳碳双键
C.鉴别乙醇、直馏汽油(饱和烃类)、裂化汽油(不饱烃类):各取液体少许,加入溴水,振荡,静置,观察现象
D. 探究溴水与乙醛发生有机反应的类型:向溴水中加入足量乙醛溶液,检验褪色后溶液的酸碱性,若为酸性,则说明发生了氧化反应
9.某有机化合物样品的质谱、核磁共振氢谱分别如图所示,则该有机化合物可能是( )。
A. B.
C. D.
10. .下列有关实验装置正确且能达到实验目的的是( )。
A.装置甲:分离乙醇和乙酸 B.装置乙:实验室制备少量乙烯
C.装置丙:制取少量乙酸乙酯 D.装置丁:验证氨气溶于水呈碱性
11.Y是一种药物合成的中间体,可由下X列反应制得。下列有关X、Y的说法正确的是( )
A. 与足量溶液反应,消耗的物质的量为
B.X分子中的所有碳原子不可能共平面
C.可用溶液鉴别X和Y
D. X分子既存在顺反异构又含有手性碳原子
12. 有机化合物中基团之间的相互影响会导致化学键的极性发生改变,从而影响物质的性质。下列事实与此无关的是( )
A.乙醛能与加成而乙酸不能
B.2-甲基-1-丙醇能发生消去反应而2,2-二甲基-1-丙醇不能
C.甲苯能使酸性溶液褪色而乙烷不能
D.苯酚的羟基在水溶液中能够发生部分电离而乙醇不能
13. 是一种有机烯醚,可由链烃A通过下列路线制得,下列说法正确的是( )
A.A的结构简式是
B. ①②③的反应类型分别为加成反应、取代反应、消去反应
C.该有机烯醚不能发生加聚反应
D. B中含有的官能团有碳溴键、碳碳双键
非选择题(61分)
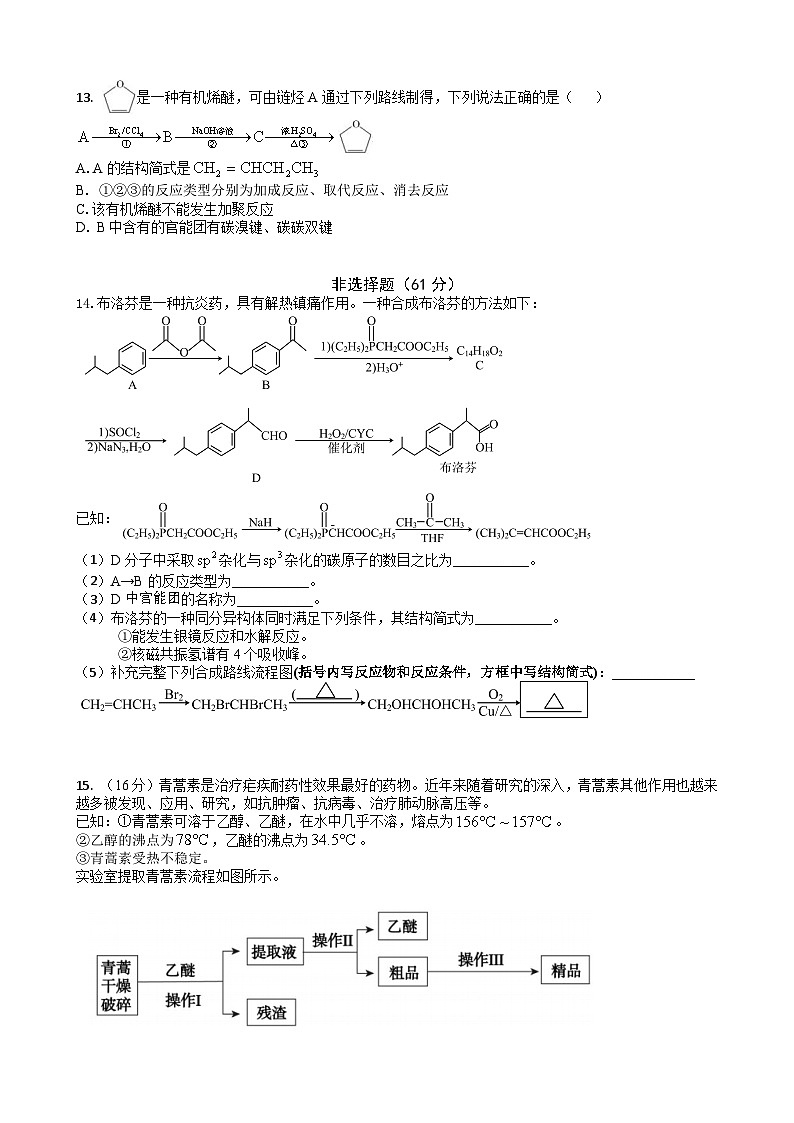
14.布洛芬是一种抗炎药,具有解热镇痛作用。一种合成布洛芬的方法如下:
已知:
(1)D分子中采取杂化与杂化的碳原子的数目之比为___________。
(2)A→B的反应类型为___________。
(3)D中官能团的名称为___________。
(4)布洛芬的一种同分异构体同时满足下列条件,其结构简式为___________。
①能发生银镜反应和水解反应。
②核磁共振氢谱有4个吸收峰。
(5)补充完整下列合成路线流程图(括号内写反应物和反应条件,方框中写结构简式):____________
15. (16分)青蒿素是治疗疟疾耐药性效果最好的药物。近年来随着研究的深入,青蒿素其他作用也越来越多被发现、应用、研究,如抗肿瘤、抗病毒、治疗肺动脉高压等。
已知:①青蒿素可溶于乙醇、乙醚,在水中几乎不溶,熔点为。
②乙醇的沸点为,乙醚的沸点为。
③青蒿素受热不稳定。
实验室提取青蒿素流程如图所示。
(1)实验前要对青蒿进行粉碎,其目的是___________。用乙醚提取青蒿素的效果比乙醇好,原因是___________。
(2)操作Ⅰ在索氏提取器中(如图所示)进行,实验时烧瓶中溶剂受热蒸发,蒸汽沿蒸汽导管2上升至装置a,冷凝后滴入滤纸套筒1中,与青蒿粉末接触,进行萃取。萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现对青蒿粉末的连续萃取。
①装置a的名称为___________。
②索氏提取的青蒿素位于___________。(填“圆底烧瓶”或“索氏提取器”)中;与常规的萃取相比,索氏提取的优点是___________。
(3)操作Ⅱ选用下图哪种装置更好___________。(填字母),原因是___________。
甲 乙
(4)操作Ⅲ的过程可能是___________。(填字母)。
a.加水溶解、蒸发浓缩、冷却结晶
b.加70%的乙醇溶解、水浴加热、冷却结晶、过滤
c.加入乙醚进行萃取分液
(5)在一定条件下,可对青蒿素分子结构进行修饰,如图所示。
从结构与性质关系的角度推测双氢青蒿素比青蒿素的水溶性、疗效更好的原因:___________。
16.(15分)化合物H是制备药物洛索洛芬钠的关键中间体,其一种合成路线如下:
(1)A→B的反应类型为___________。
(2)C分子中碳原子杂化轨道类型是___________ 。
(3)G的结构简式为___________。
(4)F的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:___________。
① 分子中含有苯环;
② 碱性条件下完全水解生成两种产物,酸化后分子中均含有4种不同化学环境的氢。
(5)设计以苯乙醇( )为原料制备的合成路线(无机试剂任用,合成路线示例见本题题干) _______。
17.苯甲酸是重要的有机合成中间体,用于制备染料、药物等。下面是两种制备苯甲酸的方法。
Ⅰ .苯甲醛自身氧化还原法
向反应容器中加入溶液和苯甲醛,加热,充分反应后冷却,用乙醚萃取、分液。向水层中加入足量盐酸,冷却、抽滤、纯化,得产品。
已知:相关物质的物理性质如下表
(1)已知 与溶液反应生成 和。则2ml 发生该反应时转移电子数目为___________。
(2)不使用试纸或其他试剂,判断盐酸已足量的实验方法是___________。
Ⅱ.高锰酸钾氧化法
步骤1:向图-1所示三口瓶中依次加入甲苯(约)、水和(约)高锰酸钾,开启搅拌器,加热回流。
步骤2:反应完全后,冷却,加入适量饱和亚硫酸氢钠溶液,充分反应后将混合物趁热过滤。滤液用冰水冷却后,用浓盐酸酸化、过滤、洗涤、干燥,得产品。
已知:盐酸可被酸性高锰酸钾溶液氧化并生成氯气 。
(3)写出步骤1中生成 、KOH和的化学方程式:___________。
(4)判断步骤2中甲苯反应完全的实验现象是___________。加入适量饱和亚硫酸氢钠溶液的原因是___________。
(5)已知在强碱性溶液中稳定存在,向碱性溶液中加酸会生成和,时反应趋于完全。补充完整制取晶体的实验方案:
将一定量与稍过量混合熔融,加入一定量,加热条件下迅速搅拌制得墨绿色固体混合物(和),将混合物溶于水,___________,得晶体。(实验中可选用试剂:冰水、。部分物质溶解度曲线如图-2所示)
名称
熔点℃
沸点/℃
水溶性
苯甲醛
-26
178
微溶
苯甲酸
122
249
微溶
苯甲醇
-15
205
微溶
相关试卷
这是一份江苏省扬州市扬州大学附属中学东部分校2023-2024学年高二下学期第一次月考 化学试卷,文件包含高二化学第一次月考答案docx、高二化学第一次月考试卷docx等2份试卷配套教学资源,其中试卷共9页, 欢迎下载使用。
这是一份江苏省扬州大学附属中学东部分校2023-2024学年高二上学期期中考试化学试卷,文件包含高二化学选修试卷最新docx、高二化学选修答案最新docx等2份试卷配套教学资源,其中试卷共9页, 欢迎下载使用。
这是一份江苏省扬州大学附属中学东部分校2023-2024学年高一上学期期中考试 化学试卷,文件包含2023高一化学期中试卷pdf、2023高一化学期中答案docx等2份试卷配套教学资源,其中试卷共7页, 欢迎下载使用。








