






所属成套资源:人教版(2024)九年级化学上册全册课件
人教版(2024)第三单元 物质构成的奥秘课题2 原子结构课文ppt课件
展开
这是一份人教版(2024)第三单元 物质构成的奥秘课题2 原子结构课文ppt课件,共39页。PPT课件主要包含了新课引入,带正电,不带电,带负电,原子的结构,新课讲授,课堂练习,离子形成过程,阳离子,阴离子等内容,欢迎下载使用。
1911年,卢瑟福用一束带正电的、质量比电子大得多的高速运动的α粒子轰击金箔,发现:①大多数α粒子能穿透金箔而不改变原来的运动方向;②一小部分α粒子改变了原来的运动方向;③有极少数α粒子被弹了回来。
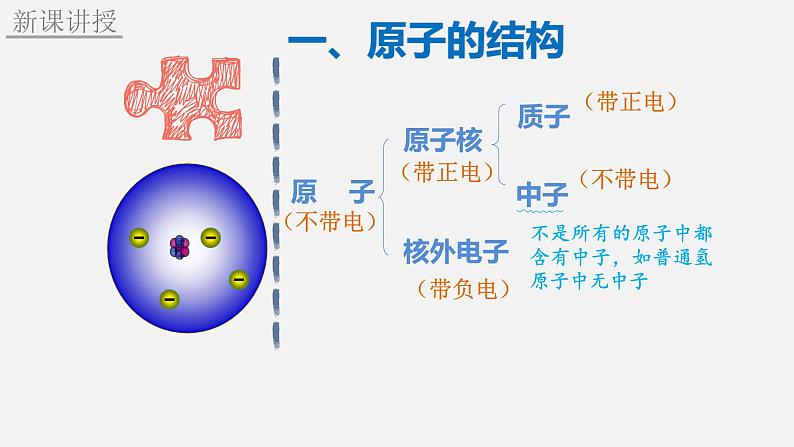
原子的构成 相对原子质量
易错提示:1. 原子可以再分, 原子是化学变化中的最小粒子,在化学变化中不能再分。2 . 质子带正电荷,电子带负电荷,原子呈电中性。
2. 原子的结构特点(1) 原子中,原子核的体积很小,电子在核外相对较大的空间运动。(2) 原子中,质子和中子的质量近似相等,电子的质量很小,约是质子质量的1/1836,可以忽略不计,原子的质量主要集中在原子核上。
1.下列说法中,正确的是( )A.原子是化学变化中的最小粒子B.原子核内一定含有质子和中子C.分子是保持物质性质的最小粒子D.相对原子质量就是原子的实际质量
2.下列说法正确的是( )A.原子是由原子核和核外电子构成的B.一切原子都是由质子和中子构成的C.一切原子都包含着质子、中子和核外电子D.原子中不存在带电荷的粒子,所以原子不显电性
1. 在原子中,核电荷数= 质子数= 核外电子数。2. 原子核所带正电荷数等于核外电子所带负电荷数,原子不显电性。
特别提醒:原子中,质子数与电子数一定相等,与中子数不一定相等。
1.一种氟原子的原子核内有9个质子和10个中子,该原子的核外电子数为( ) A.7 B.9 C.10 D.19
2.一种氢原子的原子核内有1个质子和2个中子,该原子的核外电子数是( ) A.1 B.2 C.3 D.4
1. 核外电子的分层排布(1) 电子层:科学家们将电子经常出现的区域称为电子层。离核最近的称为第一电子层,依次有第二、三、四、五、六、七电子层,离核最远的又称为最外电子层。
(2) 电子在原子核外是分层运动的,能量低的电子在离核较近的区域运动,能量高的电子在离核较远的区域运动。核外电子的分层运动又称为分层排布。
(3) 核外电子的排布规律(电子数不大于18 的) :第一电子层上最多容纳2 个电子,第二电子层上最多排8 个电子,但最外层最多排8 个电子,即:各电子层上的电子数最多为2n2 个(n 为电子层数) 。
易错提示:1. 一般来讲,金属原子的最外层电子数少于4个,但最外层电子数少于4的原子不一定是金属原子,如氦原子、氢原子。2. 原子的化学性质与最外层电子数关系密切,但是最外层电子数相同的原子化学性质不一定相似,如氦与镁;化学性质相似的原子最外层电子数也不一定相同,如氦与氖。
2. 原子结构示意图原子结构示意图可以直观地反映原子核外电子的排布情况,如:
3. 相对稳定结构有多个电子层的,最外层有8 个电子的结构(只有一个电子层的,最外层有2 个电子的结构) 称为相对稳定结构。
结论:元素的化学性质主要决定于原子的最外层电子数。
4. 原子结构与原子化学性质之间的关系
1.如图为硫原子的原子结构示意图。下列说法不正确的是( )
A.硫原子的质子数为16B.硫原子在化学变化中易失电子C.硫原子的第二层电子数为8D.硫原子核外有3个电子层
最外层8个电子,达到稳定
失去 1个电子
失去 2个电子
失去 3个电子
金属原子 阳离子
得到 3个电子
非金属原子 阴离子
最外层8个电子,达到稳定结构
1. 定义带电的原子(或原子团) 称为离子。
2. 分类阳离子:带正电的原子(或原子团)阴离子:带负电的原子(或原子团)
3. 离子的形成。原子得失电子后形成离子。原子得到电子后形成阴离子,原子失去电子后形成阳离子。4. 离子可以构成物质。如氯化钠由氯离子和钠离子构成,氯化钾由氯离子和钾离子构成。
⑴用离子符号来表示离子。
氢离子 钠离子 钾离子 镁离子 铝离子
H+ Na+ K+ Mg2+ Al3+
F- Cl- O2- S2-
氟离子 氯离子 氧离子 硫离子
练习:画出常见离子K+ Na+ O2-的结构示意图
OH- NO3- SO42- 氢氧根离子 硝酸根离子 硫酸根离子 CO32- NH4+ 碳酸根离子 铵根离子
氯酸根离子 高锰酸根离子 锰酸根离子 磷酸根离子
ClO3- MnO4- MnO42- PO43-
K2MnO4
易错提示:离子的写法及意义:1. 离子的写法:在元素符号右上角标明离子所带的电荷数及电性,数值在前,正、负号在后。2. 离子的意义:离子符号前面的数字表示离子的个数;元素符号右上角的数字表示一个离子所带的电荷数。
6. 原子和离子的区别与联系:
7. 分子、原子、离子及物质之间的联系:
1.下列各粒子的结构示意图中,表示阴离子的是( )
2.已知下列粒子结构示意图如图所示,下列说法正确的是( )
A.它们都是原子 B.它们都是稳定结构C.它们都是离子 D.它们表示同一种元素
3..微粒观是重要的化学思想。下列关于四种原子的结构示意图说法正确的是 ( )
A.4种原子核外都有3个电子层 B.④在化学反应中易失去电子 C.③中x可能为8 D.②和④的化学性质相似
4.(1) 已知某原子的结构示意图如下:Ca: , 它核外有 ____个电子层, 核内有____个质子,在化学反应中易 ____ (填“得”或“失”) 电子,形成离子的符号为 ______ 。
(2) 符号“3Al 3+ ”中“3”的意义不同。前面的“3”表示________________________,右上角的“3”表示 _______________________________________ 。(3) Fe2+ 中“2”表示 ___________________________。
1 个铝离子带3 个单位正电荷
1 个亚铁离子带2 个单位正电荷
5.分子、原子、离子都是构成物质的微粒,下列物质由离子直接构成的是( ) A.氯化钠 B.氧气 C.水D.二氧化碳
6.下列有关分子、原子和离子的说法正确的是( )A.在化学反应中,分子不能再分B.分子、原子、离子都可以直接构成物质C.加碘食盐的主要成份是氯化钠,氯化钠是由氯化钠离子构成的D.物体有热胀冷缩现象,主要是因为物体中的粒子大小随温度的改变而改变
1. 定义:相对原子质量是以一种碳原子质量的1/12 为标准,其他原子的质量与它相比较所得的比。符号为:Ar。
2. 相对原子质量的计算方法:(1) 某种原子的相对原子质量(2) 相对原子质量≈质子数+ 中子数。
特别提醒:1. 相对原子质量的单位是“1”,常略去不写,所以看起来是一个数值,而原子质量的单位是“g”或“kg”。2. 原子的实际质量越大,相对原子质量就越大。
3. 相对原子质量与原子实际质量的对比
1.我国第一艘自主建造的航母“山东舰”在建造时用到了大量钛合金,钛原子的质子数为22,相对原子质量为48,则钛原子的中子数、核外电子数分别为( ) A.26、22B.22、26 C.48、22D.70、26
相关课件
这是一份初中化学第三单元 物质构成的奥秘课题2 原子结构教案配套ppt课件,共24页。PPT课件主要包含了相对原子质量等内容,欢迎下载使用。
这是一份化学第三单元 物质构成的奥秘课题2 原子结构课文配套ppt课件,共32页。PPT课件主要包含了原子的构成,带负电,带正电,不带电,原子核,电子数,电子的自白,分层排布,电子分层排布的规律,原子结构示意图等内容,欢迎下载使用。
这是一份人教版(2024)九年级上册(2024)课题2 原子结构课前预习课件ppt,共40页。PPT课件主要包含了原子结构研究发展史,原子的构成,分层排布,原子结构示意图的意义,核电荷数,原子核,电子层,电子数,讨论归纳,原子的实际质量等内容,欢迎下载使用。











