


河北省衡水市阜城县2024-2025学年高二上学期11月月考 化学试题
展开
这是一份河北省衡水市阜城县2024-2025学年高二上学期11月月考 化学试题,文件包含高二10月份化学试卷docx、高二10月份化学试卷答案docx、高二化学答题卡docx等3份试卷配套教学资源,其中试卷共18页, 欢迎下载使用。
2024年10月28日xx学校高中化学试卷
学校:___________姓名:___________班级:___________考号:___________
一、单选题
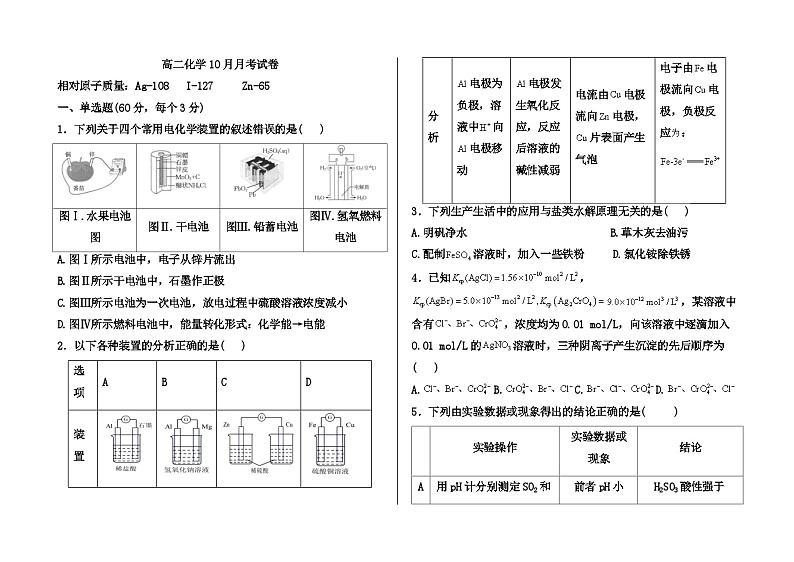
1.下列关于四个常用电化学装置的叙述错误的是( )
A.图Ⅰ所示电池中,电子从锌片流出
B.图Ⅱ所示干电池中,石墨作正极
C.图Ⅲ所示电池为一次电池,放电过程中硫酸溶液浓度减小
D.图Ⅳ所示燃料电池中,能量转化形式:化学能→电能
1.答案:C
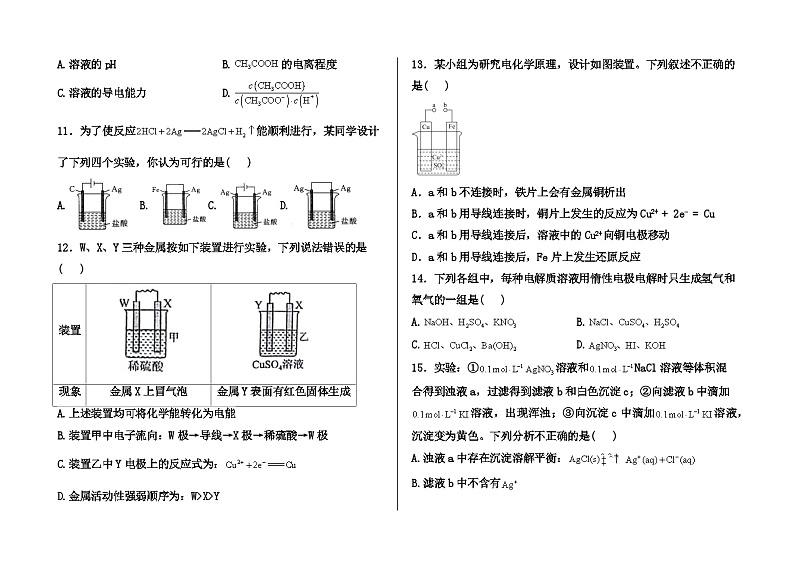
解析:
2.以下各种装置的分析正确的是( )
A.AB.BC.CD.D
2.答案:B
解析:A.铝较为活泼,失去电子发生氧化反应,为负极,溶液中向正极石墨电极移动,A错误;
B.总反应为铝和氢氧化钠生成偏铝酸钠和氢气,故反应后溶液的喊性减氺,B正确;
C.没有形成内电路,不能形成原电池,C错误;
D.铁较活泼失去电子发生氧化反应生成亚铁离子,错误。
故选B。
3.下列生产生活中的应用与盐类水解原理无关的是( )
A.明矾净水B.草木灰去油污
C.配制溶液时,加入一些铁粉D.氯化铵除铁锈
3.答案:C
解析:A.明矾是发生水解生成氢氧化铝胶体,氢氧化铝胶体吸附悬浮在水中固体小颗粒,胶体聚沉,达到净水的目的,明矾净水与盐类水解有关,A不符合题意;
B.草木灰中含有,水解使溶液显碱性,油污在碱性溶液中水解成可溶于水的物质,草木灰去油污与盐类水解有关,B不符合题意;
C.易被氧化为,向配制的FeSO4溶液中加入铁粉是为了防止被氧化为,该现象和盐类水解无关,C符合题意;
D.氯化铵溶液因水解使氯化铵溶液显酸性,铁锈为,能与反应,生成,氯化铵除铁锈与盐类水解有关,D不符合题意;
故选C。
4.已知,,某溶液中含有,浓度均为0.01 ml/L,向该溶液中逐滴加入0.01 ml/L的溶液时,三种阴离子产生沉淀的先后顺序为( )
A.B.C.D.
4.答案:C
解析:浓度均为0.01 ml/L的形成沉淀时,所需分别为、、,所需越小,越先生成沉淀,所以三种阴离子产生沉淀的先后顺序为。
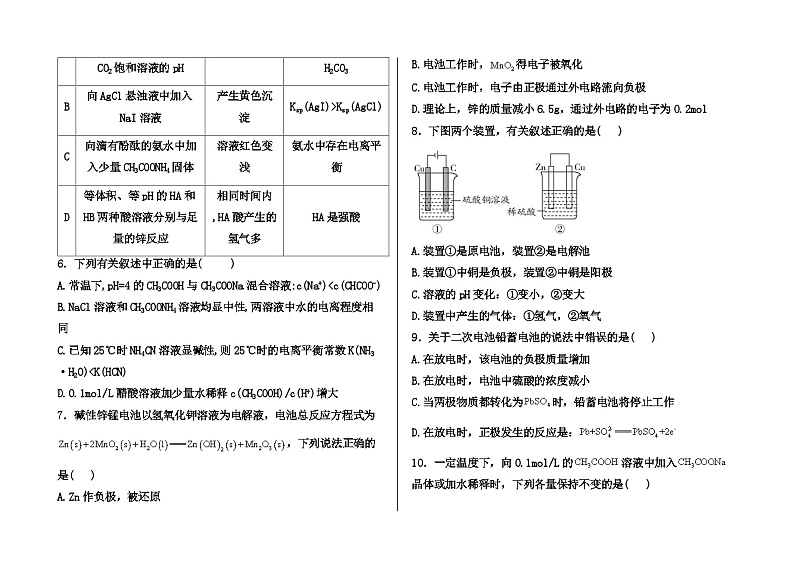
5.下列由实验数据或现象得出的结论正确的是( )
A.A B.B C.C D.D
5.答案:C
解析:
6.下列有关叙述中正确的是( )
A.常温下,pH=4的CH3COOH与CH3COONa混合溶液中:c(Na+)Y
12.答案:B
解析:A.根据分析,甲和乙两种装置均为原电池装置,均可将化学能转化为电能,A正确;
B.甲装置中X为正极,W为负极,电子由W极流出,沿导线流向X极,电子不能通过电解质溶液,B错误;
C.乙装置中Y表面有红色固体生成,Y为正极,电极反应为:,C正确;
D.根据分析,金属活动性强弱顺序为:,D正确;
13.某小组为研究电化学原理,设计如图装置。下列叙述不正确的是( )
A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为Cu2+ + 2e− = Cu
C.a和b用导线连接后,溶液中的Cu2+向铜电极移动
D.a和b用导线连接后,Fe片上发生还原反应
13.答案:D
解析:
14.下列各组中,每种电解质溶液用惰性电极电解时只生成氢气和氧气的一组是( )
A.B.
C.D.
14.答案:A
解析:A项,根据放电顺序,阳极上比优先放电,比优先放电,所以电解溶液时只生成氢气和氧气,正确;B项,电解NaCl溶液时生成和NaOH,电解溶液时生成和,错误;C项,电解HCl溶液时生成和,电解溶液时生成Cu和,错误;D项,电解溶液时生成和,电解HI溶液时生成和,错误。
15.实验:①溶液和NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;②向滤液b中滴加溶液,出现浑浊;③向沉淀c中滴加溶液,沉淀变为黄色。下列分析不正确的是( )
A.浊液a中存在沉淀溶解平衡:
B.滤液b中不含有
C.③中颜色变化说明AgCl转化为AgI
D.实验可以证明AgI比AgCl更难溶
15.答案:B
解析:A项,在浊液a中,存在AgCl的沉淀溶解平衡,正确;B项,在滤液b中,仍含有少量,故在b中加入KI溶液出现浑浊,错误;由于AgI比AgCl更难溶,向c中加入溶液,能发生沉淀的转化,生成黄色的AgI沉淀,C项和D项都正确。
16.时,在含有固体的饱和溶液中存在着平衡(,加入KI固体,下列说法正确的是( )
A.溶液中和的浓度都增大
B.溶度积常数增大
C.沉淀溶解平衡向右移动
D.溶液中的浓度减小
16.答案:D
解析:含有固体的饱和溶液中存在着平衡:,加入,增大,沉淀溶解平衡向左移动,减小,故选项错误,D选项正确。溶度积常数只与温度有关,改变,不变,故B选项错误。
17.化工生产中常用MnS作为沉淀剂除去工业废水中:,下列说法错误的是( )
A.MnS的比CuS的大
B.该反应达平衡时
C.往平衡体系中加入少量固体后,变大
D.该反应的平衡常数K=
17.答案:B
解析:
18.已知时,,。在该温度下,下列判断正确的是( )
A.向AgCl浊液中滴入KBr溶液,沉淀变成浅黄色,说明
B.向饱和AgCl溶液中加入NaCl溶液,减小
C.向的悬浊液中加入少量的固体,增大
D.固体在氨水中的比在溶液中的小
18.答案:C
解析:AgCl与AgBr沉淀类型相同,根据沉淀转化规律:沉淀类型相同时,溶解度大的难溶物可转化为溶解度更小的难溶物,则,A错误;只受温度影响,向饱和AgCl溶液中加入NaCl溶液,不变,B错误;与结合生成,使的沉淀溶解平衡正向移动,增大,C正确;只受温度影响,固体在氨水中的和在溶液中的一样,D错误。
19.下列说法正确的是( )
A.常温下,pH为1的溶液与溶液恰好完全反应时,溶液中一定存在:
B.相同浓度的和溶液混合后,溶液中各离子浓度的大小关系为:
C.溶液中
D.常温下,pH=7的和混合溶液中:
19.答案:A
解析:A.常温下,pH为1的溶液中,,则HA为强酸溶液,与溶液恰好完全反应时,溶液中溶质为强电解质,溶液呈中性,和来自于水且,故A正确;
B.相同浓度时酸性:,即电离程度大于,即;相同浓度的和溶液混合后,水解程度:,溶液中,故B错误;
C.溶液中含有,电荷守恒式,故C错误;
D.,溶液呈中性,,和混合溶液,,溶液中各离子浓度的大小关系为:,故D错误。
答案选A。
20.在如图串联装置中,通电片刻即发现乙装置左侧电极表面出现红色固体。下列说法不正确的是( )
A.乙中左侧电极反应式为
B.电解过程中丙中溶液酸碱性无变化
C.向甲中加入适量的盐酸,可使溶液恢复到电解前的状态
D.标准状况下当甲中产生4.48L气体时,丙中Cu电极质量增加21.6g
20.答案:C
解析:该装置外接电源,为电解池装置,通电片刻即发现乙装置左侧电极表面出现红色固体,说明发生反应:,A正确;乙装置左侧电极为电解池阴极,右侧为阳极;电源左侧为负极,右侧为正极;在丙装置中阳极发生失电子反应,阳极电极反应式为,阴极电极反应式为,所以电解过程中丙中溶液酸碱性无变化,B正确;甲装置中阳极电极反应为,阴极电极反应为,相当于从溶液中逸出HCl气体,若加入盐酸,则多加了水,会导致KCl溶液浓度减小,C错误;标准状况下当甲中产生4.48L气体时,两极各产生0.1ml气体,转移电子数0.2ml,其中Cu电极上银离子得电子产生银单质,转移0.2ml电子时有0.2mlAg生成,则Cu电极增重,D正确。
二、填空题
21.印刷铜电路板废液主要含、以及少量的等物质,以废液为原料制备,实现资源回收再利用,流程如下图所示。回答下列问题:
(1)粗溶液的制备
上述流程中粉碎的目的_______。
(2)溶液的精制
ⅰ.经检验,粗溶液含有。
ⅱ.向粗溶液滴加的溶液,当溶液中完全氧化后,加粉末调节溶液的。
ⅲ.将溶液加热至沸腾,趁热减压过滤,得到精制溶液。
①用离子方程式说明加入溶液的作用:_______。
②已知:25℃时,,饱和溶液中的物质的量浓度为。ⅱ中调节溶液,请回答此时是否开始沉淀_______(填“是”或“否”)。
(3)工业生产中也可采用电解的方法由制得,装置如图所示。
①与直流电源a端相连的电极材料是_______(填“铜片”或“石墨”)
②电解池的总反应的化学方程式_______。
21.答案:(1)增大固液接触面,提高反应速率
(2);
否,,此时无沉淀
(3)铜片;
解析:(1)上述流程中粉碎的目的为增大固液接触面,提高反应速率,提高浸取效率;
(2)①过氧化氢具有氧化性,能将亚铁离子氧化为铁离子利于铁离子的后续除去,同时生成水,作用:。②溶液,pOH=10,则,,此时无沉淀;
(3)从硫酸根离子的迁移方向看,左侧电极为阳极,则a为正极,b为负极。
①由Cu制得,Cu应作阳极发生氧化反应转化为铜离子,则铜与直流电源a端(正极)相连;
②阳极铜失去电子发生氧化反应生成铜离子、阴极氢离子得到电子发生还原反应生成氢气,则总反应:;
22.A、B、C、D均为石墨电极,E、F为两种活泼金属,这两种金属元素均位于短周期,且位置相邻,E能与溶液反应。按图示接通线路,反应一段时间。
(1)判断装置的名称:甲池为_______(填“电解池”或“原电池”,下同),乙池为_______。
(2)F极为_______(填“正极”“负极”“阳极”或“阴极”),电极反应式为_______;B极为_______(填“正极”“负极”“阳极”或“阴极”),电极反应式为_______。
(3)溶液会变蓝的是_______(填“a”或“b”),U形管中先变红的是_______(填“C”或“D”)极附近的溶液,U形管中发生的总反应为_______。
(4)已知烧杯和U形管中的溶液均足量,当烧杯中有生成时,甲池中溶液的质量会减少________。
22.答案:(1)电解池;原电池
(2)正极;;阴极;
(3)a;D;
(4)12
解析:(1)该整套装置为原电池与电解池连接的装置,由题意知E为,F为,则乙池为原电池,甲池为电解池。
(2)根据分析可知,E为,则E极为负极,F极为正极,正极上得电子生成H2,故正极的电极反应式为;
A连接正极,即A极为阳极,故B极为阴极,阴极上得电子生成,电极反应式为。
(3)D是阴极,该电极上会产生氢气,所以中冒气泡,则D电极周围有大量氢氧根离子,能使酚酞变红;a中是氯离子失电子产生氯气,能将碘离子氧化为单质遇到淀粉变蓝色,所以烧杯中溶液会变蓝的是a,故U形管内发生的反应为:;
故答案为:a;D;。
(4)D是阴极,根据,则的物质的量为,则转移电子的物质的量为,甲是电解池,B是碳且为阴极,发生反应为,A是阳极,发生反应为:,则甲池中溶液减少质量即为铜单质和氧气的质量,转移电子时,生成的铜,其质量为,同时生成氧气的物质的量,则氧气的质量,则甲池中溶液的质量会减少。
23.依据原电池原理,清回答下列问题.
(1)微型锌银电池可用作电子仪器的电源,其电极分别是和,电解质溶液为溶液,电池总反应为.负极发生的电极反应式为_________________________,电池工作过程中,电解液中向____________(填“”或“”)极迁移.
(2)以为电极,可以组装如图所示原电池装置.
①若电解质溶液为稀硫酸,上发生的电极反应式为_____________________________.
②若电解质溶液为溶液,上发生的电极反应式为_____________________________.
(3)图丙为氢氧燃料电池的构造示意图,电解质溶液的溶质是。通氢气一极的电极反应式为:___________。
23答案(1)由总反应可知,锌失去电子发生氧化反应生成氢氧化锌,为负极,;原电池中阴离子向负极迁移,故电池工作过程中,电解液中向极迁移。
(2)①若电解质溶液为稀硫酸,Mg失去电子发生氧化反应,为负极,发生的电极反应式为。
②若电解质溶液为溶液,镁不能和氢氧化钠反应,Al失去电子发生氧化反应,为负极,发生的电极反应式为;
(3)氢氧燃料电池,电解质溶液的溶质是,通氢气一极为负极,电极反应式为:;
图Ⅰ.水果电池图
图Ⅱ.干电池
图Ⅲ.铅蓄电池
图Ⅳ.氢氧燃料电池
选项
A
B
C
D
装置
分析
电极为负极,溶液中向电极移动
电极发生氧化反应,反应后溶液的碱性减弱
电流由电极流向电极,片表面产生气泡
电子由电极流向电极,负极反应:
实验操作
实验数据或现象
结论
A
用pH计分别测定SO2和CO2饱和溶液的pH
前者pH小
H2SO3酸性强于H2CO3
B
向AgCl悬浊液中加入NaI溶液
产生黄色沉淀
Ksp(AgI)>Ksp(AgCl)
C
向滴有酚酞的氨水中加入少量CH3COONH4固体
溶液红色变浅
氨水中存在电离平衡
D
等体积、等pH的HA和HB两种酸溶液分别与足量的锌反应
相同时间内,HA酸产生的氢气多
HA是强酸
装置
现象
金属X上冒气泡
金属Y表面有红色固体生成
相关试卷
这是一份河北省衡水市阜城实验中学2024-2025学年高一上学期11月月考 化学试题,共7页。试卷主要包含了选择题,填空题等内容,欢迎下载使用。
这是一份河北省衡水市武强中学2024-2025学年高二上学期期中考试 化学试题,文件包含河北省衡水市武强中学2024-2025学年高二年级上学期期中考试化学试题docx、高二化学答题卡pdf、高二化学答案docx等3份试卷配套教学资源,其中试卷共13页, 欢迎下载使用。
这是一份河北省衡水市武强中学2024-2025学年高一上学期期中考试 化学试题,文件包含河北省衡水市武强中学2024-2025学年高一年级上学期期中考试化学试题docx、高一化学答题纸pdf、高一化学答案docx等3份试卷配套教学资源,其中试卷共13页, 欢迎下载使用。









