
河北省衡水市阜城实验中学2024-2025学年高一上学期11月月考 化学试题
展开
这是一份河北省衡水市阜城实验中学2024-2025学年高一上学期11月月考 化学试题,共7页。试卷主要包含了选择题,填空题等内容,欢迎下载使用。
1.下列物质属于电解质的是
A.CuB.盐酸C.KNO3D.NaOH溶液
2.下列变化需加还原剂才能完成的是
A.B.C.D.
3..分类法是学习化学的重要方法。下列物质对应的分类标准正确的是
A.AB.BC.CD.D
4.下列化学反应中,不属于氧化还原反应的是
A.Cl2+H2OHCl+HClO
B.2Na2O2+2CO2=2Na2CO3+O2
C.NH4ClNH3↑+HCl↑
D.MnO2+2Cl-+4H+Mn2++Cl2↑+2H2O
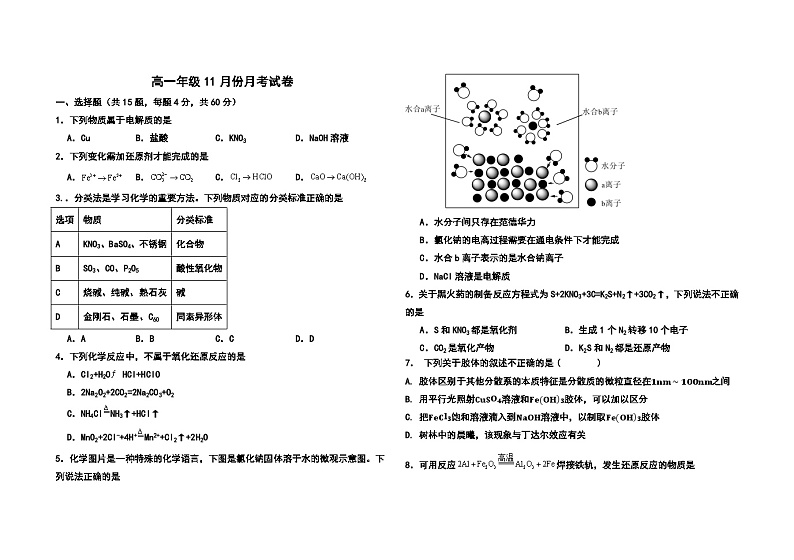
5.化学图片是一种特殊的化学语言,下图是氯化钠固体溶于水的微观示意图。下列说法正确的是
A.水分子间只存在范德华力
B.氯化钠的电离过程需要在通电条件下才能完成
C.水合b离子表示的是水合钠离子
D.NaCl溶液是电解质
6.关于黑火药的制备反应方程式为S+2KNO3+3C=K2S+N2↑+3CO2↑,下列说法不正确的是
A.S和KNO3都是氧化剂B.生成1个N2转移10个电子
C.CO2是氧化产物D.K2S和N2都是还原产物
7. 下列关于胶体的叙述不正确的是( )
A. 胶体区别于其他分散系的本质特征是分散质的微粒直径在1nm∼100nm之间
B. 用平行光照射CuSO4溶液和Fe(OH)3胶体,可以加以区分
C. 把FeCl3饱和溶液滴入到NaOH溶液中,以制取Fe(OH)3胶体
D. 树林中的晨曦,该现象与丁达尔效应有关
8.可用反应焊接铁轨,发生还原反应的物质是
A.AlB.Fe2O3C.Al2O3D.Fe
9.下列电离方程式中,正确的是
A.硫酸钠溶液:B.碳酸氢钠溶液:
C.硫酸铝溶液:D.氯化铁溶液:
10.已知反应:①;②;③。下列说法错误的是
A.还原性:
B.反应①中氧化产物和还原产物的个数比为5∶2
C.反应②中作氧化剂,反应③中为还原产物
D.可以发生反应:
11.下列指定反应的离子方程式书写正确的是
A.用小苏打治疗胃酸过多:CO+2H+=CO2↑+H2O
B.用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
C.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2OFe(OH)3(胶体)+3H+
D.向澄清石灰水中滴加少量NaHCO3溶液:Ca2++2OH-+2HCO=CaCO3↓+CO+2H2O
12.在酸性溶液中能大量共存的离子组是
A.B.
C.D.
13. 下列电子转移的表示方法中正确的是( )
A. B.
C. D.
14. 下列各组中两稀溶液间的反应可以用同一个离子方程式表示的是( )
A. H2SO4溶液(足量)与K2CO3溶液;HNO3溶液(足量)与Na2CO3溶液
B. CH3COOH溶液与KOH溶液;HCl溶液与NaOH溶液
C. BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与(NH4)2SO4溶液
D. H2SO4溶液与NaOH溶液;H2SO4溶液与Ba(OH)2溶液
15.向稀硫酸中滴入几滴酚酞溶液,然后匀速逐滴加入溶液,测得混合溶液的导电能力随时间变化的曲线如图。下列说法正确的是
A.ab段溶液的导电能力不断减弱,说明化学反应的生成物均为非电解质
B.O~t时刻发生反应的离子方程式为
C.溶液从t时刻之后开始慢慢变红色的原因:
D.用NaOH溶液代替重复上述实验,溶液导电能力随时间的变化与题图相同
二、填空题(共2题,40分)
16.完成下列问题。(20分)
Ⅰ.现有下列十种物质:①蔗糖 ②熔融NaCl ③盐酸 ④铜丝 ⑤NaOH固体 ⑥氧气 ⑦CuSO4固体 ⑧乙醇 ⑨KNO3溶液 ⑩液态H2SO4
(1)上述状态下物质中可导电的是__________(填序号,下同)。
(2)上述状态下物质中不能导电,但属于电解质的是__________。
(3)上述物质中属于非电解质的是__________。
Ⅱ.某无色透明溶液中可能大量存在Na+、Mg2+、Ag+、Cu2+、Fe3+中的几种。请填写下列空白:
(4)不做任何实验就可以肯定原溶液中不存在的离子___________。
(5)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中,肯定存在的离子是___________。
(6)取(2)中的滤液,加入过量的氢氧化钠溶液,出现白色沉淀,说明原溶液中肯定有___________,有关的离子方程式为___________。
(7)原溶液可能大量存在的阴离子是___________。
A.Cl - B.NO3- C.CO32- D.OH-
(8)若原溶液为浅黄色透明溶液,则可判断溶液中还存在的离子有___________,往溶液中加入铜粉后,溶液因发生氧化还原反应而变成蓝绿色,其反应离子方程式为:___________。
17.完成下列问题。(20分)
Ⅰ.高铁酸钠(Na2FeO4)是一种新型绿色消毒剂,主要用于饮用水处理,工业上有多种制备高铁酸钠的方法,其中一种方法的化学反应原理可用离子方程式表示为3ClO-+2Fe3++xOH-=2FeO42-+3Cl-+yH2O。
(1)上述反应中氧化剂为_______;还原产物为_______。
(2)由上述反应可知,氧化性强弱:ClO-_______(填“>”或“<”,下同)FeO42-;还原性强弱:Cl-_______Fe3+。
(3)请配平上述方程式并用单线桥法表示该反应中电子的转移情况:_____________________。
Ⅱ.储氢纳米碳管研究成功体现了科技的进步,但用电弧法合成的纳米碳管常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,反应的化学方程式为:C+K2Cr2O7+H2SO4→CO2↑+K2SO4+Cr2SO43+H2O(未配平)。回答下列问题。
(4)该反应中,还原剂是__________(填化学式),被还原的元素是__________(填元素符号)。
(5)H2SO4在该反应中表现出___________(填字母)。
A.只有酸性 B.只有氧化性 C.酸性和氧化性 D.酸性和还原性
(6)配平上述方程式:__________。每生成2分子H2O,该反应转移________个电子。
1.【答案】C
【解析】A.是金属单质,既不是电解质又不是非电解质,故不选A;
B.盐酸是混合物,既不是电解质又不是非电解质,故不选B;
C.的水溶液能导电,是电解质,故选C;
D.溶液是混合物,既不是电解质又不是非电解质,故不选D;
选C。
2.【答案】A
【解析】A.过程中Fe元素化合价下降被还原,需要加入还原剂,A符合题意;
B.过程中没有元素化合价发生变化,不需要加入还原剂,B不符合题意;
C.和H2O反应生成HCl和HClO,该过程中Cl2既是氧化剂又是还原剂,过程中不需要加入还原剂,C不符合题意;
D.过程中没有元素化合价发生变化,不需要加入还原剂,D不符合题意;
故选A。
3.【答案】D
【解析】A.不锈钢是性能优良的铁合金,属于混合物,不是化合物,故A错误;
B.一氧化碳是不成盐氧化物,不是酸性氧化物,故B错误;
C.纯碱是碳酸钠的俗称,属于盐,不属于碱,故C错误;
D.金刚石、石墨、是碳元素形成的不同种单质,互为同素异形体,故D正确;
故选D。
4.C
【详解】A.反应Cl2+H2OHCl+HClO中氯元素化合价变化,反应为氧化还原反应,故A不符合题意;
B.反应2Na2O2+2CO2=2Na2CO3+O2中氧元素化合价变化,反应为氧化还原反应,故B不符合题意;
C.反应NH4ClNH3↑+HCl↑中无元素化合价变化,反应为非氧化还原反应,故C符合题意;
D.反应MnO2+2Cl-+4H+Mn2++Cl2↑+2H2O中Mn、Cl元素化合价变化,反应为氧化还原反应,故D不符合题意;
故答案为:C。
5.【答案】C
【解析】A.由于水分子中O电负性较强,水分子间除存在范德华力外还形成了氢键,A错误;
B.氯化钠的电离过程是自发的,不需要在通电条件下完成,B错误;
C.钠离子带有正电荷,会吸引水的O,故水合b离子表示的是水合钠离子,C正确;
D.NaCl溶液是混合物,既不是电解质也不是非电解质,D错误;
故选C。
6.【答案】B
【解析】A.S、N元素化合价降低,S和KNO3都是氧化剂,故A正确;
B.S元素化合价由0降低为-2、N元素化合价由+5降低为0,生成1个N2转移12个电子,故B错误;
C.碳元素化合价升高,C发生氧化反应,CO2是氧化产物,故C正确;
D.S、N元素化合价降低发生还原反应,K2S和N2都是还原产物,故D正确;
选B。
7.【答案】C
【解析】A.胶体区别于其他分散系的本质特征是分散质的微粒直径在1nm~100nm之间,故A正确;
B.丁达尔效应可用于区分溶液和胶体,溶液无丁达尔效应,胶体有丁达尔效应,故B正确;
C.制备氢氧化铁胶体,应在沸水中滴加饱和氯化铁溶液,向NaOH溶液中滴加FeCl3饱和溶液,生成氢氧化铁沉淀,故C错误;
D.大气是胶体,当有阳光照射清晨的空气时,会有晨曦的现象,故该现象与丁达尔效应有关,故D正确。
故选C。
8.B
【详解】该反应中,铝的化合价上升,在反应中做还原剂,发生氧化反应,得到的三氧化二铝为氧化产物,三氧化二铁中;铁元素的化合价下降,在反应中做氧化剂,发生还原反应,得到的物质铁为还原产物,故答案选B。
9.C
【详解】A.硫酸钠电离方程式为,A错误;
B.碳酸氢钠电离方程式为,B错误;
C.硫酸铝电离方程式,C正确;
D.氯化铁电离方程式为,D错误;
答案选C。
10.C
【详解】A.由反应①可得出,还原性Cl->Mn2+,由反应②可得出,还原性Fe2+>Br-,由反应③可得出,还原性Br->Cl-,则还原性:,A正确;
B.反应①中,氧化产物和还原产物分别为Cl2、Mn2+,二者的个数比为5∶2,B正确;
C.反应②中,作氧化剂,反应③中,为氧化产物,C错误;
D.由A选项可知,还原性,所以可发生反应:,D正确;
故选C。
11.【答案】C
【解析】A.用小苏打治疗胃酸过多:HCO+H+=CO2↑+H2O,A错误;
B.CH3COOH是弱酸,用CH3COOH溶解CaCO3:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑,B错误;
C.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体,离子方程式:Fe3++3H2OFe(OH)3(胶体)+3H+,C正确;
D.向澄清石灰水中滴加少量NaHCO3溶液:Ca2++OH-+HCO=CaCO3↓+H2O,D错误;
故选C。
12.【答案】C
【解析】A.酸性条件下,发生氧化还原反应生成氯气,不能大量共存,故不选A;
B. 反应生成氯化银沉淀,不能大量共存,故不选B;
C.酸性条件下,相互之间不反应,能大量共存,故选C;
D.酸性条件下,发生氧化还原反应,故不选D;
选C。
13. 【答案】D
【解析】A项,HCl中的氯,失去2×e-,化合价升高,被氧化,MnO2中的Mn得到2e-,化合价降低,被还原,A错误;B项,Fe2O3中Fe得到2×3e-,化合价降低,被还原,CO中的C失去3×2e-,化合价升高,被氧化,B错误;C项,Zn失去2e-,化合价升高,被氧化,C错误;D项,氯酸钾中的氯元素由+5价下降到-1价,氧元素由-2价上升到0价,根据得失电子守恒可得双线桥,D正确;故选D。
14.【答案】A
【解析】A.二者反应实质相同,能用一个离子方程式表示:CO32-+2H+=CO2↑+H2O,故A选;
B.醋酸为弱酸,应保留化学式,氯化氢为强酸,应拆成离子形式,所以二者不能用一个离子方程式表示,故B不选;
C.二者反应实质不同,所以不能用同一个离子方程式表示,故C不选;
D.二者反应实质不同,所以不能用同一个离子方程式表示,故D不选;
故选:A。
A.二者反应实质都是氢离子与碳酸根离子反应生成二氧化碳和水;
B.弱电解质应保留化学式;
C.前者反应实质硫酸根离子与钡离子反应生成硫酸钡沉淀,后者除了钡离子与硫酸根离子离子,还有氢氧根离子与氨根离子反应;
D.前者反应实质氢离子与氢氧根离子反应生成水,后者除了氢离子与氢氧根离子反应生成水,还发生钡离子与硫酸根离子反应生成硫酸钡沉淀。
15.【答案】C
【分析】向稀硫酸溶液中匀速逐滴加入Ba(OH)2发生反应:H2SO4+ Ba(OH)2=BaSO4↓+2H2O,由于反应产生的BaSO4是难溶性物质,主要以固体存在,H2O是弱电解质,导致溶液中自由移动的离子浓度减小,溶液导电能力减弱,当到b点时,二者恰好反应,溶液中自由移动的离子浓度几乎为0,因此导电能力最弱,过了b点,过量的Ba(OH)2电离产生自由移动的离子,使离子浓度逐渐增大,溶液导电能力逐渐增强。
【解析】A.ab段溶液的导电能力不断减弱,是由于发生反应:H2SO4+ Ba(OH)2=BaSO4↓+2H2O,反应产生的BaSO4是难溶性强电解质,主要以固体存在,H2O是弱电解质,导致溶液中自由移动的离子浓度减小,溶液导电能力减弱,A错误;
B.O~t时刻,反应的离子方程式为:2H++SO+Ba2++2OH-=BaSO4↓+2H2O,B错误;
C.溶液从t时刻之后开始慢慢变红色的原因:是由于Ba(OH)2是二元强碱,在水中电离产生OH-,使溶液显碱性,电离方程式应该为:Ba(OH)2= Ba2++2OH-,C正确;
D.若用NaOH溶液代替Ba(OH)2重复上述实验,NaOH与H2SO4发生中和反应产生可溶性盐Na2SO4和H2O,溶液中始终存在大量自由移动的离子,因此溶液导电能力几乎不变,因此不会发生上述变化,D错误;
故选C。
16.【答案】Ⅰ (1)②③④⑨ 2⑤⑦⑩ (3)①⑧
Ⅱ(4) Cu2+、Fe3+ (2)Ag+
(5)Mg2+ Mg2++2OH-= Mg(OH)2↓
(6)B
(7)Fe3+ 2Fe3++Cu=2Fe2++Cu2+
17.【答案】Ⅰ (1)ClO-(2分) Cl-(2分) (2)>(2分) <(2分)
(3)(3分)
Ⅱ(4)C(1分);Cr(1分)
(5)A(2分)
(3分);3(2分)
选项
物质
分类标准
A
KNO3、BaSO4、不锈钢
化合物
B
SO3、CO、P2O5
酸性氧化物
C
烧碱、纯碱、熟石灰
碱
D
金刚石、石墨、C60
同素异形体
相关试卷
这是一份河北省衡水市武强中学2024-2025学年高一上学期期中考试 化学试题,文件包含河北省衡水市武强中学2024-2025学年高一年级上学期期中考试化学试题docx、高一化学答题纸pdf、高一化学答案docx等3份试卷配套教学资源,其中试卷共13页, 欢迎下载使用。
这是一份河北省衡水市冀州中学2024-2025学年高一上学期10月期中考试 化学试题,共10页。试卷主要包含了《赠王君仪》中道,已知等内容,欢迎下载使用。
这是一份河北省衡水市冀州中学2024-2025学年高一上学期10月期中考试 化学试题,共10页。试卷主要包含了《赠王君仪》中道,已知等内容,欢迎下载使用。








