高考化学热点试题热点08表格型实验方案的设计与评价含解析答案
展开实验方案设计与评价是近几年新高考对于实验的重要考查形式,表格型实验设计分析与评价仍然是高考实验考查的热点。题目涉及实验操作、实验原理、实验现象及其因果关系的分析判断与评价,融合了元素化合物、化学反应原理、基础有机化学等不同角度的知识点,信息容量大,综合性强。命题方式大致有以下几种:
(1)利用教材实验按照实验操作与实验现象的匹配关系进行设计。
(2)改变或拓展教材实验进行设计。
(3)利用教材中有明显现象的不常见反应进行设计。
其中,化学平衡的移动原理探究实验、沉淀溶解平衡、糖类水解、卤代烃中卤素原子的检验等实验仍是考察的重点。
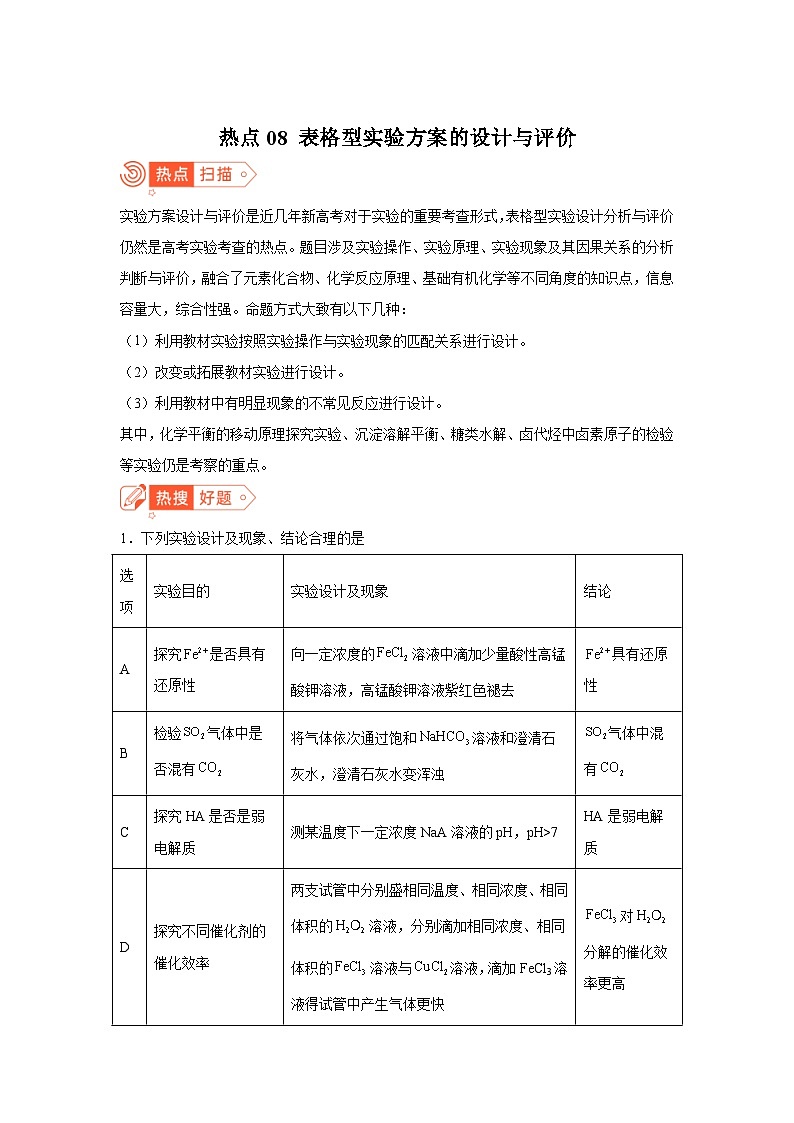
1.下列实验设计及现象、结论合理的是
A.AB.BC.CD.D
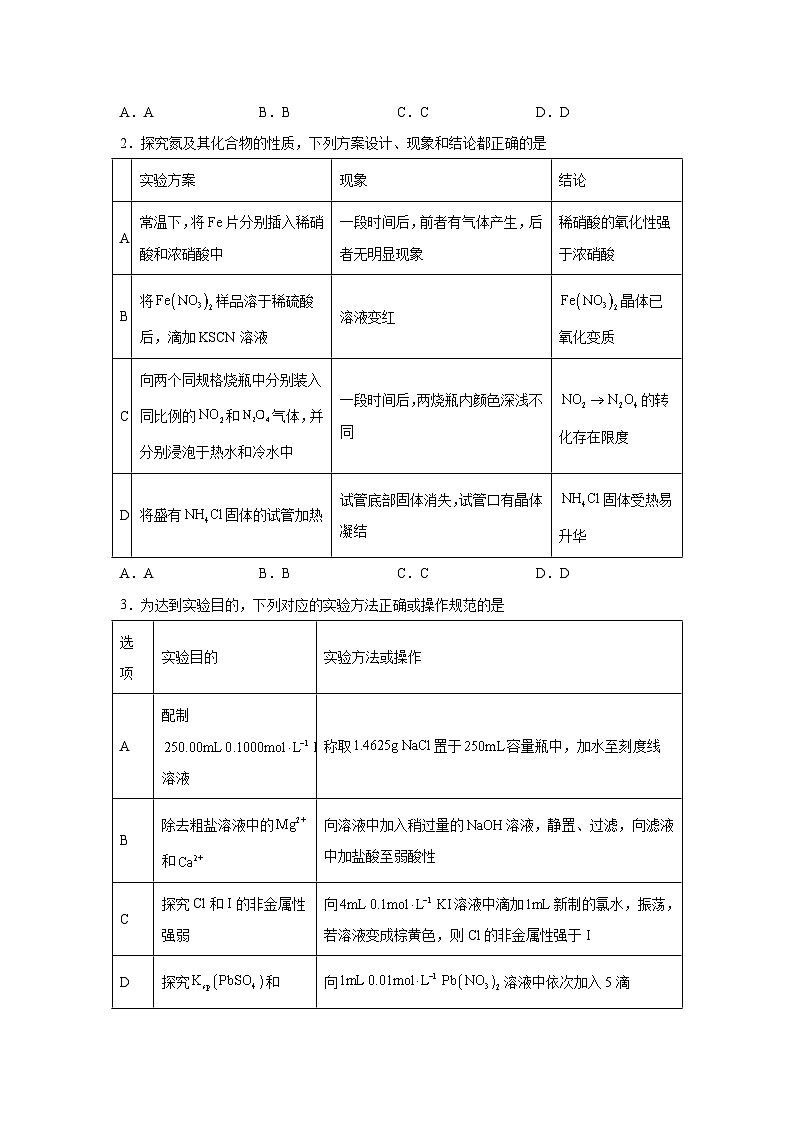
2.探究氮及其化合物的性质,下列方案设计、现象和结论都正确的是
A.AB.BC.CD.D
3.为达到实验目的,下列对应的实验方法正确或操作规范的是
A.AB.BC.CD.D
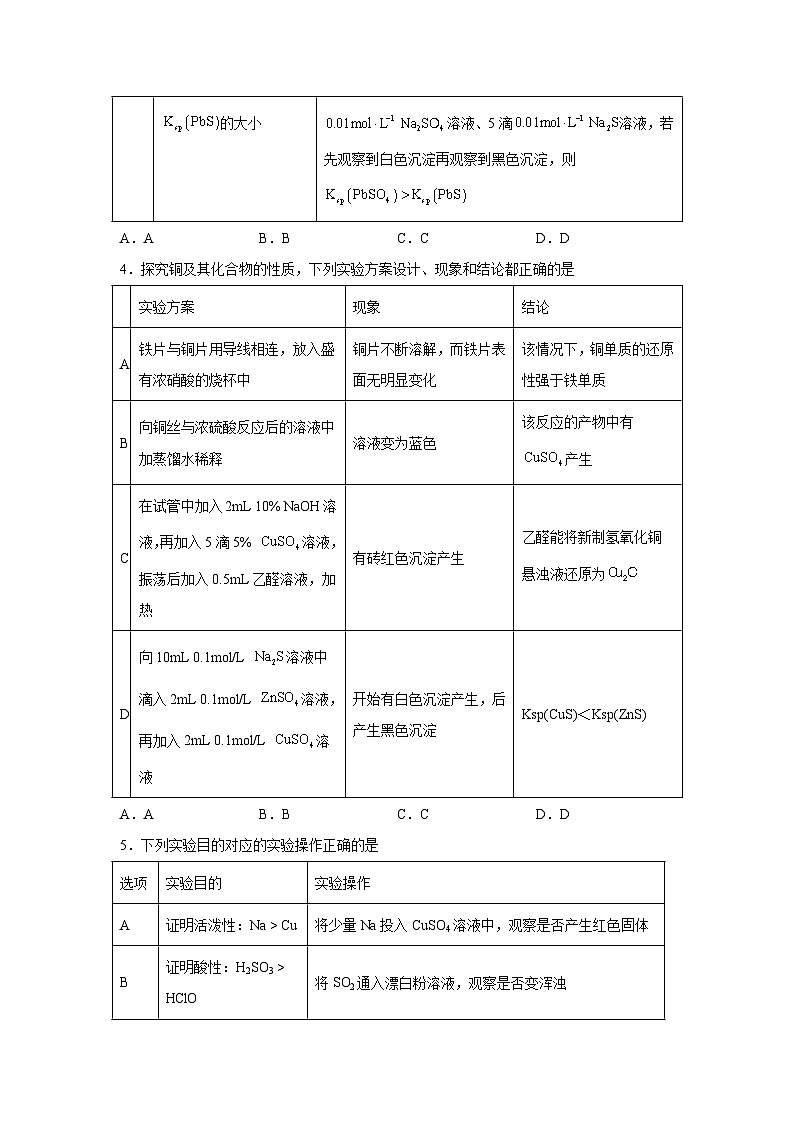
4.探究铜及其化合物的性质,下列实验方案设计、现象和结论都正确的是
A.AB.BC.CD.D
5.下列实验目的对应的实验操作正确的是
A.AB.BC.CD.D
6.下列实验操作、现象和结论均正确的是
A.AB.BC.CD.D
7.下列实验操作及现象与结论不一致的是
A.AB.BC.CD.D
8.为达到相应实验目的,下列实验设计可行的是
A.AB.BC.CD.D
9.以下探究目的对应的实验方案最合适的是
A.AB.BC.CD.D
10.为实现实验目的,下列实验操作和现象均正确的是
A.AB.BC.CD.D
选项
实验目的
实验设计及现象
结论
A
探究是否具有还原性
向一定浓度的溶液中滴加少量酸性高锰酸钾溶液,高锰酸钾溶液紫红色褪去
具有还原性
B
检验气体中是否混有
将气体依次通过饱和溶液和澄清石灰水,澄清石灰水变浑浊
气体中混有
C
探究HA是否是弱电解质
测某温度下一定浓度NaA溶液的pH,pH>7
HA是弱电解质
D
探究不同催化剂的催化效率
两支试管中分别盛相同温度、相同浓度、相同体积的溶液,分别滴加相同浓度、相同体积的溶液与溶液,滴加FeCl3溶液得试管中产生气体更快
对分解的催化效率更高
实验方案
现象
结论
A
常温下,将Fe片分别插入稀硝酸和浓硝酸中
一段时间后,前者有气体产生,后者无明显现象
稀硝酸的氧化性强于浓硝酸
B
将样品溶于稀硫酸后,滴加KSCN溶液
溶液变红
晶体已氧化变质
C
向两个同规格烧瓶中分别装入同比例的和气体,并分别浸泡于热水和冷水中
一段时间后,两烧瓶内颜色深浅不同
的转化存在限度
D
将盛有固体的试管加热
试管底部固体消失,试管口有晶体凝结
固体受热易升华
选项
实验目的
实验方法或操作
A
配制溶液
称取置于容量瓶中,加水至刻度线
B
除去粗盐溶液中的和
向溶液中加入稍过量的溶液,静置、过滤,向滤液中加盐酸至弱酸性
C
探究Cl和I的非金属性强弱
向溶液中滴加新制的氯水,振荡,若溶液变成棕黄色,则Cl的非金属性强于I
D
探究和的大小
向溶液中依次加入5滴溶液、5滴溶液,若先观察到白色沉淀再观察到黑色沉淀,则
实验方案
现象
结论
A
铁片与铜片用导线相连,放入盛有浓硝酸的烧杯中
铜片不断溶解,而铁片表面无明显变化
该情况下,铜单质的还原性强于铁单质
B
向铜丝与浓硫酸反应后的溶液中加蒸馏水稀释
溶液变为蓝色
该反应的产物中有产生
C
在试管中加入2mL 10% NaOH溶液,再加入5滴5% 溶液,振荡后加入0.5mL乙醛溶液,加热
有砖红色沉淀产生
乙醛能将新制氢氧化铜悬浊液还原为
D
向10mL 0.1ml/L 溶液中滴入2mL 0.1ml/L 溶液,再加入2mL 0.1ml/L 溶液
开始有白色沉淀产生,后产生黑色沉淀
Ksp(CuS)<Ksp(ZnS)
选项
实验目的
实验操作
A
证明活泼性:Na > Cu
将少量Na投入CuSO4溶液中,观察是否产生红色固体
B
证明酸性:H2SO3 > HClO
将SO2通入漂白粉溶液,观察是否变浑浊
C
证明H2SO4具有氧化性
将少量稀硫酸滴入Na2S2O3溶液,观察是否产生刺激性气味的气体
D
证明淀粉已水解完全
取适量淀粉水解液,滴入几滴碘水,观察溶液是否变蓝
选项
实验操作及现象
结论
A
分别向等量乙醇和水中加入绿豆大的钠,钠与水反应更剧烈
水分子中的氢原子比乙醇羟基中的氢原子活泼
B
向某稀溶液中加入NaOH溶液,能产生使湿润的蓝色石蕊试纸变红的气体
溶液中含有
C
向葡萄糖溶液中加入少量NaOH溶液和CuSO4溶液,产生砖红色沉淀
新制Cu(OH)2可检验葡萄糖
D
向少量酸性KMnO4溶液中滴加少量FeCl2溶液,再滴加2滴KSCN溶液,溶液先褪色后变红
Fe2+具有氧化性
实验操作及现象
结论
A
测定不同温度下蒸馏水的,随温度升高而降低
水的电离程度随温度升高而增大
B
向新制的溶液中滴入少量蔗糖溶液并加热,不产生砖红色沉淀
蔗糖不属于还原糖
C
将少量乙酸乙酯加入溶液中,出现分层,静置一段时间后酯层消失
乙酸乙酯可在碱性条件下水解
D
向溶液()中滴加溶液,紫色褪去
具有还原性
编号
实验目的
实验过程
A
分离、
将混合物置于足量NaOH溶液中,然后依次进行过滤、洗涤、蒸发、灼烧四项操作
B
判断反应后是否沉淀完全
将溶液与溶液混合,反应后静置,向上层清液中再加1滴溶液
C
观察颜色
向盛有溶液的试管中滴入氨水,立即振荡
D
探究浓度对反应速率的影响
向2支盛有5mL不同浓度溶液的试管中同时加入2mL5%溶液,观察实验现象
实验方案
探究目的
A
向溶液中加入金属
比较和的还原能力
B
分别向稀硝酸和稀醋酸中加入铜粉
比较稀硝酸和稀醋酸的酸性强弱
C
将浓硫酸滴入乙醇中,加热至,生成的气体通入酸性重铬酸钾溶液
验证乙烯具有还原性
D
向溶液中同时通入和
比较和的氧化能力
选项
实验目的
实验操作
实验现象
A
证明金属性
少量金属Na与胆矾隔绝空气加热
有红色固体生成
B
验证压强对化学平衡的影响
先将注射器充满气体,然后将活塞往里推
注射器内气体颜色加深,证明加压平衡朝生成气体的方向移动
C
验证常温下,溶度积:
常温下,向盛有2滴溶液的试管中滴加溶液,再向其中滴加溶液
先有白色沉淀生成,后又产生黄色沉淀
D
证明浓硫酸具有强氧化性
加热浓硫酸、NaCl固体与固体的混合物
有黄绿色气体产生
参考答案:
1.D
【详解】A.向一定浓度的溶液中滴加少量酸性高锰酸钾溶液,高锰酸钾溶液紫红色褪去,不能说明具有还原性,因为在酸性条件下,Cl-也能还原,A项错误;
B.将气体依次通过饱和碳酸氢钠溶液和澄清石灰水,澄清石灰水变浑浊,不能说明气体中混有,因为能与碳酸氢钠溶液反应生成,B项错误;
C.测某温度下一定浓度NaA溶液的pH,pH>7,由于题目中没有指明温度是室温,pH>7不能说明NaA是强碱弱酸盐,也就不能说明HA是弱电解质,C项错误;
D.两支试管中分别盛相同温度、相同浓度、相同体积的溶液,分别滴加相同浓度、相同体积的溶液与溶液,滴加溶液的试管中产生气体更快,能够说明对分解的催化效率更高,D项正确;
故选D。
2.C
【详解】A.铁遇浓硫酸会发生钝化,浓硝酸的氧化性比稀硝酸强,选项A错误;
B.向溶液中滴加稀硫酸,酸性条件下硝酸根离子与亚铁离子发生氧化还原反应生成铁离子,结论不合理,选项B错误;
C.向两个同规格烧瓶中分别装入同比例的和气体,并分别浸泡于热水和冷水中,一段时间后,两烧瓶内颜色深浅不同,说明温度影响平衡移动,的转化存在限度,不能完全转化,选项C正确;
D.将盛有固体的试管加热,发生反应,氨气和氯化氢在试管口遇冷又生成氯化铵,所以试管口处有晶体出现,选项D错误;
答案选C。
3.C
【详解】A.配制溶液时,称取的氯化钠固体应先在烧杯中溶解,再转移至容量瓶中定容,A错误;
B.向溶液中加入稍过量的溶液,除去粗盐溶液中的,还需向溶液中加入碳酸钠溶液除去,过滤后再向滤液中加入适量盐酸除去过量的、碳酸钠溶液,B错误;
C.溶液变成棕黄色,说明新制氯水能将碘离子氧化为碘单质,新制氯水中含有,该反应属于置换反应,证明Cl和I的非金属性前者更强,C符合题意;
D.向溶液中依次加入5滴溶液、5滴溶液,由于过量,一定先观察到白色沉淀硫酸铅,再观察到黑色沉淀,没有发生了沉淀转化,无法说明,D不正确;
故选C。
4.C
【详解】A.铁片表面无变化是因为铁发生了钝化,仍是铁的还原性强于铜,故A错误;
B.验证铜与浓硫酸反应后的产物,应将反应液倒入盛水的烧杯中,防止浓硫酸稀释时液滴飞溅,故B错误;
C.用新制氢氧化铜碱性悬浊液可以检验醛基存在,新制氢氧化铜碱性悬浊液有弱氧化性,在加热下被醛基还原为砖红色的氧化亚铁沉淀,故C正确;
D.Na2S与ZnSO4反应中,Na2S过量,可以继续与CuSO4反应产生黑色沉淀,无法证明由硫化锌转化为了硫化铜,故无法得出Ksp(CuS)<Ksp(ZnS)的结论,故D错误;
答案选C。
5.D
【详解】A.将少量Na投入CuSO4溶液中,金属钠不能置换出硫酸铜溶液中的铜,故不选A;
B.将SO2通入漂白粉溶液,二氧化硫被次氯酸钙氧化为硫酸钙沉淀,溶液变浑浊,不能证明酸性:H2SO3 > HClO,故不选B;
C.将少量稀硫酸滴入Na2S2O3溶液,Na2S2O3发生自身氧化还原反应生成S沉淀和二氧化硫气体,产生刺激性气味的气体,不能证明H2SO4具有氧化性,故不选C;
D.碘能使淀粉变蓝,取适量淀粉水解液,滴入几滴碘水,若溶液不变蓝,说明淀粉已完全水解,故选D。
选D。
6.A
【详解】A.钠与水反应比与乙醇反应剧烈,则乙醇中羟基上氢的活泼性比水中氢的活泼性弱,即水分子中的氢原子比乙醇羟基中的氢原子活泼,A正确;
B.将某稀溶液加热浓缩,然后加入NaOH溶液,并加热,若能产生使湿润的红色石蕊试纸变蓝的气体,该气体是NH3,说明溶液中含有;由于题目没有加热,溶液是稀溶液,试纸是蓝色石蕊试纸,因此不能看到使湿润的红色石蕊试纸变蓝的气体,操作及实验现象均有误,B错误;
C.要利用新制Cu(OH)2检验葡萄糖的醛基,操作方法是:在试管中加入2 mL10%的NaOH溶液,滴加5滴CuSO4溶液,使溶液显碱性,反应产生Cu(OH)2蓝色絮状沉淀,然后再加入2mL 10%葡萄糖溶液,加热煮沸,进行观察,若产生砖红色沉淀,证明葡萄糖分子中含有醛基,C错误;
D.Fe2+具有还原性,可以被酸性KMnO4溶液氧化为Fe3+,Fe3+与SCN-作用使溶液变为血红色,则证明Fe2+具有还原性,而不是氧化性,D错误;
故合理选项是A。
7.D
【详解】A.水的电离程度随温度升高而增大,升温氢离子浓度增大,故蒸馏水的随温度升高而降低,A正确;
B.不产生砖红色沉淀,说明新制的没有被蔗糖还原,则蔗糖不属于还原糖,B正确;
C.向含有乙酸乙酯的试管中加入NaOH溶液,酯不溶于水,出现分层,一段时间后酯层消失,则乙酸乙酯在碱性条件下可以水解,C正确;
D.酸性条件下氯离子也会和高锰酸钾发生氧化还原反应使得溶液褪色,故不能说明具有还原性,D错误;
故选D。
8.B
【详解】A.氧化铁和氢氧化钠不反应,氧化铝和氢氧化钠反应生成四羟基合铝酸钠,过滤分离氧化铁和溶液,溶液通入足量二氧化碳生成氢氧化铝沉淀,过滤,沉淀洗涤、灼烧得到氧化铝,A不符合题意;
B.层清液中再加1滴溶液,若不产生白色沉淀,说明反应后是否沉淀完全,B符合题意;
C.向盛有溶液的试管中滴入氨水,立即振荡,使得生成的氢氧化亚铁被空气中氧气氧化为氢氧化铁沉淀,不能观察颜色,C不符合题意;
D.过氧化氢和亚硫酸氢钠发生氧化还原反应生成水和硫酸钠,没有明显实验现象,不能判断反应进行的速率,D不符合题意;
故选B。
9.D
【详解】A.金属加入溶液,直接与水反应,不能置换出Al,无法比较和的还原能力,故A不符合题意;
B.铜粉不和稀醋酸反应,而且铜粉与稀硝酸反应是因为其氧化性,无法比较稀硝酸和稀醋酸的酸性强弱,故B不符合题意;
C.乙醇与浓H2SO4混合加热,可发生副反应生成SO2等物质,也能使酸性KMnO4溶液褪色,且乙醇也能使酸性高锰酸钾溶液褪色,故C不符合题意;
D.向溶液中同时通入和,有沉淀生成,说明氧化生成了硫酸根,能比较和的氧化能力,故D符合题意;
故答案选D。
10.C
【详解】A.胆矾含结晶水,加热时Na与水反应,不能生成红色固体,不能比较金属性强弱,故A错误;
B.将活塞往里推,浓度增大,且压强增大使2NO2(g)⇌N2O4(g)平衡正向移动,则气体颜色先加深后变浅,但比原平衡时颜色深,故B错误;
C.AgNO3溶液不足,AgCl转化为更难溶的AgI,则先有白色沉淀生成,后又产生黄色沉淀,可知Ksp(AgCl)>Ksp(AgI),故C正确;
D.加热浓硫酸、NaCl固体与MnO2固体的混合物,生成氯气,Mn元素的化合价降低、Cl元素的化合价升高,不能证明浓硫酸具有强氧化性,故D错误;
故选:C。
高考化学热点试题热点22定量分析型实验综合题含解析答案: 这是一份高考化学热点试题热点22定量分析型实验综合题含解析答案,共15页。
高考化学热点试题热点21性质探究型实验综合题含解析答案: 这是一份高考化学热点试题热点21性质探究型实验综合题含解析答案,共14页。试卷主要包含了铜盐是五颜六色的等内容,欢迎下载使用。
高考化学热点试题热点20物质制备型实验综合题含解析答案: 这是一份高考化学热点试题热点20物质制备型实验综合题含解析答案,共13页。试卷主要包含了过硼酸钠可用于漂白剂及杀菌消毒等内容,欢迎下载使用。












