

高考化学热点试题热点11微型工艺流程含解析答案
展开化学工艺流程题(选择题)均取材于成熟的化学工艺或改进工艺,该类试题以简洁的工艺流程图再现实际生产的关键环节,情境真实富有意义。解答时,要紧紧围绕工艺流程的最终目的,明确原料转化为产品的生产原理、除杂并分离提纯产品的方法、提高产量和产率的措施、减少污染注意环保的“绿色化学”思想、原料的来源丰富和经济成本等。从以下几个方面设置选项提问:
1.原料的预处理方法及其目的。
2.流程中指定转化的方程式书写和反应条件的控制。
3.化工流程中的分离提纯方法及原理和有关仪器选择等。
4.化工流程中滤液、滤渣的成分判断。
5.定量计算(如Ksp、pH、转化率、产率等的计算)。
1.由菱锰矿(MnCO3,含有少量Si、Fe、Ni、Al等元素)制备锂电池正极材料LiMn2O4的流程如下:
已知:Ksp[Fe(OH)3]=2.8×10-39,Ksp[Al(OH)3]=1.3×10-33,Ksp[Ni(OH)2]=5.5×10-16。下列说法错误的是
A.上述流程中有三种元素被氧化
B.从利用率考虑“反应器”中不宜使用H2O2替代MnO2
C.溶矿反应完成后,“反应器”中溶液pH=4,则Fe3+和Al3+都沉淀完全
D.加入少量BaS溶液以除去Ni2+,“滤渣”的成分至少有四种
2.某研究小组制备纳米ZnO,再与金属有机框架MOF)材料复合制备荧光材ZnO@MOF,流程如下:
已知:
①含锌组分间的转化关系:
②是的一种晶型,39℃以下稳定。
下列有关说法正确的是
A.纳米ZnO属于胶体
B.步骤Ⅰ,为提高产率应将过量NaOH溶液滴入溶液制备
C.步骤Ⅱ,为了更好地除去杂质,可用50℃的热水洗涤
D.用和过量反应,得到的沉淀无需洗涤可直接控温煅烧得纳米ZnO
3.实验小组用过量溶液处理覆铜板得到浸出液,并对其中的物质进行回收,流程如下。下列有关说法正确的是
A.浸出液呈中性B.滤渣只有铜粉
C.用KSCN溶液检验是否“氧化”完全D.溶液a回收后可用于处理覆铜板
4.硒是人体微量元素中的“胰岛素”。含硒废料(主要含Se、S、Fe2O3、ZnO、CuO、SiO2等)制取硒的流程如图,下列有关说法正确的是
A.“分离”时得到含硫煤油的操作方法是分液
B.“酸溶”后,滤渣是Se
C.“酸化”时,生成1ml Se,反应转移2ml电子
D.若向“酸溶”所得的滤液中滴加硫氰化钾溶液,溶液不变红
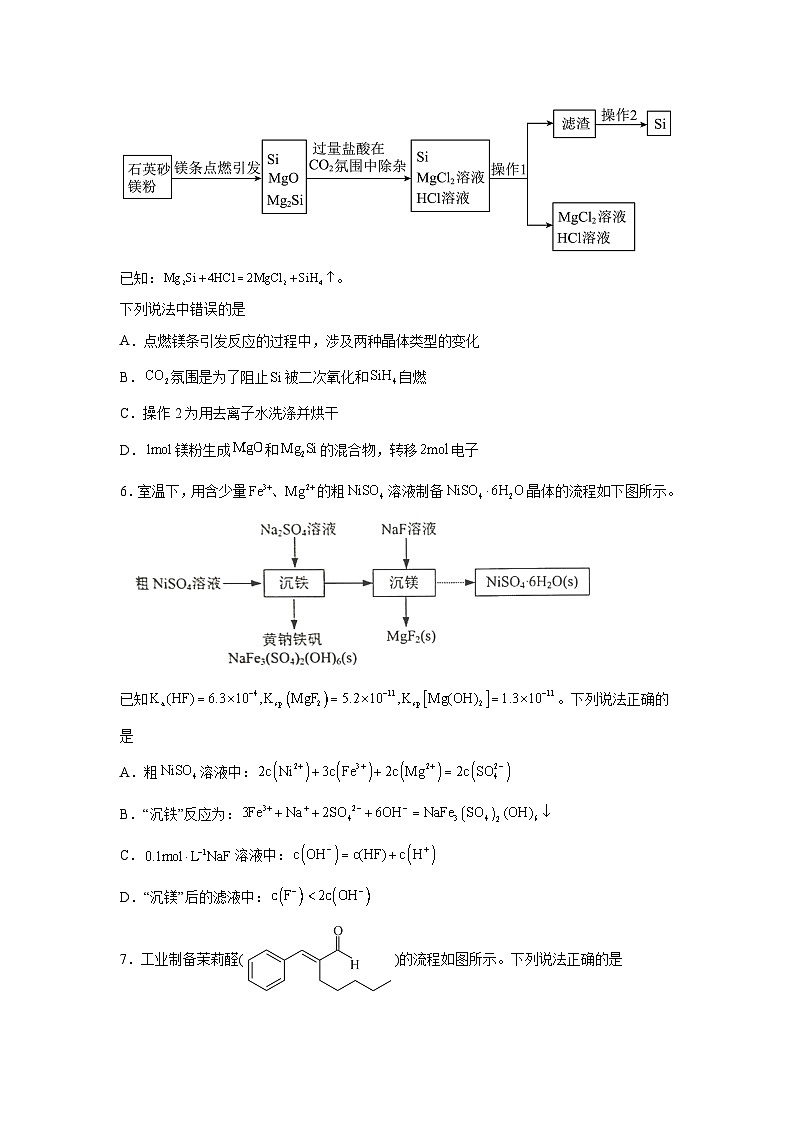
5.近日,清华大学等重点高校为解决中国“芯”——半导体芯片,成立了“芯片学院”。某小组拟在实验室制造硅,其流程如下图。
已知:。
下列说法中错误的是
A.点燃镁条引发反应的过程中,涉及两种晶体类型的变化
B.氛围是为了阻止被二次氧化和自燃
C.操作2为用去离子水洗涤并烘干
D.镁粉生成和的混合物,转移电子
6.室温下,用含少量的粗溶液制备晶体的流程如下图所示。
已知。下列说法正确的是
A.粗溶液中:
B.“沉铁”反应为:
C.溶液中:
D.“沉镁”后的滤液中:
7.工业制备茉莉醛()的流程如图所示。下列说法正确的是
已知:庚醛易自身缩合生成与茉莉醛沸点接近的产物
A.乙醇只作溶剂,苯甲醛和庚醛直接混合后保温反应
B.萃取分液过程中需酸洗、水洗,干燥剂可选用浓硫酸
C.可将最后两步“分馏”和“柱色谱分离”合并为“真空减压分馏”
D.可采用质谱法测定茉莉醛部分结构信息
8.连二亚硫酸钠()俗称保险粉,有强还原性,在空气中极易被氧化。用还原法制备保险粉的流程如下:
下列说法错误的是
A.反应1说明酸性:
B.反应1结束后,可用硝酸酸化的溶液检验是否被氧化
C.反应2中消耗的氧化剂和还原剂的物质的量之比为
D.反应2最好在无氧条件下进行
9.用绿矾()制备电池电极材料的流程如下:
下列说法正确的是
A.反应1中转化为
B.可用酸性溶液检验反应1中是否完全反应
C.可以使用KSCN溶液检验沉淀是否洗涤干净
D.反应2中氧化剂与还原剂的物质的量之比为2:1
10.实验室初步分离苯甲酸乙酯、苯甲酸和环己烷的流程如下:
已知:苯甲酸乙酯的沸点为,“乙醚-环己烷-水共沸物”的沸点为。
下列说法不正确的是
A.操作a为分液,操作c为重结晶B.操作b中需用到直形冷凝管
C.可用冷水洗涤苯甲酸粗品D.无水可以用浓硫酸代替
参考答案:
1.C
【分析】菱锰矿主要含有MnCO3,还含有少量Si、Fe、Ni、Al等元素,硫酸溶矿MnCO3和稀硫酸反应生成硫酸锰,同时得到硫酸亚铁、硫酸镍、硫酸铝等盐,用二氧化锰把硫酸亚铁氧化为氢氧化铁沉淀除铁,加石灰乳调节至pH≈7生成氢氧化铝沉淀除铝,加BaS生成NiS除Ni,过滤,滤液中含有硫酸锰,电解硫酸锰溶液得到MnO2,煅烧窑中碳酸锂、二氧化锰反应生成LiMn2O4,据此分析解题。
【详解】A.用二氧化锰把硫酸亚铁氧化为氢氧化铁沉淀除铁过程中Fe元素被氧化,电解硫酸锰溶液得到MnO2过程中Mn元素被氧化,煅烧窑中碳酸锂、二氧化锰反应生成LiMn2O4过程中Mn和O元素被氧化,所以共有三种元素被氧化,故A正确;
B.MnO2具有氧化性,加入少量MnO2的作用是将Fe2+氧化为Fe3+,Fe3+可以催化H2O2分解,所以不宜使用H2O2替代MnO2,故B正确;
C.pH=4,c(OH−)=1×10−10ml/L,根据Fe(OH)3和Al(OH)3的Ksp可知,,此时,,Al3+没有沉淀完全,故C错误;
D.有分析可知,加入少量BaS溶液除去Ni2+,可知生成的沉淀有BaSO4、NiS,此外,二氧化锰把硫酸亚铁氧化为氢氧化铁沉淀除铁,加石灰乳调节至pH≈7生成氢氧化铝沉淀除铝,所以 “滤渣”的成分至少有四种,故D正确;
故答案选C。
2.D
【分析】氢氧化钠溶液中滴入硫酸锌溶液,不断搅拌,反应得到,过滤、洗涤得到,控温,在坩埚中煅烧得到纳米ZnO,再与金属有机框架(MOF)材料复合制备荧光材料ZnO@MOF。
【详解】A.纳米ZnO属于纯净物,胶体是混合物,A错误;
B. NaOH溶液过量时锌元素的存在形式为,得不到,B错误;
C.根据题中信息,是的一种晶型,39℃以下稳定,故不能用50℃的热水洗涤,C错误;
D.用和过量反应得到碳酸锌和醋酸铵,得到的沉淀表面可能有醋酸铵,在高温煅烧下分解产生二氧化碳和水,故无需洗涤可直接控温煅烧得纳米ZnO,D正确;
故选D。
3.D
【分析】从腐蚀废液(主要含FeCl3、FeCl2、CuCl2)中进行物质回收,由流程可知,先加入过量的Fe,与氯化铁、氯化铜反应生成氯化亚铁、铜,滤渣中含Fe、Cu,加氯气氧化FeCl2产生FeCl3,据此分析解题。
【详解】A.腐蚀废液含有Fe3+,Cu2+,Fe2+,水解使得溶液呈酸性,故A错误;
B.据分析可知,滤渣中含Fe、Cu,故B错误;
C.氯气氧化FeCl2产生FeCl3,因为FeCl3为产物,只要反应开始就能使KSCN溶液变红,无法检验是否“氧化”完全,故C错误;
D.溶液a为FeCl3,可用于处理覆铜板,故D正确;
故答案选D。
4.C
【分析】由流程可知,煤油溶解S后,过滤分离出含硫的煤油,分离出Se、Fe2O3、CuO、ZnO、SiO2后,加硫酸溶解、过滤,滤液含硫酸铜、硫酸锌、硫酸铁,滤渣含Se、SiO2,再加亚硫酸钠浸取Se生成Na2SeSO3,最后酸化生成粗硒;
【详解】A.煤油溶解S后,过滤分离出含硫的煤油,滤渣为Se、Fe2O3、CuO、ZnO、SiO2,“分离”时得到含硫煤油的方法是过滤,A错误;
B.根据分析,“酸溶”后,滤渣是Se、SiO2,B错误;
C.“酸化”过程中化合物硒代硫酸钠反应后生成Se单质,Se元素从+2价降低至0价,生成1ml Se,反应转移2ml电子,C正确;
D.酸溶后的溶液中含Fe3+,与硫氰化钾溶液作用,溶液呈红色,D错误;
答案选C。
5.A
【详解】A.根据分析,点燃镁条引发反应的过程中发生的反应为:,,镁粉为金属晶体、石英砂和硅共价晶体、氧化镁和硅化镁为离子晶体,涉及三种类型晶体变化,A错误;
B.氛围是为了阻止被二次氧化和自燃,B正确;
C.根据分析,操作2为用去离子水洗涤并烘干,C正确;
D.镁粉生成和的混合物,Mg由0价全部变为+2价,转移电子,D正确;
故选A。
6.C
【分析】粗溶液中加入硫酸钠溶液,生成黄钠铁钒,除去铁元素;再向溶液中加入溶液,生成沉淀,除去镁元素,经过后续操作得到。
【详解】A.粗溶液的电荷守恒中缺少氢离子和氢氧根离子浓度,A错误;
B.溶液呈弱酸性,“沉铁”反应为:3Fe3++Na++2+6H2O=NaFe3(SO4)2(OH)6↓+6H+,B错误;
C.氟化氢为弱酸,溶液中根据质子守恒:,C正确;
D.沉镁过程形成沉淀,根据沉淀溶解平衡,,,此时,该溶液中,镁离子浓度相同,形成的是沉淀,没有形成沉淀,则溶液中,故得出沉镁后,D错误;
故选C。
7.D
【分析】苯甲醛、庚醛与KOH的乙醇溶液共热后冷却,经萃取分液分离出水相,加入干燥剂后过滤有机相,去掉滤渣,蒸馏,用柱色谱法分离出庚醛自缩物,得到茉莉醛;
【详解】A.据题意和分析,苯甲醛与庚醛反应生成水和茉莉醛,乙醇不参与反应,乙醇的主要作用是助溶剂,但反应条件是强碱条件下加热不是直接混合后保温,故A错误;
B.萃取分液过程中需酸洗、水洗,干燥剂选用不可用浓硫酸可能使得产物碳化,而且也不易分离,故B错误;
C.庚醛易自身缩合生成与茉莉醛沸点接近的产物,真空减压分馏不可以将两者分离,故C错误;
D.可采用质谱法测定茉莉醛部分结构信息,故D正确;
答案选D。
8.B
【分析】由题给流程可知,碳酸钠溶液与二氧化硫反应生成亚硫酸氢钠和二氧化碳,亚硫酸氢钠溶液与锌粉反应生成连二亚硫酸钠和氢氧化锌,连二亚硫酸钠溶液结晶脱水得到连二亚硫酸钠。
【详解】A.由分析可知,反应1为碳酸钠溶液与二氧化硫反应生成亚硫酸氢钠和二氧化碳,由强酸制弱酸的原理可知,亚硫酸的酸性强于碳酸,故A正确;
B.亚硫酸氢钠溶液不能与氯化钡溶液反应,若亚硫酸氢钠溶液被氧化,加入酸化氯化钡溶液会与硫酸根离子反应生成白色硫酸钡沉淀,则反应1结束后,可用盐酸酸化的氯化钡溶液检验亚硫酸氢钠是否被氧化,但是不能用硝酸酸化,硝酸会氧化亚硫酸根生成硫酸根,故B错误;
C.由分析可知,反应2为亚硫酸氢钠溶液与锌粉反应生成连二亚硫酸钠和氢氧化锌,反应中亚硫酸氢钠为反应的氧化剂,锌为还原剂,由得失电子数目守恒可知氧化剂和还原剂的物质的量之比为2∶1,故C正确;
D.由题意可知,连二亚硫酸钠有强还原性,在空气中极易被氧化,则制备连二亚硫酸钠时,反应2最好在无氧条件下进行,故D正确;
故选B。
9.D
【分析】“溶解”步骤中绿矾溶解到磷酸中,根据流程图可知,“反应1”步骤中加NaClO、NaOH,将Fe2+氧化成Fe3+,同时得到磷酸铁沉淀,“反应2”步骤中草酸作还原剂,与FePO4、LiOH反应生成LiFePO4,据此分析。
【详解】A.反应1中NaClO作氧化剂,将Fe2+氧化成Fe3+,本身被还原成NaCl,故A错误;
B.反应1中NaClO作氧化剂,将Fe2+氧化成Fe3+,本身被还原成NaCl,酸性高锰酸钾溶液能氧化Cl-,使之褪色,因此不能用酸性高锰酸钾溶液检验反应1中Fe2+是否完全反应,故B错误;
C.洗涤沉淀的目的是除去沉淀表面上的NaCl、NaOH、NaClO溶液等,Fe3+不用除去,不能使用KSCN溶液检验沉淀是否洗涤干净,故C错误;
D.草酸为还原剂,碳元素化合价由+3价升高为+4价,草酸整体化合价升高2价,FePO4为氧化剂,铁元素化合价由+3价降低为+2价,降低1价,最小公倍数为2,因此FePO4与草酸物质的量之比为2∶1,故D正确;
故选D。
10.D
【分析】苯甲酸乙酯、苯甲酸和环己烷混合物中加入碳酸钠溶液,苯甲酸与碳酸钠反应生成苯甲酸钠、水和二氧化碳,分液后得到有机相1和水相;苯甲酸乙酯的沸点为,“乙醚-环己烷-水共沸物”的沸点为,蒸馏(操作b)后得到有机相2和共沸物,向有机相2中加入无水硫酸镁,用于除去有机相中的少量水;向水相1中加入乙醚萃取少量的有机物进入有机相,分液后得到水相2,水相2中成分为苯甲酸钠,加入硫酸反应得到苯甲酸晶体,过滤后得到苯甲酸粗品,经重结晶后得到纯净的苯甲酸,据此分析此题。
【详解】A. 结合上述分析,操作a为分液,操作c为重结晶,故A正确;
B. 结合上述分析,操作b为蒸馏,需用到蒸馏烧瓶、直形冷凝管、温度计、尾接管、锥形瓶等,故B正确;
C. 用冷水洗涤苯甲酸粗品,避免因溶解导致产率低,故C正确;
D. 浓硫酸使苯甲酸乙酯部分发生水解,故D错误;
答案为D。
高考化学热点试题热点23化学工艺流程综合题含解析答案: 这是一份高考化学热点试题热点23化学工艺流程综合题含解析答案,共12页。试卷主要包含了层状结构薄膜能用于制作电极材料,氮化镓具有优异的光电性能等内容,欢迎下载使用。
高考化学热点试题热点19化学微型实验含解析答案: 这是一份高考化学热点试题热点19化学微型实验含解析答案,共11页。
高考化学热点试题热点14电化学及其应用含解析答案: 这是一份高考化学热点试题热点14电化学及其应用含解析答案,共11页。试卷主要包含了Adv等内容,欢迎下载使用。












