






新高考化学一轮复习课件第6章 第35讲 物质的聚集状态 常见晶体类型(含解析)
展开1.了解晶体和非晶体的区别。2.了解晶体的类型,了解不同类型晶体中结构微粒、微粒间作用力的区别。 3.了解分子晶体、 共价晶体、 离子晶体、金属晶体结构与性质的关系。4.了解四种晶体类型熔点、沸点、溶解性等性质的不同。
考点一 物质的聚集状态 晶体与非晶体
考点二 常见晶体类型
答题规范(5) 晶体熔、沸点高低原因解释
真题演练 明确考向
物质的聚集状态 晶体与非晶体
1.物质的聚集状态(1)物质的聚集状态除了固态、液态、气态,还有 、 以及介乎 和_______之间的塑晶态、液晶态等。
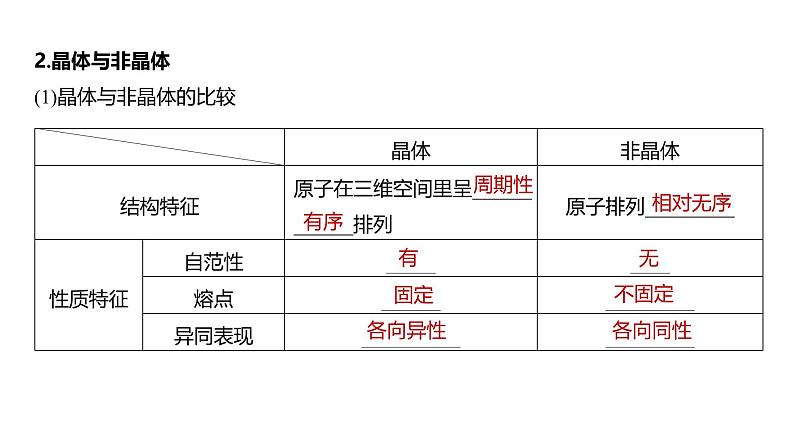
2.晶体与非晶体(1)晶体与非晶体的比较
(2)得到晶体的途径①熔融态物质凝固;②气态物质冷却不经液态直接凝固(凝华);③溶质从溶液中析出。(3)晶体与非晶体的测定方法
1.在物质的三态相互转化过程中只是分子间距离发生了变化( )2.晶体和非晶体的本质区别是晶体中粒子在微观空间里呈现周期性的有序排列( )3.晶体的熔点一定比非晶体的熔点高( )4.具有规则几何外形的固体一定是晶体( )5.缺角的NaCl晶体在饱和NaCl溶液中会慢慢变为完美的立方体块( )
一、物质聚集状态的多样性1.下列有关物质特殊聚集状态与结构的说法不正确的是A.液晶中分子的长轴取向一致,表现出类似晶体的各向异性B.等离子体是一种特殊的气体,由阳离子和电子两部分构成C.纯物质有固定的熔点,但其晶体颗粒尺寸在纳米量级时也可能发生变化D.超分子内部的分子间一般通过非共价键或分子间作用力结合成聚集体
液晶分子沿分子长轴方向有序排列,从而表现出类似晶体的各向异性,故A正确;等离子体是由阳离子、电子和电中性粒子组成的整体上呈电中性的物质聚集体,故B错误;纯物质有固定的熔点,但其晶体颗粒尺寸在纳米量级时也可能发生变化,熔点可能下降,故C正确;超分子内部的多个分子间一般通过非共价键或分子间作用力结合成聚集体,故D正确。
2.水的状态除了气、液和固态外,还有玻璃态。它是由液态水急速冷却到165 K时形成的。玻璃态的水无固定形状,不存在晶体结构,且密度与普通液态水的密度相同,下列有关玻璃态水的叙述正确的是A.水由液态变为玻璃态,体积缩小B.水由液态变为玻璃态,体积膨胀C.玻璃态是水的一种特殊状态D.在玻璃态水的X射线图谱上有分立的斑点或明锐的衍射峰
玻璃态水无固定形状,不存在晶体结构,因密度与普通液态水相同,故水由液态变为玻璃态时体积不变。
二、晶体与非晶体的区别3.下列关于晶体和非晶体的说法正确的是A.晶体在三维空间里呈周期性有序排列,因此在各个不同的方向上具有相同的物理 性质B.晶体在熔化过程中需要不断地吸热,温度不断地升高C.普通玻璃在各个不同的方向上力学、热学、电学、光学性质相同D.晶体和非晶体之间不可以相互转化
晶体在三维空间里呈周期性有序排列,其许多物理性质常常会表现出各向异性,A不正确;晶体的熔点是固定的,所以在熔化过程中温度不会变化,B不正确;在一定条件下晶体和非晶体是可以相互转化的,D不正确。
4.玻璃是常见的非晶体,在生产生活中有着广泛的用途,如图是玻璃的结构示意图,下列有关玻璃的说法错误的是A.玻璃内部微粒排列是无序的B.玻璃熔化时吸热,温度不断上升C.光导纤维和玻璃的主要成分都可看成是SiO2, 二者都是非晶体D.利用X射线衍射实验可以鉴别石英玻璃和水晶
根据玻璃的结构示意图可知,构成玻璃的粒子无周期性排列,是无序的,所以玻璃是非晶体,因此没有固定的熔点,A、B对;玻璃属于非晶体,但光导纤维属于晶体,C错;区分晶体与非晶体最科学的方法是对固体进行X射线衍射实验,D对。
1.晶胞(1)概念:描述晶体结构的基本单元。(2)晶体中晶胞的排列——无隙并置①无隙:相邻晶胞之间没有 。②并置:所有晶胞 排列、 相同。
2.四种常见晶体类型的比较
3.常见晶体的结构模型(1)典型的分子晶体——干冰和冰
①干冰晶体中,每个CO2分子周围等距且紧邻的CO2分子有 个。②冰晶体中,每个水分子与相邻的 个水分子以氢键相连接,含1 ml H2O的冰中,最多可形成 ml氢键。
(2)典型的共价晶体——金刚石、二氧化硅①金刚石和二氧化硅晶体结构模型比较
②金刚石和二氧化硅结构特点分析比较
(3)典型的离子晶体——NaCl、CsCl、CaF2
①NaCl型:在晶体中,每个Na+同时吸引 个Cl-,每个Cl-同时吸引 个Na+,配位数为 。每个晶胞含 个Na+和 个Cl-。
②CsCl型:在晶体中,每个Cl-吸引 个Cs+,每个Cs+吸引 个Cl-,配位数为 。③CaF2型:在晶体中,每个Ca2+吸引 个F-,每个F-吸引 个Ca2+,每个晶胞含___个Ca2+, 个F-。
(1)定义气态离子形成1 ml离子晶体释放的能量,通常取正值,单位:kJ·ml-1。(2)意义:晶格能越大,表示离子键越强,离子晶体越稳定,熔、沸点越高。(3)影响因素①离子所带电荷数:离子所带电荷数越多,晶格能越大。②离子的半径:离子的半径越小,晶格能越大。
(4)过渡晶体与混合型晶体①过渡晶体:纯粹的分子晶体、共价晶体、离子晶体和金属晶体四种典型晶体是不多的,大多数晶体是它们之间的过渡晶体。人们通常把偏向离子晶体的过渡晶体当作离子晶体来处理,把偏向共价晶体的过渡晶体当作共价晶体来处理。②混合型晶体
石墨层状晶体中,层与层之间的作用是______________,平均每个正六边形拥有的碳原子个数是___,C原子采取的杂化方式是_____。
1.分子晶体不导电,溶于水后也都不导电( )2.沸点:HF
NaOH、(NH4)2S
H2O2、CO2、CCl4、C2H2、晶体氩
2.下列有关晶体类型的判断正确的是
二、常见晶体类型的结构特点3.金刚石和石墨是碳元素形成的两种单质,下列说法正确的是A.金刚石和石墨晶体中最小的环均含有6个碳原子B.在金刚石中每个C原子连接4个六元环,石墨中每个C原子连接3个六元环C.金刚石与石墨中碳原子的杂化方式均为sp2D.金刚石中碳原子数与C—C数之比为1∶4,而石墨中碳原子数与C—C数之比为1∶3
金刚石中每个C原子连接12个六元环,石墨中每个C原子连接3个六元环,B项错误;金刚石中碳原子采取sp3杂化,而石墨中碳原子采取sp2杂化,C项错误;
4.碳化硅(SiC)晶体具有多种结构,其中一种晶体的晶胞(如图所示)与金刚石的类似。下列判断正确的是A.该晶体属于分子晶体B.该晶体中存在极性键和非极性键C.该晶体中Si的化合价为-4D.该晶体中C的杂化类型为sp3
与金刚石类似,该晶体属于共价晶体,A错误;根据该晶体的晶胞结构图可知,该晶体只存在Si—C极性共价键,B错误;Si—C中,C的电负性更强,共用电子对偏向C原子,所以Si的化合价为+4,C错误;
每个C原子与4个Si原子形成4个σ键,C原子没有孤电子对,所以C的杂化类型为sp3,D正确。
5.有关晶体的结构如图所示,下列说法不正确的是A.在NaCl晶体中,距Cl-最近的Na+形 成正八面体B.在CaF2晶体中,每个晶胞平均含有4 个Ca2+C.冰晶体中每个水分子与另外四个水分 子形成四面体结构D.该气态团簇分子的分子式为EF
气态团簇分子不同于晶胞,气态团簇分子中含有4个E原子、4个F原子,则分子式为E4F4或F4E4,故D错误。
晶体熔、沸点高低原因解释
1.不同类型晶体熔、沸点比较答题模板:×××为×××晶体,而×××为×××晶体。
例1 (1)金刚石的熔点比NaCl高,原因是 。(2)SiO2的熔点比CO2高,原因是 。
金刚石是共价晶体,而NaCl是离子晶体
SiO2是共价晶体,而CO2是分子晶体
2.同类型晶体熔、沸点比较(1)分子晶体答题模板:①同为分子晶体,×××存在氢键,而×××仅存在较弱的范德华力。②同为分子晶体,×××的相对分子质量大,范德华力强,熔、沸点高。③同为分子晶体,两者的相对分子质量相同(或相近),×××的极性大,熔、沸点高。④同为分子晶体,×××形成分子间氢键,而×××形成的则是分子内氢键,分子间氢键会使熔、沸点升高。
例2 (1)NH3的沸点比PH3高,原因是_______________________________________________________________________。(2)CO2比CS2的熔、沸点低,原因是___________________________________________________________。(3)CO比N2的熔、沸点高,原因是_______________________________________________________________。
同为分子晶体,NH3分子间存在较强的氢键,而PH3分子间仅有较弱的范德华力
同为分子晶体,CS2的相对分子质量大,范德华力强,熔、沸点高
同为分子晶体,两者相对分子质量相同,CO的极性大,熔、沸点高
(4) 的沸点比 高,原因是___________________________________________________________________________________________。
内氢键,而 形成分子间氢键,分子间氢键会使沸点升高
(2)共价晶体 答题模板:同为共价晶体,×××晶体的键长短,键能大,熔、沸点高。
例3 Si单质比化合物SiC的熔点低,理由是_______________________________________________________________________________________。
晶体硅与SiC均属于共价晶体,晶体硅中的Si—Si比SiC中Si—C的键长长,键能低,所以熔点低
(3)离子晶体答题模板:①阴、阳离子电荷数相等,则看阴、阳离子半径:同为离子晶体,Rn-(或Mn+)半径小于Xn-(或Nn+),故×××晶体晶格能大(或离子键强),熔、沸点高。②阴离子(或阳离子)电荷数不相等,阴离子(或阳离子)半径不相同:同为离子晶体,Rn-(或Mn+)半径小于Xm-(或Nm+),Rn-(或Mn+)电荷数大于Xm-(或Nm+),故×××晶体晶格能大(或离子键强),熔、沸点高。
例4 (1)ZnO和ZnS的晶体结构相似,熔点较高的是ZnO,理由是_______________________________________________________________________________。(2)FeO的熔点小于Fe2O3的熔点,原因是______________________________________________________________________________。
ZnO和ZnS同属于离子晶体,O2-半径小于S2-,故ZnO晶格能大(或离子键强),熔点高
同为离子晶体,Fe2+半径比Fe3+大,所带电荷数也小于Fe3+,FeO的晶格能比Fe2O3小
1.FeF3具有较高的熔点(高于1 000 ℃),其化学键类型是________,FeBr3的相对分子质量大于FeF3,但其熔点只有200 ℃,原因是_________________________________________________________。
FeF3为离子晶体,FeBr3的化学键以共价键为主,属于分子晶体
2.已知:K2O的熔点为770 ℃,Na2O的熔点为1 275 ℃,二者的晶体类型均为___________,K2O的熔点低于Na2O的原因是_______________________________________。
K+的半径大于Na+,K2O的晶格能小于Na2O
3.已知氨(NH3,熔点:-77.8 ℃、沸点:-33.5 ℃),联氨(N2H4,熔点:2 ℃、沸点:113.5 ℃),解释其熔、沸点高低的主要原因:_________________________________________________。
联氨分子间形成氢键的数目多于氨
4.已知氮化硼与砷化镓属于同种晶体类型。则两种晶体熔点较高的是_____(填化学式),其理由是___________________________________________________________。
两种晶体均为共价晶体,N和B原子半径较小,键能较大,熔点较高
5.S位于周期表中第______族,该族元素氢化物中,H2Te比H2S沸点高的原因是______________________________________________________________________,H2O比H2Te沸点高的原因是______________________________________。
两者均为分子晶体且结构相似,H2Te相对分子质量比H2S大,分子间作用力更强
两者均为分子晶体,H2O分子间存在氢键
1.(2022·湖北,7)C60在高温高压下可转变为具有一定导电性、高硬度的非晶态碳玻璃。下列关于该碳玻璃的说法错误的是A.具有自范性B.与C60互为同素异形体C.含有sp3杂化的碳原子D.化学性质与金刚石有差异
自范性是晶体的性质,碳玻璃为非晶态,所以没有自范性,A错误;碳玻璃和C60均是由碳元素形成的不同的单质,所以互为同素异形体,B正确;金刚石与碳玻璃互为同素异形体,性质差异主要表现在物理性质上,化学性质上也有差异,D正确。
2.(2021·天津,2)下列各组物质的晶体类型相同的是A.SiO2和SO3 B.I2和NaClC.Cu和Ag D.SiC和MgO
SiO2为共价晶体,SO3为分子晶体,A错误;I2为分子晶体,NaCl为离子晶体,B错误;Cu和Ag都为金属晶体,C正确;SiC为共价晶体,MgO为离子晶体,D错误。
3.(2021·辽宁,7)单质硫和氢气在低温高压下可形成一种新型超导材料,其晶胞如图。下列说法错误的是A.S位于元素周期表p区B.该物质的化学式为H3SC.S位于H构成的八面体空隙中D.该晶体属于分子晶体
4.[2021·浙江6月选考,26(1)]已知3种共价晶体的熔点数据如下表:
金刚石熔点比晶体硅熔点高的原因是__________________________________________________________________________________________________________________。
共价晶体中,原子半径越小,共价键键能越大,熔点越高,原子半径:C<Si(或键长:C—C<Si—Si),键能:C—C>Si—Si
1.下列关于物质聚集状态的叙述错误的是A.在电场存在的情况下,液晶分子沿着电场方向有序排列B.非晶体的内部原子或分子的排列杂乱无章C.物质的聚集状态除了晶态、非晶态还有塑晶态、液晶态等D.等离子体是指由电子、阳离子组成的带有一定电荷的物质聚集体
液晶分子间的相互作用容易受温度、压力、电场的影响,在电场存在的情况下,液晶分子沿着电场方向有序排列,A正确;内部原子或分子的排列呈现杂乱无章的分布状态的固体物质称为非晶体,B正确;物质的聚集状态有晶态、非晶态还有塑晶态、液晶态等,C正确;等离子体由电子、阳离子和中性粒子组成,正、负电荷大致相等,整体上呈电中性,D错误。
2.下列关于晶体的叙述不正确的是A.晶体的自范性指的是在适宜条件下晶体能够自发地呈现规则的多面体外形的性质B.固体粉末一定不具有晶体的性质C.晶体的对称性是微观粒子按一定规律做周期性有序排列的必然结果D.晶体的各向异性直接取决于微观粒子的排列具有特定的方向性
晶体的自范性是指在适宜条件下,晶体能够自发地呈现规则的多面体外形的性质,故A不选;许多固体粉末仍是晶体,具有晶体的性质,故B选;构成晶体的粒子在微观空间里呈现周期性有序排列,则晶体的对称性是微观粒子按一定规律做周期性有序排列的必然结果,故C不选;晶体在不同方向上物质微粒的排列情况不同,即为各向异性,具有特定的方向性,故D不选。
3.下列说法错误的是A.只含分子的晶体一定是分子晶体B.碘晶体升华时破坏了共价键C.几乎所有的酸都属于分子晶体D.稀有气体中只含原子,但稀有气体的晶体属于分子晶体
分子晶体是分子通过相邻分子间的作用力形成的,只含分子的晶体一定是分子晶体,故A正确;碘晶体属于分子晶体,升华时破坏了分子间作用力,故B错误;几乎所有的酸都是由分子构成的,故几乎所有的酸都属于分子晶体,故C正确;稀有气体是由原子直接构成的,只含原子,故稀有气体的晶体属于分子晶体,故D正确。
4.如图是金属晶体内部的电子气理论示意图。电子气理论可以用来解释金属的性质,其中正确的是A.金属能导电是因为金属阳离子在外加电场作 用下定向移动B.金属能导热是因为自由电子在热的作用下相 互碰撞,从而发生热的传导C.金属具有延展性是因为在外力的作用下,金 属中各原子层间会出现相对滑动,但自由电子可以起到润滑剂的作用,使金属不 会断裂D.合金与纯金属相比,由于增加了不同的金属或非金属,使电子数目增多,所以合 金的延展性比纯金属强,硬度比纯金属小
金属能导电是因为自由电子在外加电场作用下定向移动,A错误;自由电子在热的作用下与金属阳离子发生碰撞,实现热的传导,B错误;在外力的作用下,金属中各原子层间会出现相对滑动,而自由电子与金属阳离子之间的电性作用仍然存在,使得金属不会断裂,C正确;
合金与纯金属相比,由于增加了不同的金属或非金属,相当于填补了金属阳离子之间的空隙,所以一般情况下合金的延展性比纯金属弱,硬度比纯金属大,D错误。
5.根据下表中给出的有关数据,判断下列说法错误的是A.SiCl4是分子晶体B.晶体硼是共价晶体C.AlCl3是分子晶体,加热能升华D.金刚石中的C—C比晶体硅中的 Si—Si弱
SiCl4、AlCl3的熔、沸点低,都是分子晶体,AlCl3的沸点低于其熔点,即在低于熔化的温度下就能气化,故AlCl3加热能升华,A、C正确;晶体硼的熔、沸点很高,所以晶体硼是共价晶体,B正确;由金刚石与晶体硅的熔、沸点相对高低可知,金刚石中的C—C比晶体硅中的Si—Si强,D错误。
6.钡在氧气中燃烧时得到一种钡的氧化物晶体,其结构如图所示,下列有关说法正确的是A.该晶体属于分子晶体B.晶体的化学式为Ba2O2C.该晶体晶胞结构与CsCl相似D.与Ba2+距离相等且最近的Ba2+共有12个
该晶胞是由金属阳离子钡离子和阴离子过氧根离子构成的,属于离子晶体,A错误;
该晶胞中钡离子配位数是6,过氧根离子配位数是6,氯化铯晶体中离子配位数是8,C错误。
7.(2022·吉林高三模拟)下列说法正确的是A.基态钙原子核外有2个未成对电子B.CaTiO3晶体中与每个Ti4+最邻近的O2-有12个(如图是其晶 胞结构模型)C.分子晶体中都存在共价键D.金属晶体的熔点都比分子晶体的熔点高
基态钙原子核外电子排布式为1s22s22p63s23p64s2,均为成对电子,故A错误;由该晶胞可知,每个Ti4+最邻近的O2-有12个,故B正确;分子晶体中不一定都存在共价键,如稀有气体为单原子分子,其分子晶体中只有分子间作用力,故C错误。
C项,6.4 g CaC2为0.1 ml,则含阴离子0.1 ml,正确;D项,与每个Ca2+距离相等且最近的Ca2+有4个,错误。
9.如图是从NaCl或CsCl晶体结构图中分割出来的部分结构图,其中属于从NaCl晶体中分割出来的结构图是
A.图①和图③ B.图②和图③C.图①和图④ D.只有图④
10.石英晶体的平面示意图如图,它实际上是立体的网状结构(可以看作是晶体硅中的每个Si—Si中插入一个O),其中硅、氧原子数比是m∶n,下列有关叙述正确的是A.m∶n=2∶1B.6 g该晶体中含有0.1NA个分子
D.石英晶体中由硅、氧原子构成的最小的环上含有的Si、 O原子个数和为8
原硅酸(H4SiO4)的结构可表示为 ,两个原硅酸分子可发生分子间脱水生成二聚原硅酸: ,
6个H+后,形成带6个负电荷的二聚原硅酸根离子;在SiO2晶体中,由Si、O构成的最小单元环中共有12个原子。
11.锂、铁单质晶胞分别如图甲、乙所示,锂、铁晶胞的配位数之比为________。
由晶胞结构可知,锂晶胞中,顶点锂原子与体心锂原子的距离最近,故锂原子的配位数为8;铁晶胞中,顶点铁原子与面心铁原子的距离最近,故铁原子的配位数为12;则锂、铁晶胞的配位数之比为2∶3。
12.(1)某些氧化物的熔点数据如下表所示:
解释表中氧化物之间熔点差异的原因:______________________________________________________________________________________________________________________________________________________________________________。
Cs2O和PbO是离子晶体,熔化需破坏离子键,CO2是分子晶体,熔化需克服范德华力,范德华力比离子键弱,所以CO2晶体熔点低;两种离子晶体中PbO的Pb2+半径小,所带电荷数多,所以熔点高
(2)NaF的熔点_____(填“>”“=”或“<”) 的熔点,其原因是______________________________________________________________________________________________________________。
F-的半径小,则NaF的离子键强,熔点高
13.完成下列问题(1)A、B、C、D为四种晶体,性质如下:A.固态时能导电,能溶于盐酸B.能溶于CS2,不溶于水C.固态时不导电,熔融态时能导电,可溶于水D.固态、熔融态时均不导电,熔点为3 500 ℃试推断它们可能的晶体类型:A.___________;D.__________。
(2)下图中A~D是常见的几种晶体结构模型,请填写相应物质的名称:
A________;B________;C__________;D_________。
(人教版)高考化学一轮复习讲义课件第9章第36讲 物质的聚集状态 常见晶体类型(含解析): 这是一份(人教版)高考化学一轮复习讲义课件第9章第36讲 物质的聚集状态 常见晶体类型(含解析),共60页。PPT课件主要包含了常见晶体类型,练真题明考向,课时精练等内容,欢迎下载使用。
2025届高中化学全程复习构想课件全套31物质的聚集状态 常见晶体类型: 这是一份2025届高中化学全程复习构想课件全套31物质的聚集状态 常见晶体类型,共52页。PPT课件主要包含了考点一,考点二,考点三,各向异性,X射线衍射,答案A,答案B,答案C,阳离子,共价键等内容,欢迎下载使用。
大单元三 第九章 第36讲 物质的聚集状态 常见晶体类型-2025年高考化学大一轮复习(人教版)【配套PPT课件】: 这是一份大单元三 第九章 第36讲 物质的聚集状态 常见晶体类型-2025年高考化学大一轮复习(人教版)【配套PPT课件】,共60页。PPT课件主要包含了常见晶体类型,练真题明考向,课时精练等内容,欢迎下载使用。












