
高中化学人教版 (2019)必修 第二册实验活动6 化学能转化成电能学案设计
展开1.理解氧化还原反应在化学能转化成电能过程中的作用,体会化学的价值。
2.认识原电池的构成要素及其作用。
实验用品
器材:烧杯、导线、电流表。
试剂:锌片、铜片、石墨棒、稀硫酸。
实验过程和结论
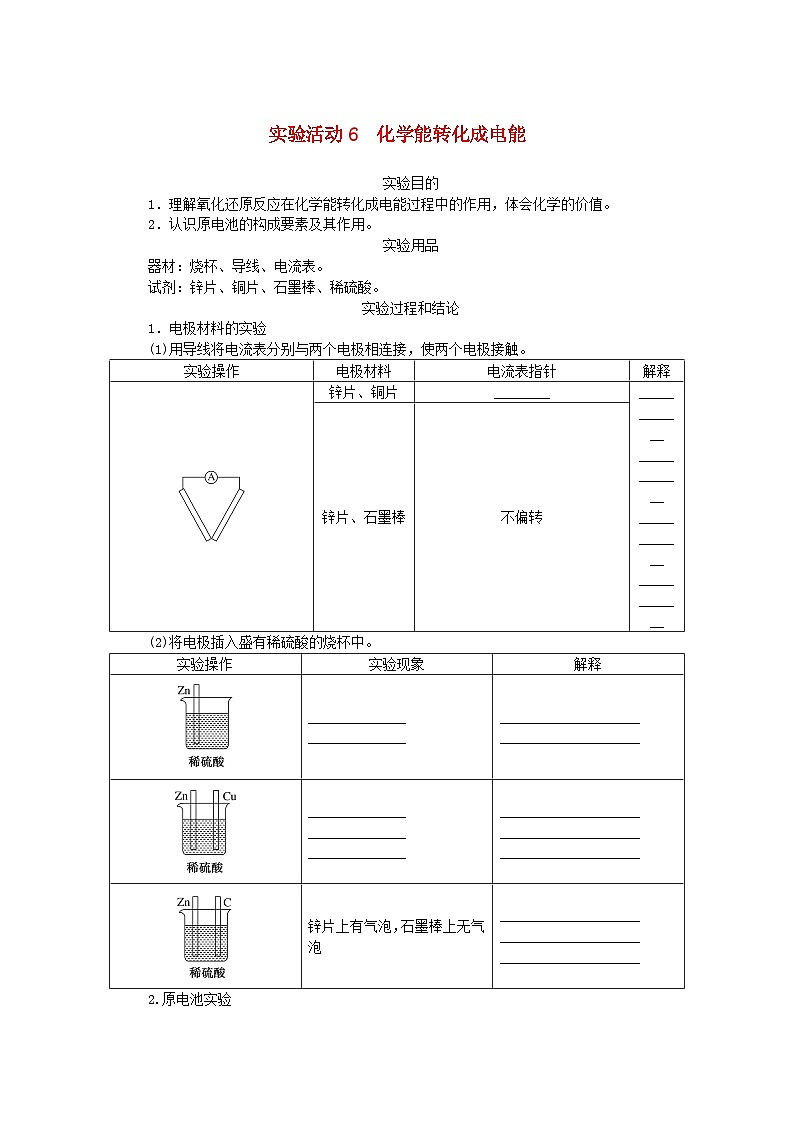
1.电极材料的实验
(1)用导线将电流表分别与两个电极相连接,使两个电极接触。
(2)将电极插入盛有稀硫酸的烧杯中。
2.原电池实验
选择不同的电极材料,以及稀硫酸、导线和电流表,组装原电池,如图:
试验其能否产生电流,并作出解释。
问题和讨论
1.根据以上实验,说明原电池的工作原理和构成要素,以及组装原电池的操作注意事项。
2.能否用铁片作为电极代替铜锌原电池中的锌片?为什么?
3.若将稀硫酸换为硫酸铜溶液,①~③能否构成原电池?
练习与应用
1.现有如下两个反应:
A.NaOH+HCl===NaCl+H2O
B.Cu+2Ag+===2Ag+Cu2+
(1)根据两反应本质,判断能否设计成原电池____________________。
(2)如果不能,说明其原因________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(3)如果可以,则写出正负极材料、其电极反应式、反应类型(“氧化反应”或“还原反应”)。
负极:________________,________________,________________;
正极:________________,________________,________________。
2.为了探究影响铝在原电池中作正极或负极的因素,设计如下实验。
3.研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电,
总反应为2Li+2H2O===2LiOH+H2↑。
(1)该电池的负极是________,负极反应是________________________________________________________________________
________________________________________________________________________。
(2)正极现象是________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(3)放电时OH-向____________移动(填“正极”或“负极”)。
实验活动6 化学能转化成电能
实验过程和结论
1.(1)不偏转 没有电解质溶液,不发生氧化还原反应
(2)锌片上有气泡 锌与稀硫酸反应生成氢气 锌片上有气泡,铜片上无气泡 锌与稀硫酸反应生成氢气,铜与稀硫酸不反应 锌与稀硫酸反应生成氢气,石墨棒与稀硫酸不反应
2.①构成原电池,将化学能转化为电能 ②有气泡 偏转 构成原电池,将化学能转化为电能 ③无氧化还原反应发生,不能构成原电池
问题和讨论
1.提示:构成原电池的条件有①两种活泼性不同的金属;②电解质溶液;③形成闭合回路;④有—个能自发进行的氧化还原反应。原电池是将氧化反应和还原反应分别在不同的区域发生,使电子在导线中转移,产生电流。
2.提示:铁片代替锌片后,铁能够与稀硫酸反应,仍然具备构成原电池的条件,仍然有电流产生。
3.提示:由于锌能与硫酸铜发生氧化还原反应,故①②仍然构成原电池,③不能。
练习与应用
1.解析:(1)只有自发的氧化还原反应才能设计成原电池,B是氧化还原反应且能自发进行。(3)根据电池反应式Cu+2Ag+===2Ag+Cu2+可知,Cu失电子作负极,负极材料是Cu,正极材料应是比铜不活泼的金属或能导电的非金属;Ag+得电子,所以此电解质溶液只能为AgNO3溶液。
答案:(1)A反应不能,B反应可以
(2)A反应不是氧化还原反应,没有电子转移
(3)Cu Cu-2e-===Cu2+ 氧化反应 碳棒、银、铂、金(任选其一) Ag++e-===Ag 还原反应
2.答案:镁比铝活泼,铝作正极 铝比铜活泼,铝作负极 铝能与氢氧化钠溶液发生氧化还原反应,而镁不能 另一电极的活泼性、电解质溶液
3.解析:金属锂比铁活泼,作原电池的负极,电极反应式为Li-e-===Li+,LiOH溶液中的阳离子有Li+和H+,由于氧化性H+>Li+,所以正极反应是2H++2e-===H2↑,正极产生无色气体;在原电池的放电过程中,阳离子向正极移动,阴离子向负极移动,所以OH-向负极移动。
答案:(1)锂 Li-e-===Li+
(2)有无色气体产生
(3)负极
实验操作
电极材料
电流表指针
解释
锌片、铜片
________
____________
____________
____________
____________
锌片、石墨棒
不偏转
实验操作
实验现象
解释
______________
______________
____________________
____________________
______________
______________
______________
____________________
____________________
____________________
锌片上有气泡,石墨棒上无气泡
____________________
____________________
____________________
编号
电极材料
实验现象
解释
①
锌片、铜片
锌片上无气泡,铜片上有气泡,电流表指针偏转
______________
______________
②
锌片、
石墨棒
锌片上无气泡,石墨棒上__________,电流表指针________
______________
______________
③
铜片、
石墨棒
无明显现象
______________
______________
电解质
溶液
左侧电
极材料
实验现象
解释
稀硫酸
镁片
镁片上无气泡,铝片上有气泡,电流表指针偏转
________________
________________
稀硫酸
铜片
铝片上无气泡,铜片上有气泡,电流表指针偏转
________________
________________
氢氧化
钠溶液
镁片
铝片上无气泡,镁片上有气泡,电流表指针偏转
________________
________________
________________
实验
结论
铝在原电池中作正极或负极的影响因素有________________________________________________________________________
________________________________________________________________________
高中化学人教版 (2019)必修 第二册实验活动6 化学能转化成电能精品导学案: 这是一份高中化学人教版 (2019)必修 第二册<a href="/hx/tb_c4000042_t4/?tag_id=42" target="_blank">实验活动6 化学能转化成电能精品导学案</a>,共3页。
高中化学人教版 (2019)必修 第二册第六章 化学反应与能量实验活动6 化学能转化成电能导学案及答案: 这是一份高中化学人教版 (2019)必修 第二册<a href="/hx/tb_c4000042_t4/?tag_id=42" target="_blank">第六章 化学反应与能量实验活动6 化学能转化成电能导学案及答案</a>,共3页。
高中化学人教版 (2019)必修 第二册实验活动6 化学能转化成电能学案: 这是一份高中化学人教版 (2019)必修 第二册<a href="/hx/tb_c4000042_t4/?tag_id=42" target="_blank">实验活动6 化学能转化成电能学案</a>,共7页。













