


高中化学鲁科版 (2019)选择性必修2第3节 元素性质及其变化规律优质课课件ppt
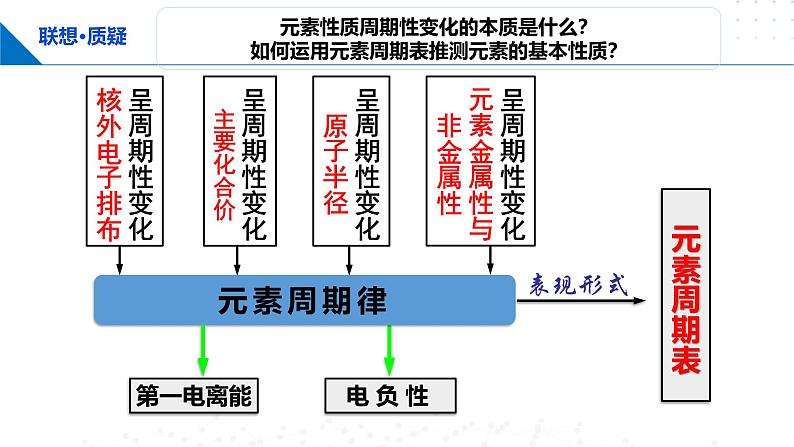
展开请你回忆!在元素周期表中,随着原子序数的递增,元素的哪些性质呈现周期性变化?
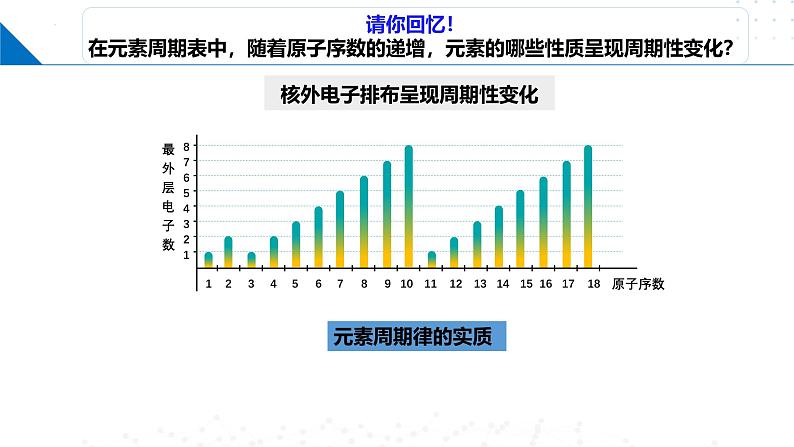
核外电子排布呈现周期性变化
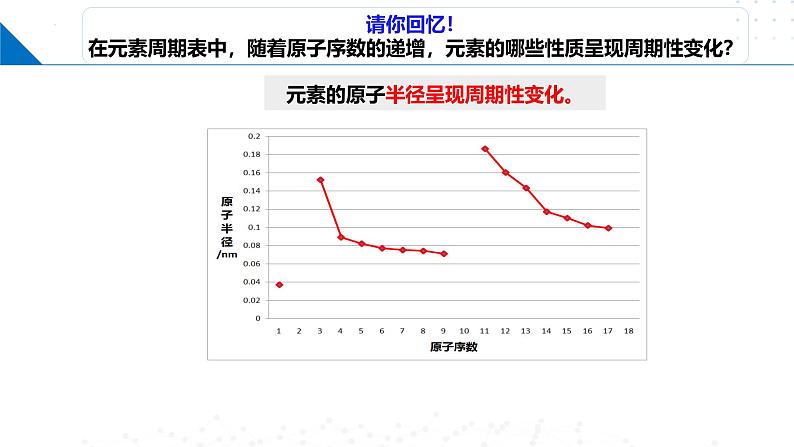
元素的原子半径呈现周期性变化。
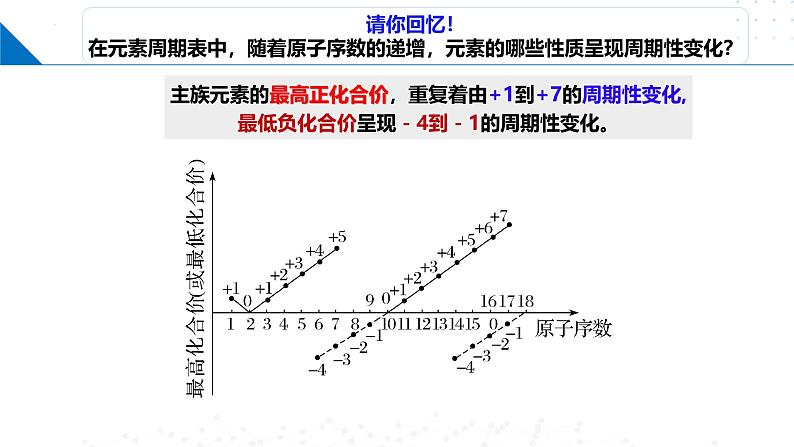
主族元素的最高正化合价,重复着由+1到+7的周期性变化,最低负化合价呈现-4到-1的周期性变化。
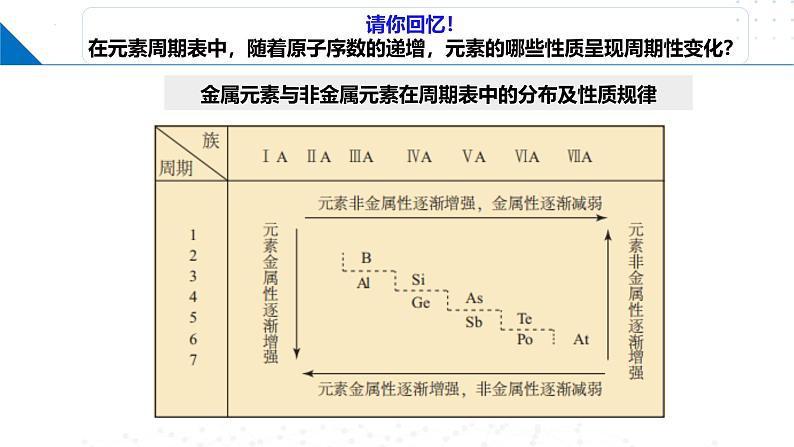
金属元素与非金属元素在周期表中的分布及性质规律
第 3 节 元素性质及其变化规律
第一章 原子结构与元素性质
课时1 原子半径及其变化规律
学生在学习了化学必修第二册后就已经能从原子结构的角度,结合元素周期表定性地判断元素原子得失电子的难易程度;但是对"元素性质周期性变化的内在本质是什么?能否定量地判断元素原子得失电了的能力?"这样的问题,只有对原了结构模型有了更深入的学习后,才能得到很好的解答。 本节教材的编写就是建立在学生学习了核外电子排布和核外电子排布与元素周期表关系的基础上,通过"联想·质疑"引出学习目的;通过"联想·质疑""观察·思考""交流·研讨"中的活动,引导学生在活动中主动认识元素原子核外电子排布周期性变化对原子半径、原子得失电子能力的影响,使他们对元素周期律的认识更为深刻,并能构建起新的"构(原子结构)—位(元素在周期表中的位置)—性(元素性质)"三者关系的认识平台。
元素性质周期性变化的本质是什么?如何运用元素周期表推测元素的基本性质?
呈周期性变化核外电子排布
呈周期性变化主要化合价
呈周期性变化原子半径
呈周期性变化元素金属性与非金属性
meiyangyang8602
原子半径是如何测定的?
依据量子力学理论,在原子核外,从原子核附近到离核很远的地方,电子都有可能出现,因此原子并不是一个具有明确“边界”的实体,也就是说,原子并没有经典意义上的半径。但是,由于核外电子运动区域的大小对于元素原子的性质有很大的影响,为了便于讨论这方面的问题,人们便假定原子是一个球体,并采用统计的方法来测定原子半径。
测定原子半径的方法很多。常用的一种方法是根据固态单质的密度算出1ml原子的体积,再除以阿伏加德罗常数,得到一个原子在固态单质中平均占有的体积,进而得到其原子半径。
另一种更常用的方法是,指定化合物中两个相邻原子的核间距为两个原子的半径之和,再通过实验来测定分子或固体中原子的核间距,从而求得相关原子的原子半径。
一是共价半径,由共价分子或共价晶体中原子的核间距计算得出;
二是是范德华半径,由分子晶体中共价分子之间的最短距离计算得出;
三是金属半径,由金属晶体中原子之间的最短距离计算得出。
请你观察!教材P21“元素的原子半径及相应的比例模型”
总结归纳元素的原子半径随着元素原子序数的递增呈现的周期性变化规律
随着原子序数的增大,元素的原子半径自左至右呈逐渐减小的趋势
这是因为每增加一个电子,核电荷相应增加一个正电荷;增加的电子排布在同一层上,增加的电子产生的电子间的排斥作用小于核电荷增加导致的核对外层电子的吸引作用,结果使原子半径逐渐减小。
自上而下,随着原子序数的逐渐增大,原子半径逐渐增大
这是因为随着电子层数的增加,离核更远的外层轨道填入电子,电子层数的影响大于核电荷增加的影响,导致原子半径增大
同一周期(如第 4 周期)的过渡元素与主族元素相比,从总的变化趋势来看,从左到右原子半径的变化幅度不大
这是因为增加的电子都排布在 (n1)d 轨道上,不同元素原子的外层电子(ns)受到原子核吸引作用及内层电子排斥作用的总体效果差别不大。
(1) 电子层数越多:半径越大。
(2) 电子层数相同时:核电核数越大,半径越小。
“序大径小”、“价高径小”
电子层结构相同的离子,随核电荷数增大,离子半径减小
如r(S2-)>r(Cl-)>r(K+)>r(Ca2+)。
(3) 电子层数、核电荷数都相同时:电子数越多,半径越大。
如r(Fe2+)>r(Fe3+),r(Cu+)>r(Cu2+)。
【例1】下列各组微粒不是按半径逐渐增大的顺序排列的是( )A.Na、K、Rb B.F、Cl、BrC.Mg2+、Al3+、Zn2+ D.Cl-、Br-、I-
1,已知An+、B(n+1)+、Cn-、D(n+1)-都具有相同的电子层结构,则A、B、C、D的原子半径由大到小的顺序是______________________,离子半径由大到小的顺序是__________________________,原子序数由大到小的顺序是________________________。
2、下列离子半径的大小顺序正确的是( ) ①Na+:1s22s22p6 ②X2-:1s22s22p63s23p6 ③Y2-:1s22s22p6 ④Z-:1s22s22p63s23p6 A.③>④>②>① B.④>③>②>① C.④>③>①>② D.②>④>③>①
3,下列化合物中阳离子半径与阴离子半径比值最小的是( )A.NaF D.KBr
请你思考!如何利用原子半径和价电子数进行解释元素原子得失电子能力?
电子层数相同核电荷数增多
原子失电子能力逐渐减弱,得电子能力逐渐增强
原子核对最外层电子的吸引力增强
金属性逐渐减弱,非金属性逐渐增强
失电子能力逐渐减弱,得电子能力逐渐增强
位于元素周期表中金属与非金属元素分界线周围元素的原子获得或失去电子的能力都不强。
请你猜想!尝试寻找能定量地衡量或比较原子得失电子能力的方法
26岁英国化学家巴特列特
首次合成出O2PtF6
1 175.5 kJ·ml-1
1 170.0 kJ·ml-1
科学家通常用电离能来表示元素原子或离子失去电子的难易程度
元素的电离能及其变化规律
气态基态原子或气态基态离子失去一个电子所需要的最小能量称为电离能(inizatin energy),常用符号 I 表示,单位kJ·ml-1。
气态基态原子失去一个电子转化为气态基态正离子所需要的最低能量叫做第一电离能。
元素原子失去一个电子后,再失去一个电子的电离能,常用符号 I2表示;
同一原子的各级电离能之间存在如下关系:I1
第一电离能越小,越___失电子,金属性越强
第一电离能越大,越难失电子,金属性越弱
通常运用电离能数值来判断金属元素的原子在气态时失去电子的难易程度。
观察图 1-3-4,说明元素的第一电离能随着元素原子序数的递增呈现的变化规律,并从原子结构的角度加以解释
对于同一周期的元素而言,碱金属元素的第一电离能最小,稀有气体元素的第一电离能最大;从左到右,元素的第一电离能在总体上呈现从小到大的变化趋势,表示元素原子越来越难失去电子
同周期元素原子电子层数相同,但随着核电荷数增大,原子核对外层电子的有效吸引作用增强。
同周期从左到右:第一电离能逐渐增大
同周期的第一电离能:ⅡA大于ⅢA,ⅤA大于ⅥA
第二周期Be第一电离能大于B,N大于O;第三周期Mg大于Al,P大于S的原因是什么?
I1(ⅡA)>I1(ⅢA)
ⅡA为ns2(全充满)
I1(ⅤA)>I1(ⅥA)
ⅤA为ns2np3(半充满)
Be:1S2 2S22P0 (B:1S2 2S22P1) N:1S2 2S22P3 (O:1S2 2S22P4) Mg:1S2 2S22P6 3S23P0 (Al:1S2 2S22P6 3S23P1) P:1S2 2S22P6 3S23P3 (S:1S2 2S22P6 3S23P4)
对于同一周期的过渡元素而言,从左到右随着元素原子序数的增加,第一电离能总体上略有增加。
这是因为对这些元素的原子来说,增加的电子大部分排布在 (n-1)d 或 (n-2)f 轨道上,原子核对外层电子的有效吸引作用变化不是太大。
同主族元素,总体上自上而下第一电离能逐渐减小,表明自上而下原子越来越容易失去电子
这是因为同主族元素原子的价电子数相同,但自上而下,原子半径逐渐增大,原子核对外层电子的有效吸引作用逐渐减弱。
1,判断下列元素间的第一电离能的大小:Na K; O N; N P; F Ne; Mg Al; S P; Cl S; Cl Ar。
①K Na Li ②B C Be N ③He Ne Ar ④Na Al S P
2,将下列元素按第一电离能由大到小的顺序排列:
3,气态原子生成+1价气态阳离子所需要的能量称为第一电离能。元素的第一电离能是衡量元素金属性强弱的一种尺度。下列有关说法不正确的是( )A.一般来说,元素的第一电离能越大,其金属性越弱B.元素N的第一电离能大于元素O的第一电离能C.金属单质跟酸反应的难易,只跟该金属元素的第一电离能有关D.金属单质跟酸反应的难易,除跟该金属元素的第一电离能有关外,还与该单质中固态金属原子以及该金属原子失去电子后在水溶液里形成水合离子的变化有关
鲁科版 (2019)选择性必修2第3节 元素性质及其变化规律优秀课件ppt: 这是一份鲁科版 (2019)选择性必修2<a href="/hx/tb_c4002597_t3/?tag_id=26" target="_blank">第3节 元素性质及其变化规律优秀课件ppt</a>,共41页。PPT课件主要包含了教材分析,电离能的应用等内容,欢迎下载使用。
鲁科版 (2019)选择性必修2第3节 元素性质及其变化规律课前预习课件ppt: 这是一份鲁科版 (2019)选择性必修2<a href="/hx/tb_c4002597_t3/?tag_id=26" target="_blank">第3节 元素性质及其变化规律课前预习课件ppt</a>,共45页。PPT课件主要包含了教材分析,元素周期律,表现形式,元素周期表,第一电离能,电负性,原子半径及其变化规律,原子半径,ABDC,DCAB等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修2第二节 原子结构与元素的性质课文内容ppt课件: 这是一份高中化学人教版 (2019)选择性必修2第二节 原子结构与元素的性质课文内容ppt课件,共36页。PPT课件主要包含了学习目标,复习回顾,知识点一,思考讨论,拓展延伸,Na+﹥Mg2+,练一练,知识点二,元素的电离能,电离能越小等内容,欢迎下载使用。













