


高中沪科技版(2020)1.1 化学反应与能量变化评优课ppt课件
展开1.理解能量守恒定律在化学反应中的应用2.知道内能的含义3.知道化学反应中的能量转化形式4.了解反应焓变与反应热的关系
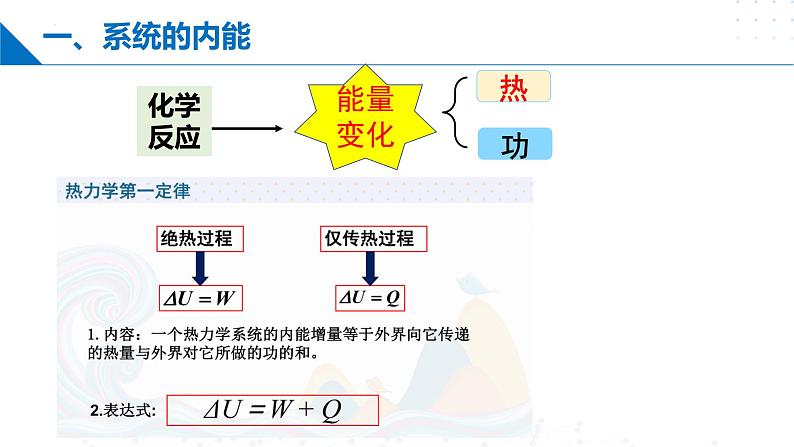
U、Q、W分别表示什么?有什么关系?
▷ U 『内能』系统内物质各种能量的总和
▷ Q 『热』系统与环境之间由于温度差交换或传递的能量
▷ W 『功』除热以外,其他各种形式传递的能量
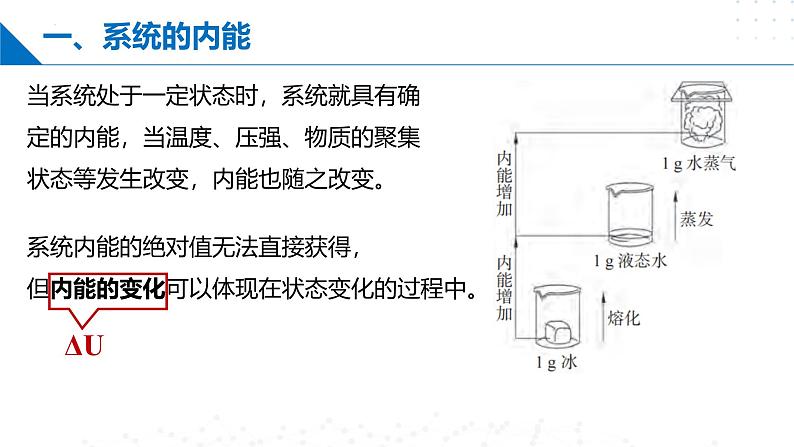
当系统处于一定状态时,系统就具有确定的内能,当温度、压强、物质的聚集状态等发生改变,内能也随之改变。
系统内能的绝对值无法直接获得,但内能的变化可以体现在状态变化的过程中。
化学反应实现了化学能与其他能量形式之间的转化,其中化学能与热能之间的转化是最常见的一种形式。
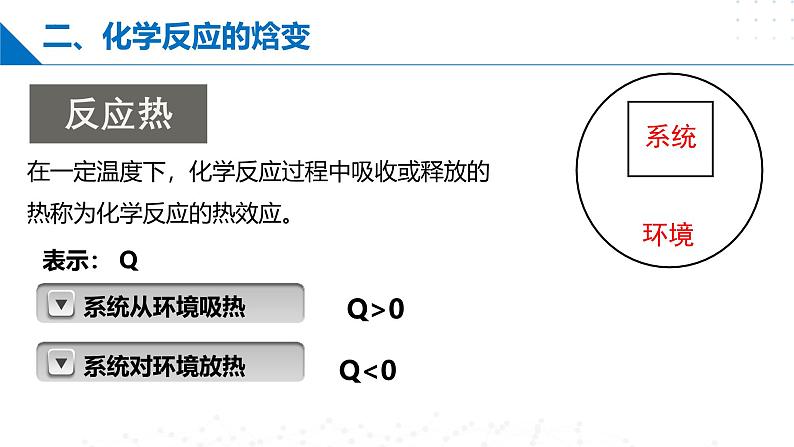
在一定温度下,化学反应过程中吸收或释放的热称为化学反应的热效应。
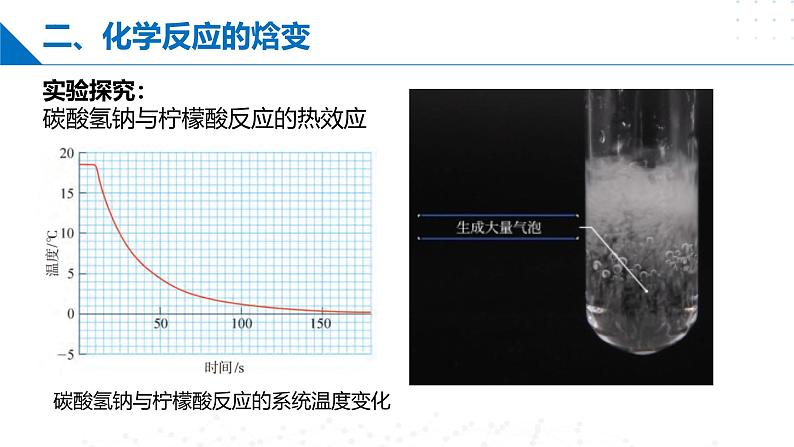
实验探究:碳酸氢钠与柠檬酸反应的热效应
碳酸氢钠与柠檬酸反应的系统温度变化
在化工生产和科学实验中,化学反应通常是在敞口容器中进行的,反应体系的压强与外界压强相等,即反应是在等压条件下进行的。
焓是与内能有关的物理量,用符号H表示。
人们常用系统的焓的变化,即焓变(ΔH)来表示在等压、只做体积功条件下的反应热。
∆H=∑H(生成物)- ∑H(反应物)
2H2 (g) + O2 (g) == 2H2O (g) ΔH = —484 kJ · ml—12HgO (s) == 2Hg (l) + O2 (g) ΔH = 182 kJ · ml—1
中和反应、燃烧、多数化合反应、铝热反应、自发的氧化还原反应……
Ba(OH)2·8H2O和NH4Cl固体的反应多数分解反应某些需要持续加热的反应……
物质能量越低,键能越大
ΔH=反应物键能总和(E1)-生成物键能总和(E2)
键能:在25 ℃和101 kPa下,断开1 ml 气态分子AB(g)中的共价键,使其生成气态原子 A(g)和 B(g)所吸收的能量。
∆H2=−436 kJ/ml
∆H1=+436 kJ/ml
化学键断裂和形成时的能量变化是化学反应中能量变化的主要原因。
H2(g) + Cl2(g) === 2HCl(g)
吸收436 kJ + 243 kJ=679 kJ
释放431 kJ/ml×2 ml=862kJ
∆H=−183 kJ/ml
依据信息估算2 ml H2(g) 和1 ml O2(g) 反应生成2 ml H2O(g) 的反应热∆H=?
∆H=−483.6 kJ/ml
1 ml N2分子中的化学键断裂吸收的能量是_ kJ,1 ml O2分子中的化学键断裂吸收的能量是_ kJ,2 ml NO分子中的化学键形成释放的能量是_ kJ,则N2(g)+O2(g)===2NO(g)的反应吸收的热量为_ kJ。
常见的几种ΔH大小比较方法
H2(g)+ O2(g)===H2O(l) ΔH1=-a kJ·ml-1;2H2(g)+O2(g)===2H2O(l) ΔH2=-b kJ·ml-1,
ΔH2<ΔH1<0,且b=2a。
ΔH1<ΔH2<0,且a>b。
S(g)+O2(g)===SO2(g) ΔH1=-a kJ·ml-1S(s)+O2(g)===SO2(g) ΔH2=-b kJ·ml-1
C(s,石墨)+O2(g)===CO2(g) ΔH1=-a kJ·ml-1C(s,金刚石)+O2(g)===CO2(g) ΔH2=-b kJ·ml-1
①其他条件相同,燃烧越充分,放出的热量越多,ΔH越小。
C(s)+ O2(g)===CO(g) ΔH1C(s)+O2(g)===CO2(g) ΔH2
②对于可逆反应,由于反应物不可能完全转化为生成物,所以实际放出(或吸收)的热量小于相应的热化学方程式中的ΔH的绝对值。
2SO2(g)+O2(g)⇌2SO3(g) ΔH=-197 kJ·ml-1,向密闭容器中通入2 ml SO2(g)和1 ml O2(g),发生上述反应,达到平衡后,放出的热量 197 kJ,ΔH为 。
-197 kJ·ml-1
反应热焓变宏观表现微观分析
1、反应A+B―→C(ΔH<0)分两步进行:①A+B―→X(ΔH>0),②X―→C(ΔH<0)。下列示意图中,能正确表示总反应过程中能量变化的是( )
鲁科版 (2019)选择性必修1第2章 化学反应的方向、 限度与速率第1节 化学反应的方向获奖ppt课件: 这是一份鲁科版 (2019)选择性必修1<a href="/hx/tb_c4002580_t3/?tag_id=26" target="_blank">第2章 化学反应的方向、 限度与速率第1节 化学反应的方向获奖ppt课件</a>,共17页。PPT课件主要包含了盖斯定律,如何理解盖斯定律,学以致用,燃烧热,化石燃料,新能源,天然气,属于不可再生能源,开源节流,开发新能源等内容,欢迎下载使用。
高中鲁科版 (2019)第1节 化学反应的方向获奖ppt课件: 这是一份高中鲁科版 (2019)<a href="/hx/tb_c4002580_t3/?tag_id=26" target="_blank">第1节 化学反应的方向获奖ppt课件</a>,共17页。PPT课件主要包含了温故知新,2符号U,交流研讨,课堂练习等内容,欢迎下载使用。
高中化学鲁科版 (2019)选择性必修1第1章 化学反应与能量转化第1节 化学反应的热效应一等奖ppt课件: 这是一份高中化学鲁科版 (2019)选择性必修1<a href="/hx/tb_c4002573_t3/?tag_id=26" target="_blank">第1章 化学反应与能量转化第1节 化学反应的热效应一等奖ppt课件</a>,共22页。PPT课件主要包含了联想●质疑,是放热反应,是吸热反应,化学反应的反应热,什么是反应热,中和热,实验步骤等内容,欢迎下载使用。













