












沪科技版(2020)选择性必修3第1章 认识有机化学1.1有机化学的建立和发展有机化学的建立和早期发展优秀ppt课件
展开国家游泳中心“水立方”
没有有机化学建立与发展,就没有现代生活!
有机化学的建立和早期发展
酿酒、造纸、制糖、豆腐发酵都是涉及到了到有机反应
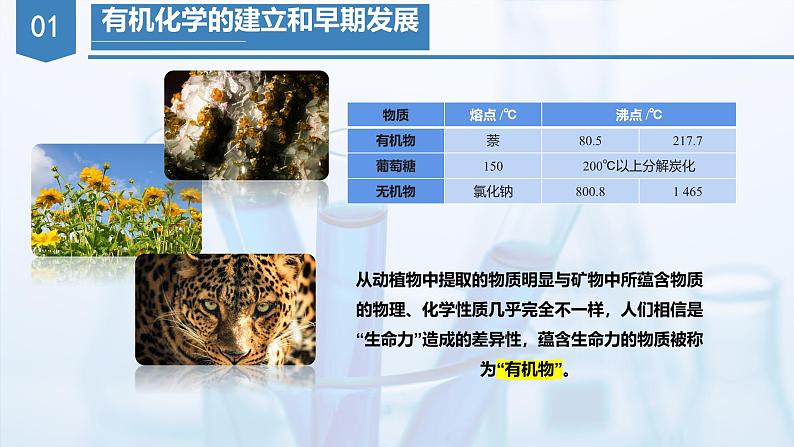
从动植物中提取的物质明显与矿物中所蕴含物质的物理、化学性质几乎完全不一样,人们相信是“生命力”造成的差异性,蕴含生命力的物质被称为“有机物”。
瑞典化学家贝采利乌斯 (Jöns Jacb Berzelius,1779—1848)
1808 年,瑞典化学家贝采利乌斯 在对有机物深入研究的基础上,首次提出了“有机化学”这一概念。
1828~1854年,尿素、草酸、醋酸等被认为只能在有机体内发现的物质的合成,宣告了“生命力‘’假说的破产!
1770年——1806年——1828年——1848年——1874年——
人类认识有机化学的历史沿袭图谱
进入 19 世纪后半叶,有机化学的发展逐渐进入爆发期。
元素分析发现有机物都含碳,巨大多数含有氢,一部分还有氮/氧元素,于是化学家们认为,碳是构成有机物的基本元素,把含碳化合物称为有机物。
NH3 +CO2 → CO (NH2)2
CO (NH2)2+H2O→2NH3+CO2
有机物与无机物在一定条件下是可以转变的
奥运火炬燃料:丙烷(C3H8)
装修污染物:苯(C6H6) 甲苯C7H8)
当代有机化学化合物数目已经达到几千万之多
进入 20 世纪,随着原子结构的发现,有机化学从实验 方法到基础理论都有了巨大的进展,也产生了不少分支学科,包括有机合成化学、高分子化学、天然产物化学、有机分析、有机立体化学等。
当代的有机化学实验室仪器
有机合成是创造有机物分子的主要手段。化学家们通 过选择不同的起始原料,经过一系列基本合成反应,获得 目标分子。通过对不同合成路线的评价,可以筛选出有工业前景的生产方法和工艺,这也是现代有机合成的发展方向之一。
有机化学合成之父-罗伯特·伯恩斯·伍德沃德(Rbert Burns Wdward)
中国当代知名有机化学家-邢其毅
中国诺贝尔化学奖获得者-屠呦呦
现代有机化学的研究方法
思考与讨论 给你一瓶白酒为样品研究乙醇的分子结构, 你会怎么研究?
研究有机化合物的基本步骤:
学习任务一:分离提纯的常用方法
1.什么是物质的分离、提纯?
(1)物质的分离是把混合物的各种成分物质分开的过程,分开以后的各物质应该尽量减少损失。
(2)物质的提纯是将某物质中的杂质,采用物理或化学方法除掉的过程。
两者主要区别在于提纯除掉后的杂质可以不进行恢复。
2.分离、提纯物质的方法有哪些?
思考与讨论2: 下列物质中的杂质(括号中是杂质)可以用什么方法除去?
(1)乙醇(水) (2)KNO3(NaCl ) (3)乙酸乙酯(乙醇)(4)甲烷(乙烯) (5)NaCl(泥沙) (6)碘(水)
分离、提纯的方法:物理方法:溶解、过滤、重结晶、升华、蒸发、蒸馏、萃取、分液、液化、汽化、渗析、盐析、洗气等。化学方法:加热分解、氧化还原转化、生成沉淀、酸碱中和、络合、水解、化学方法洗气等。
杂转纯杂变沉化为气溶剂分
3.分离提纯的总原则是什么?
被提纯物质和杂质易分离
被提纯物质易恢复原状态
有机物的分离提纯:蒸馏(分馏)法、萃取分液法、结晶(重结晶)法等
1、某同学欲用96%的工业酒精制取无水乙醇,思考并回答:(1)应采用什么方法进行分离、提纯?(2)选择该方法的依据是什么?
学习任务2:有机物的分离、提纯
已知:乙醇沸点78.5℃、水的沸点为100℃、沸点差距相对不大,所以工业乙醇(主要成分是乙醇,含有水、甲醇杂质),通过蒸馏可获得95.6%乙醇和4.4%水的共沸混合物(沸点78.15℃)。那么我们想要得到无水乙醇该如何操作呢?
2、观看实验视频,思考并回答:(3)该实验操作主要仪器有哪些?(4)实验操作中有有哪些注意事项?
原因:1.CaO和水反应生成的Ca(OH)2是糊状物,过滤时会堵塞滤纸孔。2.Ca(OH)2微溶,少量Ca2+、OH-等离子会透过滤纸导致乙醇不纯。
加吸水剂[CaO 或 MgSO4 ]吸收水后再蒸馏出无水乙醇
CaO+H2O=Ca(OH)2
(1)蒸馏原理在一定温度和压强下,加热液态混合物,利用物质沸点差异进行物质分离的方法,使沸点低的物质汽化,然后冷凝、收集,从而达到与沸点高的物质相分离的目的。
(2)蒸馏提纯的条件 : 液态混合物 有机物热稳定性较强(加热不分解);与杂质的沸点相差较大(一般约大于30℃)
温度计水银球应处于蒸馏烧瓶的支管口处
铁架台、酒精灯、石棉网、蒸馏烧瓶、沸石、温度计、导管、冷凝管、橡胶管、牛角管、锥形瓶
甲烷与氯气发生取代反应,反应历程如下:
分离液态混合物中含二氯甲烷、三氯甲烷和四氯化碳的方法是什么?
1、若要分离出碘水中的碘,思考并回答:(1)应采用什么方法进行分离、提纯?(2)选择该方法的依据是什么?2、观看实验视频,思考并回答:(3)该实验操作主要仪器有哪些?(4)实验中四氯化碳的作用是?选择依据是?(5)实验操作中有有哪些注意事项?
(1)原理:利用混合物中一种溶质在互不相溶的两种溶剂中的溶解性不同,用一种溶剂把溶质从它与另一种溶剂组成的溶液中提取出来的方法。 (2)主要仪器:分液漏斗
固—液萃取:是用有机溶剂从固体物质中溶解出有机物的过程。(专用仪器设备)
(4)萃取剂的选择:①与原溶剂互不相溶②被萃取的物质在萃取剂中的溶解度要大得多③被萃取的物质不与溶剂反应
常见的有机萃取剂:苯、乙醚、汽油、四氯化碳……
⑴. 打开玻璃塞或使塞上的凹槽或小孔对准漏斗口上的小孔。
⑵. 下层液体从下口放出,上层液体从上口倒出。
a.使用前先检查分液漏斗是否漏液b.振荡时双手托住分液漏斗,右手按住玻璃塞,平放,用力振荡(震荡后注意放气)c.震荡后,使玻璃塞凹槽和小孔对齐,静置分层d.分液时,记住下层的为密度大的液体,从下面放出.上层的为密度相对小的液体,从上面倒出.
互不相溶的两种液体分开
分液时,记住下层的为密度大的液体,从下面放出.上层的为密度相对小的液体,从上面倒出.
萃取与分液有什么区别?
提示:(1)分液和萃取是两个不同的操作方法,分液可以单独进行,但萃取之后一般要进行分液。(2)分液是将两种互不相溶的液体混合物进行分离的操作。
资料卡:1、苯甲酸为无色晶体。2、熔点122℃,沸点249℃。3、微溶于水(溶解度见下表),易溶于乙醇、乙醚等有机溶剂。
某粗苯甲酸样品含有少量氯化钠和泥沙,应如何提纯?
母液(可溶性杂质和部分被提纯物)
溶于溶剂,制成饱和溶液,趁热过滤
冷却,结晶,过滤,洗涤
被提纯的有机物在此溶剂中的溶解度,受温度的影响较大
杂质在此溶剂中溶解度很小或很大
铁架台(带铁圈)、酒精灯、石棉网、普通漏斗、烧杯、玻璃棒、
1、溶解粗苯甲酸时加热的作用是什么?
增大苯甲酸在水中的溶解度
2、趁热过滤的目的是什么?
温度高,苯甲酸不易析出
3、实验操作中多次使用了玻璃棒,分别起到哪些作用?
溶解时加速溶解、过滤和洗涤时引流
4、如何检验提纯后的苯甲酸中氯化钠已被除净?
取最后一次洗涤液少许与试管中,加入硝酸银溶液后,无明显现象,说明氯化钠已经除净。
5、在重结晶过程中进行热过滤后,要用少量热溶剂冲洗几遍,其目的是什么?
洗涤不溶性固体表面的可溶性有机物。
6、在晶体析出后,分离晶体和滤液时,要用少量的冷溶剂洗涤晶体,其洗涤的目的是什么?为什么要用冷溶剂?
7、温度越低,苯甲酸的溶解度越小,为了得到更多的苯甲酸晶体,是不是结晶时的温度越低越好?
洗涤除去晶体表面附着的可溶性杂质;用冷溶剂洗涤可降低洗涤过程中晶体的损耗。
温度过低,杂质的溶解度也会降低,部分杂质不会析出,达不到提纯苯甲酸的目的;温度极低时,溶剂(水)也会结晶,给实验操作带来麻烦。
两种方法的操作过程有什么区别?
溶解度随温度变化小的(蒸发溶剂)
2.根据右图信息,下列实验的步骤是什么? (1)提纯KNO3、NaCl (少量)混合物中KNO3
(2)提纯NaCl、KNO3 (少量)混合物中NaCl
溶解,蒸发结晶,趁热过滤,这样首先析出的是NaCl,少量的KNO3仍残留在热的溶液中。
溶解,蒸发浓缩,冷却结晶,过滤得到KNO3晶体,杂质NaCl留在滤液中。
下列说法中错误的是( )A.用酒精萃取甲苯水溶液中甲苯的操作可选用分液漏斗,然后静置分液B.进行分液时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出C.对于密度不同、互不相溶的液体混合物,可采用分液的方法将它们分离D.对于热稳定性较强、沸点较高的液态有机物和沸点较低的杂质可用蒸馏法除杂答案 A
高中第一单元 有机化学的发展与应用课文内容课件ppt: 这是一份高中第一单元 有机化学的发展与应用课文内容课件ppt,共26页。PPT课件主要包含了内容索引,自主预习新知导学,合作探究释疑解惑,课堂小结,课标定位素养阐释,问题引领,归纳提升,性质比较,典型例题等内容,欢迎下载使用。
苏教版 (2019)选择性必修3第一单元 有机化学的发展与应用教课内容ppt课件: 这是一份苏教版 (2019)选择性必修3第一单元 有机化学的发展与应用教课内容ppt课件,共15页。PPT课件主要包含了有机化学的发展,天然气,药物和香料,贝采利乌斯,生命力论,无机物和有机物,结晶牛胰岛素,基因工程,有机化合物,功能材料等内容,欢迎下载使用。
高中苏教版 (2019)专题1 有机化学的发展及研究思路第一单元 有机化学的发展与应用作业ppt课件: 这是一份高中苏教版 (2019)专题1 有机化学的发展及研究思路第一单元 有机化学的发展与应用作业ppt课件,共12页。PPT课件主要包含了A级必备知识基础练,B级关键能力提升练,加成反应,C级学科素养创新练,氧化反应等内容,欢迎下载使用。














