


还剩21页未读,
继续阅读
成套系列资料,整套一键下载
人教版 (新课标)选修4 化学反应原理 第四章 电化学基础 章末归纳与整理
展开
这是一份人教版 (新课标)选修4 化学反应原理 第四章 电化学基础 章末归纳与整理,共29页。
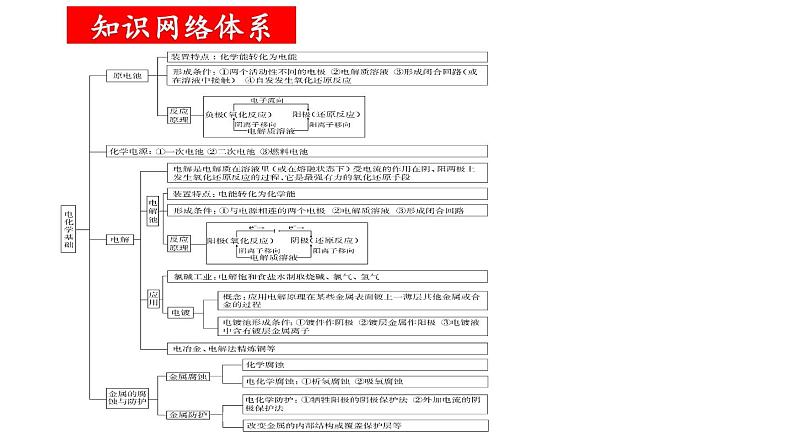
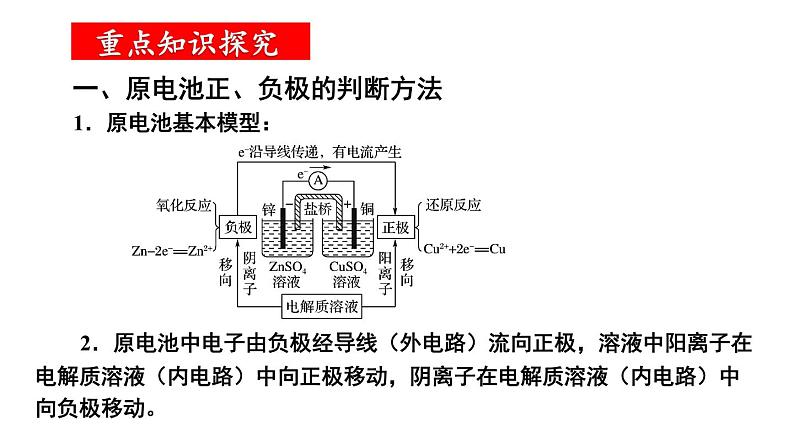
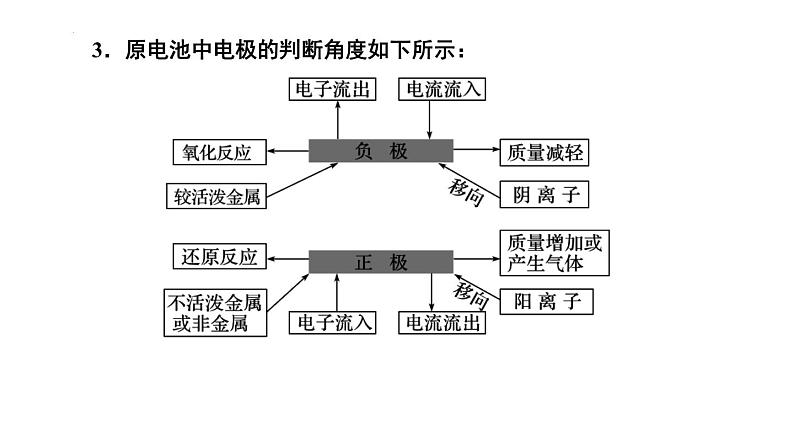
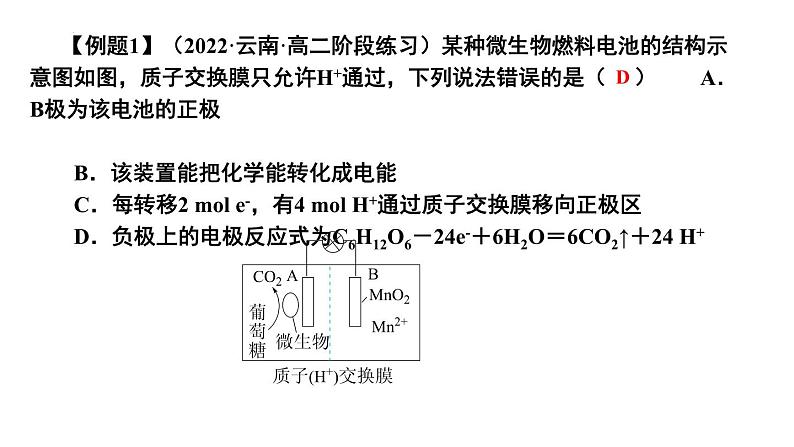
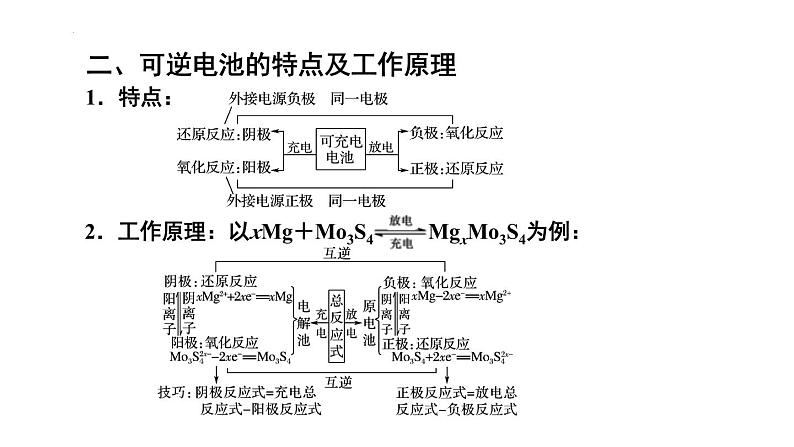
组织建设第四章 电化学基础章末归纳与整理知识网络体系重点知识探究一、原电池正、负极的判断方法 2.原电池中电子由负极经导线(外电路)流向正极,溶液中阳离子在电解质溶液(内电路)中向正极移动,阴离子在电解质溶液(内电路)中向负极移动。 1.原电池基本模型: 3.原电池中电极的判断角度如下所示: 【例题1】(2022·云南·高二阶段练习)某种微生物燃料电池的结构示意图如图,质子交换膜只允许H+通过,下列说法错误的是( ) A.B极为该电池的正极 B.该装置能把化学能转化成电能 C.每转移2 mol e-,有4 mol H+通过质子交换膜移向正极区 D.负极上的电极反应式为C6H12O6-24e-+6H2O=6CO2↑+24 H+D 【对应训练】如图是某同学设计的原电池装置,下列叙述中正确的是( )A.电极Ⅰ上发生还原反应,作原电池的负极 B.电极Ⅱ的电极反应为Cu2++2e-=Cu C.盐桥中装有含氯化钾饱和溶液的琼胶,其作用是传递电子 D.该原电池中电子的运动方向:电极Ⅱ→导线→电极ⅠD二、可逆电池的特点及工作原理 1.特点: 【例题2】(2022·山东省实验中学高二阶段练习)某高能LiFePO4电池工作原理为: (1-x)LiFePO4+xFePO4+LixCn LiFePO4+nC。下列说法不正确的是( ) A.该电池是二次电池 B.充电时,阳极附近锂元素被氧化 C.放电时Li+主要从负极区通过隔膜移向正极区 D.放电时,正极电极反应式: xFePO4+xLi++xe-=xLiFePO4B 【对应训练】镍镉(NiCd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充放电按下式进行:Cd+2NiOOH+2H2O Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是( ) A.充电时阳极反应:Ni(OH)2-e-+OH-=NiOOH+H2O B.充电过程是化学能转化为电能的过程 C.放电时负极附近溶液的碱性不变 D.放电时电解质溶液中的OH-向正极移动A三、原电池电极反应式的书写规律和方法 1.先分析题目给定的图示装置,确定原电池正、负极上的反应物,并标出相同数目电子的得失。 2.负极反应式的书写:①负极(Pb)本身失去电子生成阳离子(Pb2+);②生成的阳离子(Pb2+)与电解质溶液成分(SO42-)反应①负极本身不反应,燃料失去电子被氧化;②燃料反应产物与电解质溶液成分有些能反应将①和②进行叠加:Pb-2e-+SO42-=PbSO4将①和②进行叠加:CH4-8e-+10OH-=CO32-+7H2O①负极(Zn)本身失去电子生成阳离子(Zn2+);②生成的阳离子不与电解质溶液成分反应直接写出负极反应式:Zn-2e-=Zn2+ 3.正极反应式的书写 (1)首先判断在正极发生反应的物质:当负极材料与电解质溶液能自发的发生化学反应时,在正极上发生电极反应的物质是电解质溶液中的某种微粒;当负极材料与电解质溶液不能自发的发生化学反应时,在正极上发生反应的物质是溶解在电解质溶液中的O2。 (2)然后再根据具体情况写出正极反应式,在书写时也要考虑正极反应产物是否与电解质溶液反应的问题,若参与反应也要书写叠加式。 (3)燃料电池的正极反应式 电解质是碱性或中性溶液:O2+2H2O+4e-=4OH-, 电解质是酸性溶液:O2+4H++4e-=2H2O。(4)正、负电极反应式相加得到电池反应的总反应方程式。C 【例题3】(2021·新疆昌吉·高二期中)下列电极反应式与出现的环境相匹配的是( ) 【对应训练】如图是某校化学兴趣小组设计的一套原电池装置,下列有关描述正确的是( ) A.此装置能将电能转变为化学能 B.石墨电极的反应式:O2+2H2O+4e-=4OH- C.电子由石墨电极经导线流向Cu电极 D.电池的总反应式:2Cu+O2+4HCl=2CuCl2+2H2OD四、电解原理及多室电解的特点 1.电解是指直流电通过电解质溶液(或熔融的电解质)在阴、阳两极引起还原反应、氧化反应的过程。电解池是将电能转化为化学能的装置。2.电解池模型:3.多室电解特点—以三室电渗析法处理Na2SO4废水为例: 4.四步分析法—以书写用石墨作电极电解CuSO4溶液的电极反应式及总反应式为例: 第一步:明确溶液中存在哪些离子。阳离子有Cu2+、H+;阴离子有OH-、SO42-。 第二步:判断阴、阳两极负极离子得失电子顺序。 阴极:Cu2+>H+;阳极:OH->SO42-。 第三步:分别写出两极的电极反应式。 阴极:2Cu2++4e-=2Cu; 阳极:2H2O-4e-=O2↑+4H+ 第四步:根据得失电子数相等,将两极反应式相加得总反应式:2CuSO4+2H2O=2Cu+O2↑+2H2SO4 【例题4】(2021·湖南·长沙市明德中学高二期中)利用图中装置可以制备一元弱酸H3BO3,下列说法不正确的是( ) A.M室产生的气体为氧气 B.阴极的电极反应式为:2H2O-e-=2OH-+H2↑ C.原料室的[B(OH)4]-穿过阴离子交换膜进入产品室 D.当电路中通过1mol电子时,可得到1molH3BO3B 【对应训练】如图为利用电化学方法处理有机废水的原理示意图。下列说法正确的是( ) A.a、b极不能使用同种电极材料 B.工作时,a极的电势低于b极的电势 C.工作一段时间之后,a极区溶液的pH增大 D.b极的电极反应式为:CH3COO-+4H2O-8e-=2HCO3-+9H+D 电解池中电极反应式的书写关键是掌握离子的放电顺序。 1.阴极与电源负极相连,得电子发生还原反应。其规律有两个:一是电极本身不参加反应;二是电解质溶液中氧化性强的阳离子先得电子,如Ag+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+,要注意金属活动性顺序表中Al及Al前面的金属离子在溶液中不放电。 2.阳极与电源正极相连,失去电子发生氧化反应。其规律有两个:一是若阳极为非惰性电极(除Pt、Au之外的金属作电极),电极本身失去电子被氧化,电解质溶液中的阴离子不参与电极反应;二是若阳极为惰性电极(Pt、Au或非金属作电极),电解质溶液中还原性强的阴离子失去电子被氧化,如S2->I->Br->Cl->OH->含氧酸根。五、电解池中电极反应式的书写基本规律 3.特别注意:书写电解池中电极反应式时,要以实际放电的离子表示,但书写总电解反应方程式时,弱电解质要写成分子式。如用惰性电极电解NaOH溶液,阳极发生氧化反应,电极反应式为4OH--4e-=2H2O+O2↑,阴极发生还原反应,电极反应式为2H++2e-=H2↑,总反应式表示为2H2O 2H2↑+O2↑。 【例题5】(2022·全国·高二单元测试)金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:还原性Fe>Ni>Cu)( ) A.阳极发生还原反应,其电极反应式:Ni2++2e-=Ni B.电解过程中,阳极质量的减少与阴极质量的增加相等 C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+ D.电解后,电解槽底部的阳极泥中只有Cu和PtD 【对应训练】LiOH是生产航空航天润滑剂的原料。清华大学首创三室膜电解法制备氢氧化锂,其模拟装置如图所示。下列有关说法正确的是( ) A.膜1为阳离子交换膜,膜2为阴离子交换膜 B.a极为电源的负极,Y极上发生氧化反应 C.X极的电极反应式为2H2O-4e-=4H++O2↑ D.每转移2 mol电子,理论上生成52 g LiOHC六、电解产物的判断及有关计算 1.简单装置中各电极产物间的计算:在一个装置中进行电解时,各电极产物不同,但阴阳极得失电子数相等。根据此标准可对各电极产物、溶液中的产物,以及反应消耗的物质进行计算。 2.复杂装置中(指多个装置串联连接)各电极产物的判断:在串联电解装置中,各电极电子转移数相等。据此,可计算各电极产物,溶液中的c(H+)、c(OH-)的变化。 3.电解的计算特点:有关电解的计算通常是求电解后某产物的质量、气体的体积、某元素的化合价以及溶液的pH、物质的量浓度等。解答此类题的方法有两种:一是根据电解方程式或电极反应式,应用阴、阳两极得失电子守恒进行有关计算。二是用惰性电极进行电解的过程,若电解质的阴、阳离子不同时在两极上放电,则阳离子放电的同时必有H+生成,n(H+)=n(阳离子)×电荷数。也可利用物质的量关系(电子得失守恒)进行计算,如,H2~Cl2~1/2O2~Cu~2Ag~2H+~2OH-。 【例题6】(2021·浙江·效实中学高二期中)利用膜技术和电化学原理制备少量硫酸和绿色硝化剂N2O5,装置如图,下列说法正确的是( )B A.甲装置将电能转化为化学能B.每转移2mol电子,生成2mol N2O5 和1mol H2SO4C.乙中电极d上发生氧化反应D.c电极反应式为: N2O4 – 2e- +H2O=N2O5+2H+ 【对应训练】如图所示的A、B两个电解池中的电极均为铂,在A池中加入0.05 mol·L-1的CuCl2溶液,B池中加入0.1 mol·L-1的AgNO3溶液,进行电解。a、b、c、d四个电极上所析出的物质的物质的量之比是( ) A.2∶2∶4∶1 B.1∶1∶2∶1 C.2∶1∶1∶1 D.2∶1∶2∶1A七、电解原理在工业上有哪些基本的应用?各有何特点? 1.氯碱工业:电解饱和食盐水制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品。如图1 2.电镀:镀待镀金属制品作阴极,镀层金属作阳极,用含有镀层金属离子的溶液作电镀液。如图所示(铁片上镀银)。如图2所示(铁片上镀银):图1图2 4.电冶金:利用电解熔融盐的方法来冶炼活泼金属Na、Ca、Mg、Al等。如: 冶炼钠:2NaCl(熔融) 2Na+Cl2↑ , 阳极:2Cl--2e-=Cl2↑; 阴极:2Na++2e-=2Na。 冶炼铝:2Al2O3(熔融) 4Al+3O2↑ 阳极:6O2--12e-=3O2↑; 阴极:4Al3++12e-=4Al。 3.电解精炼铜如图所示:用纯铜板作阴极,粗铜板(含Zn、Fe、Ni、Ag、Au等杂质)作阳极,CuSO4溶液或CuCl2溶液作电解液。如图3 【例题7】(2022·河北·石家庄市第四十二中学高二阶段练习)根据工业上离子交换膜法制烧碱的方法,可以用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。下列说法错误的是( ) A.该电解槽的阳极反应式为2H2O-4e-=4H++O2↑ B.制得的氢氧化钾溶液从出口D导出 C.通电开始后,阴极附近溶液pH增大 D.若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为O2+2H2O-4e-=4OH-D 【对应训练】结合图示判断,下列叙述正确的是( ) A.K与N连接时,X为硫酸,一段时间后溶液的pH增大 B.K与N连接时,X为氯化钠,石墨极电极反应式为2H++2e-=H2↑ C.K与M连接时,X为硫酸,一段时间后溶液的pH增大 D.K与M连接时,X为氯化钠,石墨极电极反应式为4OH--4e-=2H2O+O2↑A
组织建设第四章 电化学基础章末归纳与整理知识网络体系重点知识探究一、原电池正、负极的判断方法 2.原电池中电子由负极经导线(外电路)流向正极,溶液中阳离子在电解质溶液(内电路)中向正极移动,阴离子在电解质溶液(内电路)中向负极移动。 1.原电池基本模型: 3.原电池中电极的判断角度如下所示: 【例题1】(2022·云南·高二阶段练习)某种微生物燃料电池的结构示意图如图,质子交换膜只允许H+通过,下列说法错误的是( ) A.B极为该电池的正极 B.该装置能把化学能转化成电能 C.每转移2 mol e-,有4 mol H+通过质子交换膜移向正极区 D.负极上的电极反应式为C6H12O6-24e-+6H2O=6CO2↑+24 H+D 【对应训练】如图是某同学设计的原电池装置,下列叙述中正确的是( )A.电极Ⅰ上发生还原反应,作原电池的负极 B.电极Ⅱ的电极反应为Cu2++2e-=Cu C.盐桥中装有含氯化钾饱和溶液的琼胶,其作用是传递电子 D.该原电池中电子的运动方向:电极Ⅱ→导线→电极ⅠD二、可逆电池的特点及工作原理 1.特点: 【例题2】(2022·山东省实验中学高二阶段练习)某高能LiFePO4电池工作原理为: (1-x)LiFePO4+xFePO4+LixCn LiFePO4+nC。下列说法不正确的是( ) A.该电池是二次电池 B.充电时,阳极附近锂元素被氧化 C.放电时Li+主要从负极区通过隔膜移向正极区 D.放电时,正极电极反应式: xFePO4+xLi++xe-=xLiFePO4B 【对应训练】镍镉(NiCd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充放电按下式进行:Cd+2NiOOH+2H2O Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是( ) A.充电时阳极反应:Ni(OH)2-e-+OH-=NiOOH+H2O B.充电过程是化学能转化为电能的过程 C.放电时负极附近溶液的碱性不变 D.放电时电解质溶液中的OH-向正极移动A三、原电池电极反应式的书写规律和方法 1.先分析题目给定的图示装置,确定原电池正、负极上的反应物,并标出相同数目电子的得失。 2.负极反应式的书写:①负极(Pb)本身失去电子生成阳离子(Pb2+);②生成的阳离子(Pb2+)与电解质溶液成分(SO42-)反应①负极本身不反应,燃料失去电子被氧化;②燃料反应产物与电解质溶液成分有些能反应将①和②进行叠加:Pb-2e-+SO42-=PbSO4将①和②进行叠加:CH4-8e-+10OH-=CO32-+7H2O①负极(Zn)本身失去电子生成阳离子(Zn2+);②生成的阳离子不与电解质溶液成分反应直接写出负极反应式:Zn-2e-=Zn2+ 3.正极反应式的书写 (1)首先判断在正极发生反应的物质:当负极材料与电解质溶液能自发的发生化学反应时,在正极上发生电极反应的物质是电解质溶液中的某种微粒;当负极材料与电解质溶液不能自发的发生化学反应时,在正极上发生反应的物质是溶解在电解质溶液中的O2。 (2)然后再根据具体情况写出正极反应式,在书写时也要考虑正极反应产物是否与电解质溶液反应的问题,若参与反应也要书写叠加式。 (3)燃料电池的正极反应式 电解质是碱性或中性溶液:O2+2H2O+4e-=4OH-, 电解质是酸性溶液:O2+4H++4e-=2H2O。(4)正、负电极反应式相加得到电池反应的总反应方程式。C 【例题3】(2021·新疆昌吉·高二期中)下列电极反应式与出现的环境相匹配的是( ) 【对应训练】如图是某校化学兴趣小组设计的一套原电池装置,下列有关描述正确的是( ) A.此装置能将电能转变为化学能 B.石墨电极的反应式:O2+2H2O+4e-=4OH- C.电子由石墨电极经导线流向Cu电极 D.电池的总反应式:2Cu+O2+4HCl=2CuCl2+2H2OD四、电解原理及多室电解的特点 1.电解是指直流电通过电解质溶液(或熔融的电解质)在阴、阳两极引起还原反应、氧化反应的过程。电解池是将电能转化为化学能的装置。2.电解池模型:3.多室电解特点—以三室电渗析法处理Na2SO4废水为例: 4.四步分析法—以书写用石墨作电极电解CuSO4溶液的电极反应式及总反应式为例: 第一步:明确溶液中存在哪些离子。阳离子有Cu2+、H+;阴离子有OH-、SO42-。 第二步:判断阴、阳两极负极离子得失电子顺序。 阴极:Cu2+>H+;阳极:OH->SO42-。 第三步:分别写出两极的电极反应式。 阴极:2Cu2++4e-=2Cu; 阳极:2H2O-4e-=O2↑+4H+ 第四步:根据得失电子数相等,将两极反应式相加得总反应式:2CuSO4+2H2O=2Cu+O2↑+2H2SO4 【例题4】(2021·湖南·长沙市明德中学高二期中)利用图中装置可以制备一元弱酸H3BO3,下列说法不正确的是( ) A.M室产生的气体为氧气 B.阴极的电极反应式为:2H2O-e-=2OH-+H2↑ C.原料室的[B(OH)4]-穿过阴离子交换膜进入产品室 D.当电路中通过1mol电子时,可得到1molH3BO3B 【对应训练】如图为利用电化学方法处理有机废水的原理示意图。下列说法正确的是( ) A.a、b极不能使用同种电极材料 B.工作时,a极的电势低于b极的电势 C.工作一段时间之后,a极区溶液的pH增大 D.b极的电极反应式为:CH3COO-+4H2O-8e-=2HCO3-+9H+D 电解池中电极反应式的书写关键是掌握离子的放电顺序。 1.阴极与电源负极相连,得电子发生还原反应。其规律有两个:一是电极本身不参加反应;二是电解质溶液中氧化性强的阳离子先得电子,如Ag+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+,要注意金属活动性顺序表中Al及Al前面的金属离子在溶液中不放电。 2.阳极与电源正极相连,失去电子发生氧化反应。其规律有两个:一是若阳极为非惰性电极(除Pt、Au之外的金属作电极),电极本身失去电子被氧化,电解质溶液中的阴离子不参与电极反应;二是若阳极为惰性电极(Pt、Au或非金属作电极),电解质溶液中还原性强的阴离子失去电子被氧化,如S2->I->Br->Cl->OH->含氧酸根。五、电解池中电极反应式的书写基本规律 3.特别注意:书写电解池中电极反应式时,要以实际放电的离子表示,但书写总电解反应方程式时,弱电解质要写成分子式。如用惰性电极电解NaOH溶液,阳极发生氧化反应,电极反应式为4OH--4e-=2H2O+O2↑,阴极发生还原反应,电极反应式为2H++2e-=H2↑,总反应式表示为2H2O 2H2↑+O2↑。 【例题5】(2022·全国·高二单元测试)金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:还原性Fe>Ni>Cu)( ) A.阳极发生还原反应,其电极反应式:Ni2++2e-=Ni B.电解过程中,阳极质量的减少与阴极质量的增加相等 C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+ D.电解后,电解槽底部的阳极泥中只有Cu和PtD 【对应训练】LiOH是生产航空航天润滑剂的原料。清华大学首创三室膜电解法制备氢氧化锂,其模拟装置如图所示。下列有关说法正确的是( ) A.膜1为阳离子交换膜,膜2为阴离子交换膜 B.a极为电源的负极,Y极上发生氧化反应 C.X极的电极反应式为2H2O-4e-=4H++O2↑ D.每转移2 mol电子,理论上生成52 g LiOHC六、电解产物的判断及有关计算 1.简单装置中各电极产物间的计算:在一个装置中进行电解时,各电极产物不同,但阴阳极得失电子数相等。根据此标准可对各电极产物、溶液中的产物,以及反应消耗的物质进行计算。 2.复杂装置中(指多个装置串联连接)各电极产物的判断:在串联电解装置中,各电极电子转移数相等。据此,可计算各电极产物,溶液中的c(H+)、c(OH-)的变化。 3.电解的计算特点:有关电解的计算通常是求电解后某产物的质量、气体的体积、某元素的化合价以及溶液的pH、物质的量浓度等。解答此类题的方法有两种:一是根据电解方程式或电极反应式,应用阴、阳两极得失电子守恒进行有关计算。二是用惰性电极进行电解的过程,若电解质的阴、阳离子不同时在两极上放电,则阳离子放电的同时必有H+生成,n(H+)=n(阳离子)×电荷数。也可利用物质的量关系(电子得失守恒)进行计算,如,H2~Cl2~1/2O2~Cu~2Ag~2H+~2OH-。 【例题6】(2021·浙江·效实中学高二期中)利用膜技术和电化学原理制备少量硫酸和绿色硝化剂N2O5,装置如图,下列说法正确的是( )B A.甲装置将电能转化为化学能B.每转移2mol电子,生成2mol N2O5 和1mol H2SO4C.乙中电极d上发生氧化反应D.c电极反应式为: N2O4 – 2e- +H2O=N2O5+2H+ 【对应训练】如图所示的A、B两个电解池中的电极均为铂,在A池中加入0.05 mol·L-1的CuCl2溶液,B池中加入0.1 mol·L-1的AgNO3溶液,进行电解。a、b、c、d四个电极上所析出的物质的物质的量之比是( ) A.2∶2∶4∶1 B.1∶1∶2∶1 C.2∶1∶1∶1 D.2∶1∶2∶1A七、电解原理在工业上有哪些基本的应用?各有何特点? 1.氯碱工业:电解饱和食盐水制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品。如图1 2.电镀:镀待镀金属制品作阴极,镀层金属作阳极,用含有镀层金属离子的溶液作电镀液。如图所示(铁片上镀银)。如图2所示(铁片上镀银):图1图2 4.电冶金:利用电解熔融盐的方法来冶炼活泼金属Na、Ca、Mg、Al等。如: 冶炼钠:2NaCl(熔融) 2Na+Cl2↑ , 阳极:2Cl--2e-=Cl2↑; 阴极:2Na++2e-=2Na。 冶炼铝:2Al2O3(熔融) 4Al+3O2↑ 阳极:6O2--12e-=3O2↑; 阴极:4Al3++12e-=4Al。 3.电解精炼铜如图所示:用纯铜板作阴极,粗铜板(含Zn、Fe、Ni、Ag、Au等杂质)作阳极,CuSO4溶液或CuCl2溶液作电解液。如图3 【例题7】(2022·河北·石家庄市第四十二中学高二阶段练习)根据工业上离子交换膜法制烧碱的方法,可以用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。下列说法错误的是( ) A.该电解槽的阳极反应式为2H2O-4e-=4H++O2↑ B.制得的氢氧化钾溶液从出口D导出 C.通电开始后,阴极附近溶液pH增大 D.若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为O2+2H2O-4e-=4OH-D 【对应训练】结合图示判断,下列叙述正确的是( ) A.K与N连接时,X为硫酸,一段时间后溶液的pH增大 B.K与N连接时,X为氯化钠,石墨极电极反应式为2H++2e-=H2↑ C.K与M连接时,X为硫酸,一段时间后溶液的pH增大 D.K与M连接时,X为氯化钠,石墨极电极反应式为4OH--4e-=2H2O+O2↑A
相关资料
更多









