




2022苏教版高中化学选修四《化学反应原理》《电解池的工作原理及应用》【创新课件】1
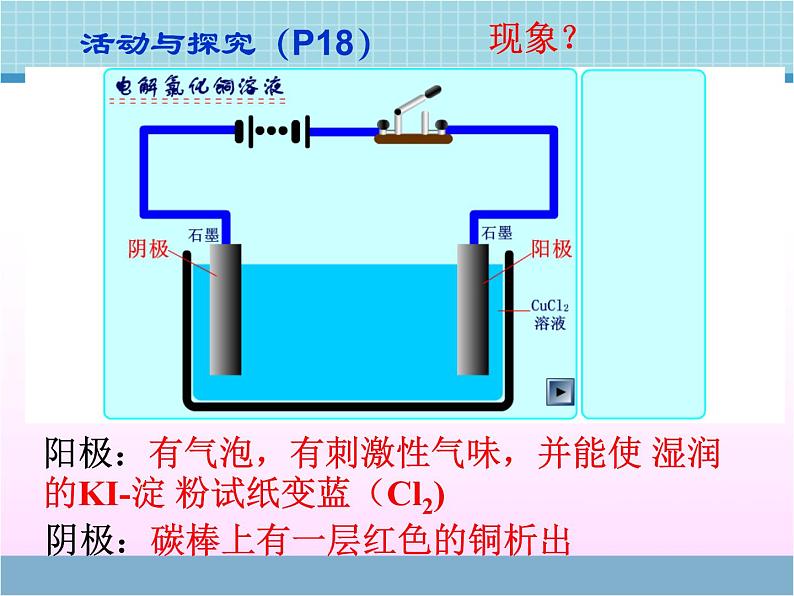
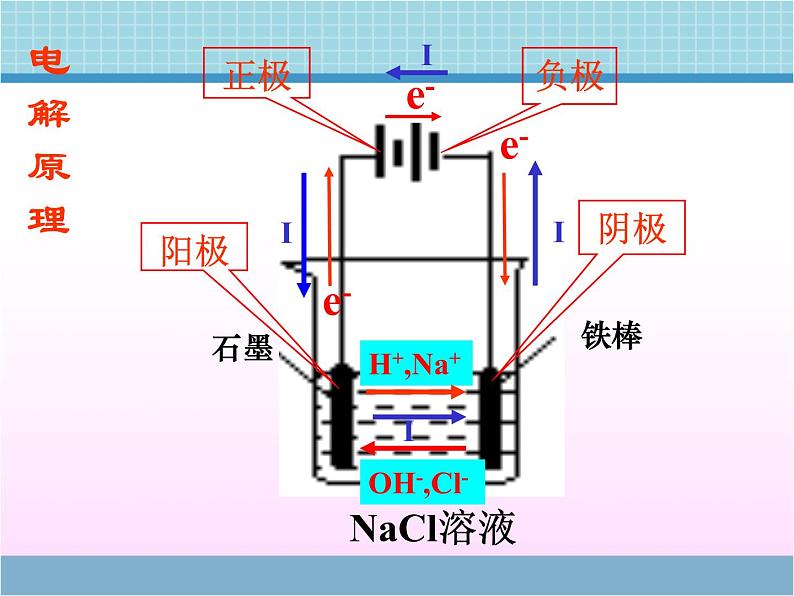
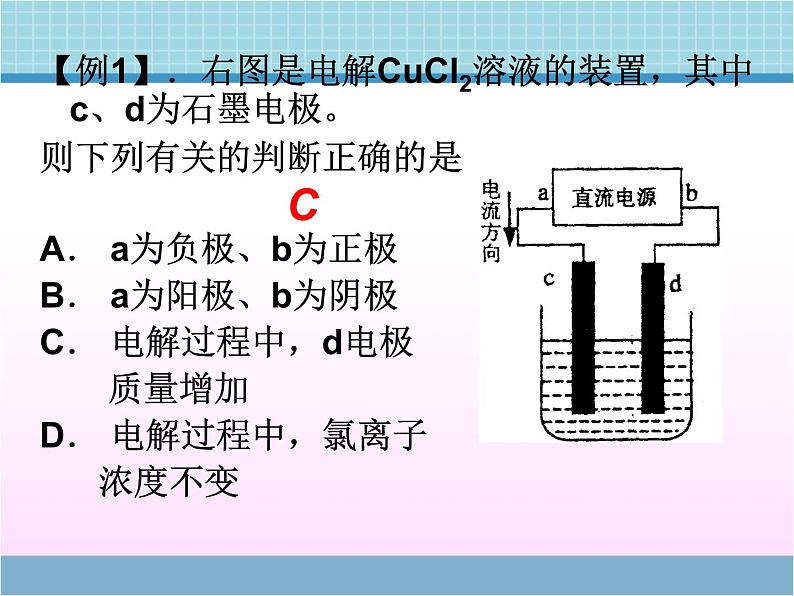
展开电解池的工作原理与应用第二单元 化学能与电能的转化活动与探究(P18)阳极:有气泡,有刺激性气味,并能使 湿润的KI-淀 粉试纸变蓝(Cl2) 阴极:碳棒上有一层红色的铜析出现象?通电前:分析熔融电解质中的离子情况 通电后: Na+ 、Cl-做无规则运动交流与讨论P17:Na+ 、Cl-做定向移动,电解过程不仅可以在电解质溶液中进行,也可以在熔融的电解质中进行。 使电流通过电解质溶液而在阴阳两极引起氧化还原反应的过程。电解池: 把电能转化为化学能的装置.一、电解的定义:电解和电离有无区别?二、电解原理:正极负极H+,Na+OH-,Cl-NaCl溶液石墨铁棒阳极阴极电解原理(1)外加直流电源(2)与电源相连的两个导电的电极: 接电源正极的为阳极,发生氧化反应 接电源负极的为阴极,发生还原反应(3)电解质溶液或熔化的电解质(4)形成闭合回路三、电解池的构成条件:一般是非自发的氧化还原反应电子 的一极阳极:与电源 极相连的电极电极质量 的一极发生 反应的极电流 一极 移入的一极流出流入氧化阴离子减少四、电解池阴阳极的判断方法该电极为活性电极正【例1】.右图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是A. a为负极、b为正极B. a为阳极、b为阴极C. 电解过程中,d电极 质量增加D. 电解过程中,氯离子 浓度不变 C【例2】:分析以惰性电极电解下列溶液的电极反应。(1)硝酸银溶液(2)氯化钠溶液(3)稀硫酸(4)氢氧化钠溶液(5)硫酸钠溶液(1)溶液的PH如何变化?(2)上述溶液电解结束后,要使溶液和电解前相同需要加入何种物质?离子放电顺序:活性电极(除Au、Pt、石墨外)>S2- > I- > Br - > Cl- > OH- > 含氧酸根 > F- Ag+>Fe3+> Hg2+> Cu2+>H+ >Pb2+>Sn2+> Fe2+>Zn2+>Al3+>Mg2+>Na+ >Ca2+>K+ 阳极:阴极:注意:阳极材料“遵循谁强谁放电”【例3】:若以铜为阳极,铁为阴极,电解氯化铜溶液,情况又如何? 【例4】如何使图中的铁棒上析出铜,而铁的质量不变?【例5】.(2007年江苏)某同学按右图所示的装置进行电解实验。下列说法正确的是A.电解过程中,铜 电极上有H2产生B.电解初期,主反 应方程式为:Cu+H2SO4=CuSO4+H2↑C.电解一定时间后,石墨电极上有铜析出D.整个电解过程中,H+的浓度不断增大BC【例6】、用石墨作电极电解 100mLH2SO4和 CuSO4的混合溶液,通电一段时间后,两极均收集到2.24L气体(标准状况下),原混合溶液中Cu2+的物质的量浓度为 ( ) A.1mol/L B.2mol/L C.3 mol/L D.4 mol/LA电解饱和食盐水五、电解原理的应用阳离子交换膜的作用 只允许阳离子通过,阻止阴离子和气体通过1、以石墨为电极电解饱和食盐水(P19)(1)请写出电极反应式和电解反应⑵在工业生产中,用阳离子交换膜将阴极区与阳极区隔开,使阴极区的OH-不能进入阳极区,为什么要这么做?Cl –在阳极失电子生成Cl2, OH-进入阳极区会与Cl2反应,既减少Cl2的产量,又会生成NaClO,使产品不纯且干扰电解。2、 电镀定义利用电解原理在某些金属的表面镀上一薄层其它金属或合金的过程。装置(以铜上镀银为例)结果:“一多一少一不变”阴极——待镀金属或镀件 阳极——镀层金属电镀液——含有镀层金属离子的溶液 阳极:2Ag—2e- = 2Ag+阴极:2Ag++ 2e- =2Ag 【铜上镀锌?】3、铜的电解精炼:粗铜 含杂质(Zn Fe Ni Ag Au 等)阳极: Zn - 2e- = Zn2+Fe - 2e- =Fe2+Ni - 2e- = Ni2+Cu - 2e- = Cu2+ Zn Fe Ni CuAg Au 阴极: Cu2+ + 2e- = Cu阳极泥问:电解完后,CuSO4溶液的浓度有何变化?硫酸铜溶液结果:“一多一少一基本不变”基本不变阳极-粗铜,阴极-纯铜4、 活泼金属的制备特别活泼的金属钠、镁、铝等只能通过电解的方法制取阳极:6O2-—12e-== 3O2↑阴极:4Al3++ 12e—==4Al总方程式:思考:1.为什么不电解熔融的AlCl3 ?2.工业上制金属镁是电解氧化镁还是电解熔融的氯化镁?练习 银质奖章较长时间后变黑, 形成黑锈,可以采用抛光的方法恢复光泽,抛光的简单方法是:将变质的奖章放入盛有食盐的铝锅中,放置一段时间后,黑锈就被除去,而银不会损失。(1)形成黑锈的原因: (2)除锈的原理:4Ag+2H2S+O2=2Ag2S+2H2O【例7】 (2008年全国I)电解100mL含 c(H+)=0.30mol/L的下列溶液,当电路中通过0.04mol电子时,理论上析出金属质量最大的是 A.0.10mol/L Ag+ B.0.02mol/L Zn2+ C.0.20mol/L Cu2+ D.0.20mol/L Pb2+原电池与电解池 化学能转化为电能 电能转化为化学能反应不自发反应自发连接电源的正极,作为阳极相对活泼的金属作为负极连接电源的负极,作为阴极相对不活泼的金属或石墨作为正极阴离子向阳极迁移,阳离子向阴极迁移阴离子向负极迁移,阳离子向正极迁移两个电极、电解质溶液形成闭合回路。电解池有外电源,原电池无需外电源。知识重组:氧化反应失去电子还原反应获得电子负极→正极负极→阴极,阳极→正极
苏教版 (2019)选择性必修1第二单元 化学能与电能的转化课文配套ppt课件: 这是一份苏教版 (2019)选择性必修1第二单元 化学能与电能的转化课文配套ppt课件,共60页。PPT课件主要包含了NO1,NO2,NO3,点击右图进入等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修1第二单元 化学能与电能的转化图片ppt课件: 这是一份高中化学苏教版 (2019)选择性必修1第二单元 化学能与电能的转化图片ppt课件,共14页。PPT课件主要包含了学习目标,交流讨论,Cl2,Cl-,Na+,NaCl,OH-,课堂探究,硫酸酸化的硫酸铜,Cu2+等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修1第二单元 化学能与电能的转化图片ppt课件: 这是一份高中化学苏教版 (2019)选择性必修1第二单元 化学能与电能的转化图片ppt课件,共10页。PPT课件主要包含了学习目标,交流讨论,电子的流向,课堂小结,实验现象,红色物质,实验结论,课堂探究,②③⑥,①③④等内容,欢迎下载使用。













