
高中化学鲁科版 (2019)必修 第一册第3章 物质的性质与转化第2节 硫的转化第二课时学案
展开1.掌握SO2的重要物理、化学性质及实验现象。
2.能从物质类别及化合价的角度预测常见含硫化合物的转化关系,设计实验实现不同价态含硫物质的相互转化。 【重难点】二氧化硫的化学性质
【自 学 自 测】
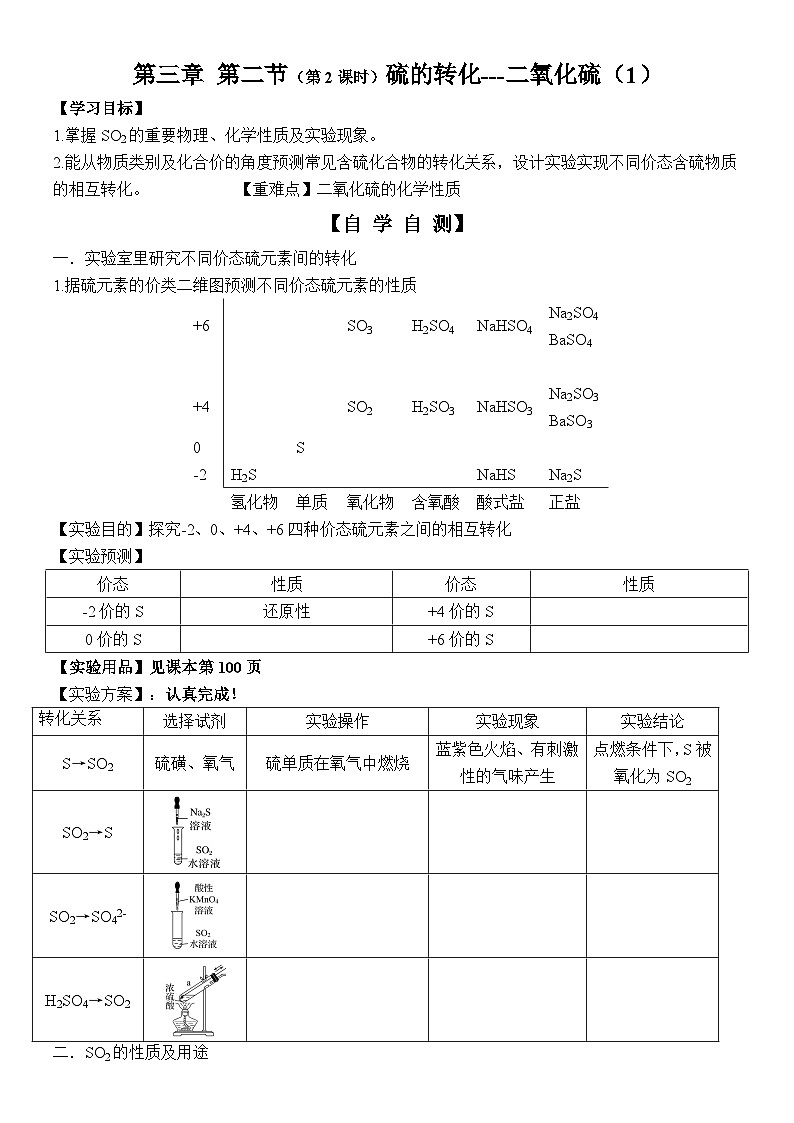
一.实验室里研究不同价态硫元素间的转化
1.据硫元素的价类二维图预测不同价态硫元素的性质
【实验目的】探究-2、0、+4、+6四种价态硫元素之间的相互转化
【实验预测】
【实验用品】见课本第100页
【实验方案】:认真完成!
二.SO2的性质及用途
1.物理性质
2.化学性质
从硫元素价态预测:SO2中硫元素呈现+4价,既有 性也有 性。
(1)酸性氧化物的通性(与CO2性质相似)
SO2+H2O⇌ SO2+NaOH=== (SO2少量)
SO2+NaOH=== (SO2过量)
(2)氧化性:SO2→S
例如:SO2与H2S反应的化学方程式:
(3)还原性:SO2→SO42-能被Cl2、Br2、I2、O2、Fe3+、KMnO4、HNO3等氧化剂氧化
例如:SO2与Cl2反应的化学方程式:
SO2与O2反应的化学方程式:
SO2与Fe3+反应的离子方程式:
SO2与酸性KMnO4反应的离子方程式:
【思考】①将SO2通入到紫色石蕊试液中, 褪色,而将Cl2通入到紫色石蕊试液中,先 ,后 。
②将等物质的量的SO2和Cl2的混合气体通入到品红试液中,发现品红并不褪色。解释其原理。
(4)漂白性:
现象:将SO2通入品红溶液后,品红溶液很快变为 溶液。再加热后,无色溶液又重新恢复为 色。原理: 。
【总结】总结学过的有漂白性的物质,并分析它们的漂白原理有何不同?
3.实验室制取
常用Na2SO3固体与较浓的硫酸反应制取SO2:Na2SO3+H2SO4(浓)===Na2SO4+H2O+SO2↑
4.用途 -----------制硫酸、食品添加剂(漂白剂、防腐剂、抗氧化剂)等。
【自测】正误判断:
(1)SO2既有氧化性,又有还原性( )
(2)SO2是一种无色、有刺激性气味、无毒的气体( )
(3)SO2能使酸性高锰酸钾溶液褪色体现了它的漂白性( )
(4)将SO2通入品红溶液中,溶液褪色,加热后无变化( )
(5)SO2和CO2性质相似,通入BaCl2溶液中,都会产生白色沉淀( )
【自 研 自 悟】
【探究点】SO2的性质
将SO2分别通入下列五种溶液中
回答下列问题:
(1)试管①中的实验现象:酸性KMnO4溶液__________,证明SO2具有________性。
(2)试管②中的实验现象:溶液________,证明SO2具有________性。
(3)试管③中的实验现象:溶液________,证明SO2能中和NaOH,具有酸性氧化物的性质,写出该反应的离子方程式:_____________________________________________________
(4)试管④中能产生________(填化学式,下同)沉淀。
(5)试管⑤中能产生________沉淀。
【归纳总结】常见漂白剂漂白原理及比较
【自 练 自 提】
1.核心元素的化合价及类别是研究物质性质的两个重要视角。硫及其化合物的分类与相应硫元素的化合价关系如图所示。下列说法错误的是( )
A.适量的c可作为葡萄酒的添加剂
B.常温下,a与c反应可生成b
C.将c通入紫色石蕊溶液中,溶液先变红后褪色
D.在自然界中,部分的c会转化成d,最后转化为f或h
2.硫黄在空气中燃烧生成气体甲;将甲溶于水得溶液乙;向溶液乙中滴加溴水时溴水褪色,乙变为丙;在丙中加入硫化钠又生成气体丁;把丁通入溶液乙中得沉淀戊。物质甲、乙、丙、丁、戊中均含有硫元素,它们依次是( )
A.SO3、H2SO4、H2SO3、H2S、S B.SO2、H2SO3、H2SO4、H2S、S
C.SO2、H2SO3、H2SO4、H2S、SO3 D.SO2、H2SO3、H2S、H2SO4、Na2S2O3
3.下列物质能使品红溶液褪色,且褪色原理基本相同的是( )
①活性炭 ②氯水 ③二氧化硫 ④臭氧 ⑤过氧化钠 ⑥过氧化氢
A.①②④⑥ B.①②③⑤ C.②④⑤⑥ D.③④⑤⑥
4.某微型实验装置(夹持仪器已省略)如图所示,其中a棉球蘸有品红溶液,b棉球蘸有含酚酞的NaOH溶液,c棉球蘸有I2与淀粉的混合溶液。实验时将70% H2SO4溶液滴入装有Na2SO3固体的培养皿中。下列说法错误的是( )
A.a棉球会变白,微热后变红
B.b棉球变为白色,离子反应为SO2+2OH-===SOeq \\al(2-,3)+H2O
C.c棉球变为白色,说明SO2具有漂白性
D.若将试剂改为浓盐酸和Ca(ClO)2固体,a、b处棉球也会变为白色
5~7题有一个或两个选项符合题目要求。
5.下列物质能与SO2气体反应,但无沉淀产生的是( )
①溴水 ②Ba(OH)2溶液 ③石灰水 ④Na2CO3溶液 ⑤稀硫酸 ⑥Na2SO4溶液 ⑦Na2SO3溶液
A.只有① B.①④⑤ C.④⑥⑦ D.①④⑦
6.在探究SO2水溶液成分和性质的实验中,下列根据实验现象得出的结论正确的是(已知:NOeq \\al(-,3)在酸性条件具有强氧化性)( )
A.向SO2水溶液中加入少量NaHCO3粉末,有气泡产生,说明SO2水溶液呈酸性
B.向SO2水溶液中滴加Ba(NO3)2溶液,有白色沉淀产生,说明SO2水溶液中含有SOeq \\al(2-,4)
C.向SO2水溶液中通入H2S气体,有淡黄色沉淀产生,说明SO2具有氧化性
D.向酸性KMnO4溶液中滴加SO2水溶液,溶液褪色,说明SO2具有漂白性
7.某同学为探究SO2气体还原Fe3+的反应,装置如图所示,下列说法不合理的是( )
A.能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色
B.装置C的作用是吸收SO2尾气,防止污染空气
C.为验证A中发生了氧化还原反应,加入酸性KMnO4溶液,紫色褪去
D.为验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀
8.硫在单质气体A中燃烧发出蓝紫色火焰,生成刺激性气味的气体B;通常情况下C为无色液体,B、C、D是氧化物;E、F和X都是酸,G是白色沉淀。
(1)E的化学式为____________________。
(2)反应①的化学方程式为___________________________________________________。
(3)反应④的化学方程式为___________________________________________________。
(4)反应⑥的化学方程式为____________________________________________________。
自练自提答案:
C 2.B 3. C 4.C 5.D 6.AC 7.C
点燃
(1) H2SO3 (2)S+O2=SO2 (3)SO3+H2O=H2SO4 (4)H2SO4+BaCl2=BaSO4+2HCl
+6
SO3
H2SO4
NaHSO4
Na2SO4
BaSO4
+4
SO2
H2SO3
NaHSO3
Na2SO3
BaSO3
0
S
-2
H2S
NaHS
Na2S
氢化物
单质
氧化物
含氧酸
酸式盐
正盐
价态
性质
价态
性质
-2价的S
还原性
+4价的S
0价的S
+6价的S
转化关系
选择试剂
实验操作
实验现象
实验结论
S→SO2
硫磺、氧气
硫单质在氧气中燃烧
蓝紫色火焰、有刺激性的气味产生
点燃条件下,S被氧化为SO2
SO2→S
SO2→SO42-
H2SO4→SO2
颜色
状态
气味
密度
溶解性
毒性
比空气
溶于水
类型
原理
特点
举例
氧化型
漂白剂本身是强氧化剂,可将有色物质氧化,使有色物质失去原有的颜色
不可逆
HClO、Ca(ClO)2、新制氯水、O3、Na2O2、H2O2等
加合型
漂白剂与有色物质结合生成新的无色物质,使有色物质失去原有的颜色
可逆
SO2或H2SO3
吸附型
有些固体物质疏松多孔,具有较大的表面积,可以吸附有色物质而使之失去原有的颜色
部分吸附剂可重复使用
活性炭
鲁科版 (2019)必修 第一册第3章 物质的性质与转化第3节 氮的循环第3课时学案设计: 这是一份鲁科版 (2019)必修 第一册<a href="/hx/tb_c4002549_t4/?tag_id=42" target="_blank">第3章 物质的性质与转化第3节 氮的循环第3课时学案设计</a>,共5页。学案主要包含了学习目标,自 学 自 测,实验探究1,实验探究2,实验结论,自 研 自 悟,探究点1,借题发挥等内容,欢迎下载使用。
鲁科版 (2019)必修 第一册第3章 物质的性质与转化第3节 氮的循环第2课时学案: 这是一份鲁科版 (2019)必修 第一册<a href="/hx/tb_c4002549_t4/?tag_id=42" target="_blank">第3章 物质的性质与转化第3节 氮的循环第2课时学案</a>,共5页。学案主要包含了学习目标,自 学 自 测,氨的喷泉实验,自 研 自 悟,自 练 自 提等内容,欢迎下载使用。
高中化学鲁科版 (2019)必修 第一册第3节 氮的循环第1课时导学案及答案: 这是一份高中化学鲁科版 (2019)必修 第一册<a href="/hx/tb_c4002549_t4/?tag_id=42" target="_blank">第3节 氮的循环第1课时导学案及答案</a>,共5页。学案主要包含了学习目标,自 学 自 测,自 研 自 悟,自 练 自 提等内容,欢迎下载使用。













