





2020-2021学年第2节 硫的转化教课内容课件ppt
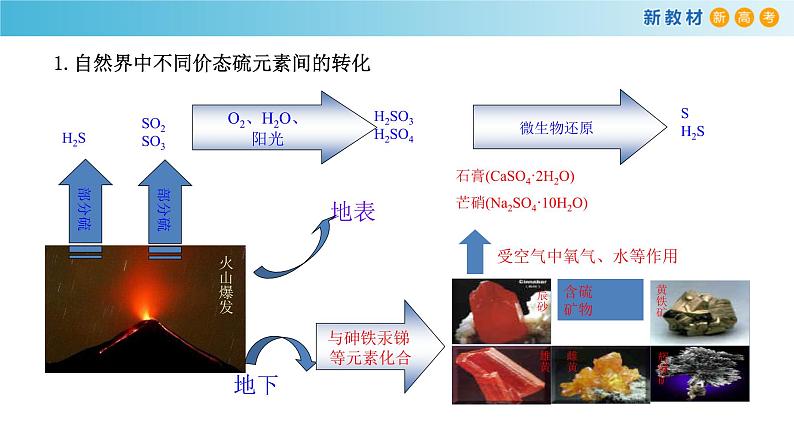
展开火山喷发时熔岩喷涌、浓烟滚滚,不仅释放出巨大的能量,而且产生了许多含有硫元素的气体,在火山口还有硫单质出现。这是自然界中硫单质及含硫化合物的来源之一。 除此之外,自然界中还有哪些含硫化合物?它们在自然界中是怎样产生和以什么形态存在的?人们是怎样把它们转化成生产和生活中所需要的物质的?在使用硫单质及含硫化合物的过程中,人们遇到了哪些问题?这些问题是如何解决的?
与砷铁汞锑 等元素化合
石膏(CaSO4·2H2O)芒硝(Na2SO4·10H2O)
1.自然界中不同价态硫元素间的转化
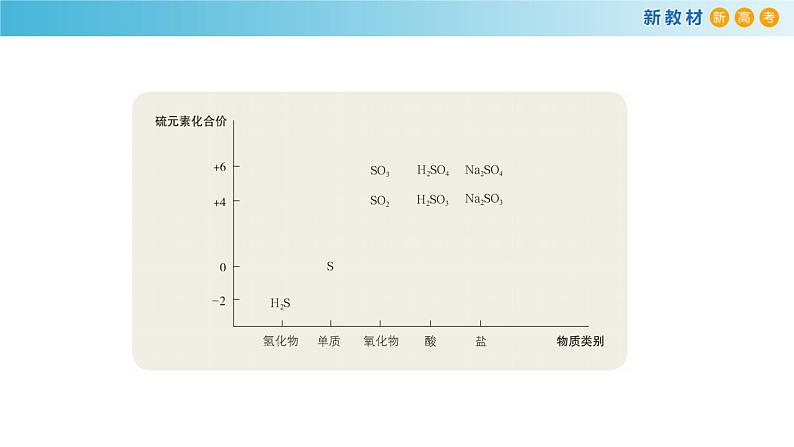
硫的常见化合价及代表物
化合价 代表物-2价 H2S0价 S+4价 SO2、H2SO3、Na2SO3+6价 SO3、H2SO4、Na2SO4
2.认识硫单质(俗名:硫磺)
实验1 取少量硫粉放入试管中,观察它的颜色、状态;在酒精灯上加热,观察发生的现象。
不溶于水,微溶于酒精,易溶于CS2
(1)与金属单质反应(2)与非金属单质反应
现象:剧烈燃烧,发光发热,生成黑色固体。
注意:生成硫化亚铁 FeS
反应放出的热能使反应继续进行
实验2把研细的硫粉和铁粉混合物放在石棉网上堆成条状,用一根加热后的玻璃棒去引燃药品的一端。
[讨论]硫和氯气都能分别与铜、铁反应,试比较反应有何异同。
结论:氯气的氧化性比硫强
实验3取少量硫粉放入燃烧匙中,将燃烧匙放在酒精灯上加热至硫粉熔化并燃烧 后,迅速伸入盛满氧气的集气瓶(底部有少量水)中,观察发生的现象。
现象:燃烧,蓝紫色火焰
实验3取少量硫粉放入燃烧匙中,将燃烧匙放在酒精灯上加热至硫粉熔化并燃烧 后,迅速伸入盛满氧气的集气瓶(底部有少量水)中,观察发生的现象。
划火柴时常闻到的一股呛鼻的气味,就是火柴头成份中的硫燃烧后产生的二氧化硫。
黑火药焰 火火 柴
二、实验室里研究不同价态硫元素间的转化
提出问题含有硫元素的物质在自然界中依靠大自然的作用进行相互转化。那么,在实验室中怎样实现这些物质间的转化呢?
实验目的选取含有硫元素的物质,通过实验探究0、+4、+6这三种价态硫元素之间的相互转化。实验用品SO2水溶液,Na2SO3溶液,浓硫酸,Na2S溶液,稀硫酸,NaOH溶液,酸性KMnO4溶液,氯水,KI溶液,淀粉溶液,品红溶液,铜片;酒精灯,玻璃管,橡胶塞,导气管,试管夹,试管,胶头滴管,铁架台等。实验方案设计及实施
不同价态硫元素之间的转化
SO2水溶液 ( Na2SO3 溶液) 酸性高锰酸钾
高锰酸钾由紫红色变为无色
+4价的硫被氧化成+6价
SO2水溶液 ( Na2SO3 溶液) 氯水
Na2SO3 Na2S 稀硫酸
SO32- + 2H+ = SO2↑+ H2OS2- + 2H+ = H2S↑SO2 + 2H2S =3S↓+2H2O
SO32-+2S2-+6H+=3S↓+3H2O
1、二氧化硫的性质(一)、物理性质 无色,有刺激性气味的有毒气体,密度比空气大,易液化(沸点是-10 C),易溶于水(常温常压下一体积水能溶解40体积的二氧化硫).
(二)化学性质 1、具有酸性氧化物的通性 (1)、与H2O反应: SO2+H2O H2SO3(亚硫酸)
(2)、与碱反应 SO2+2NaOH=Na2SO3+H2O (SO2少量) SO2+NaOH=NaHSO3 (SO2过量) 实验室制取SO2 ,可选择碱液吸收尾气,防止空气污染。
(3)、与碱性氧化物反应: SO2+Na2O=Na2SO3 SO2 +CaO==CaSO3
【思考】已知SO2与澄清石灰水反应,有与CO2类似的现象。试判断SO2通入澄清石灰水直至过量有何现象,并写出反应方程式请思考SO2与CO2怎样区别?
2、具有还原性(1)、 2SO2+O2 2SO3
(2)、SO2+Cl2+2H2O=H2SO4+2HCl 说明:SO2可以使氯水、溴水、碘水褪色。
SO3是一种无色固体,熔点(16.8。C),沸点(44.8。C),SO3与H2O反应生成H2SO4,同时放出大量的热。工业上常用这两个反应制造硫酸。
(3)、可以使酸性高锰酸钾溶液退色
3、具有氧化性 SO2+2H2S=3S↓ +2H2O 4、具有漂白性——能使品红褪色
它能与有色色素结合成不稳定的无色物质而具有漂白性. ---加热可恢复颜色并释放出二氧化硫.它可以用来漂白纸浆、毛、丝、草编制品等。
【思考】SO2的漂白性与氯气相同吗?
注意:不能使紫色石蕊试液褪色 (石蕊变红)
检验:将气体通入品红溶液中,如果品红退色,加热恢复红色,则证明为二氧化硫气体.
将有色的色素氧化为稳定的无色物质
与色素结合成不稳定的无色物质
“黄”银耳是怎样“变”成“雪白雪白”的呢?
【思考】氯水和SO2都具有漂白作用,则将1mlSO2通入含1mlCl2的氯水中,所得溶液的漂白作用加强吗?
此外,二氧化硫还能够杀灭霉菌和细菌,可以用作食物和干果的防腐剂
SO2+Cl2+2H2O=H2SO4+2HCl
A、硫与金属反应B、硫与非金属反应
1.下列说法不正确的是( )
A.硫是一种淡黄色的不溶于水的晶体B.硫的化合物常存在于火山喷出的气体中和矿泉水里C.硫易燃烧,其燃烧产物是大气污染物之一D.硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫
2.下列关于硫的说法不正确的是( )
A.试管内壁附着的硫可用二硫化碳溶解除去B.游离态的硫存在于火山喷口附近或地壳的岩层里C.单质硫既有氧化性,又有还原性D.硫在过量纯氧中的燃烧产物是三氧化硫
3.下列化合物能由两种单质直接化合生成的是( )
A.Fe2S3 B.CuSC.SO3D.SO2
4.下列说法正确的是( )
A.硫单质常存在于火山喷口附近B.进行SO2性质探究实验时,多余的SO2应排到实验室外C.SO2气体通入BaCl2溶液中会产生白色沉淀D.硫在空气中的燃烧产物是SO2,在纯氧中的燃烧产物是SO3
5.下列说法正确的是( )
A.因为SO2具有漂白性,所以它能使品红溶液、溴水、酸性KMnO4溶液、石蕊试液褪色B.能使品红溶液褪色的不一定是SO2C.SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同D.盐酸能使滴有酚酞的NaOH溶液褪色,所以盐酸也有漂白性
6. Cl2和SO2都具有漂白作用,能使品红溶液褪色。若将等物质的量的Cl2、SO2混合后再通入品红与BaCl2的混合溶液,能观察到的现象是( )
①溶液很快褪色 ②溶液不褪色 ③出现沉淀 ④不出现沉淀A.①②B.①③ C.②③D.②④
7.下列化学实验中,能证明某种中学常见气体为SO2的是( )
①能使澄清的石灰水变浑浊 ②能使湿润的蓝色石蕊试纸变红 ③既能使品红溶液褪色又能使澄清的石灰水变浑浊 ④将其通入足量的NaOH溶液中,再滴加BaCl2溶液,有白色沉淀生成,该沉淀溶于稀盐酸 ⑤通入溴水,能使溴水褪色,再滴加Ba(NO3)2溶液,有白色沉淀产生。A.都能证明B.都不能证明C.③⑤都能证明D.只有⑤能证明
9. 检验SO2中是否混有CO2气体,可采用的方法是( )
A.通过品红溶液B.先通过足量NaOH溶液,再通入澄清石灰水C.通过澄清石灰水D.先通过足量酸性KMnO4溶液,再通过澄清石灰水
8.下列溶液中,不能鉴别CO2、SO2气体的是( )
①石灰水 ②H2S水溶液 ③酸性KMnO4溶液 ④溴水 ⑤氯水 ⑥品红溶液A.①⑤B.②③④⑤⑥C.只有①D.③④
2021学年第2节 硫的转化示范课ppt课件: 这是一份2021学年第2节 硫的转化示范课ppt课件,共46页。PPT课件主要包含了分点突破1,分点突破2,认识硫单质,分点突破3,二氧化硫等内容,欢迎下载使用。
高中化学鲁科版 (2019)必修 第一册第2节 硫的转化图片课件ppt: 这是一份高中化学鲁科版 (2019)必修 第一册第2节 硫的转化图片课件ppt,共46页。PPT课件主要包含了任务分项突破,课堂小结提升,学科素养测评,自主梳理,SO3,H2SO4,Na2SO4,SO2,H2SO3,Na2SO3等内容,欢迎下载使用。
鲁科版 (2019)必修 第一册第2节 硫的转化课文课件ppt: 这是一份鲁科版 (2019)必修 第一册第2节 硫的转化课文课件ppt,共24页。PPT课件主要包含了自然界中的硫,黄色或淡黄色,单斜硫,硫的物理性质,硫与铁的反应,硫的化学性质,硫与非金属的反应,二氧化硫SO2,氧化性,三氧化硫的性质等内容,欢迎下载使用。













