




2025届高中化学全程复习构想课件全套34反应热的测定与计算 能源
展开1. 了解燃烧热的概念及能源利用的意义。2.了解中和反应反应热的测定方法。3.掌握盖斯定律的内容及意义,并能进行有关反应热的计算。
OH-(aq)+H+(aq)===H2O(l) ΔH=-57.3 kJ·ml-1
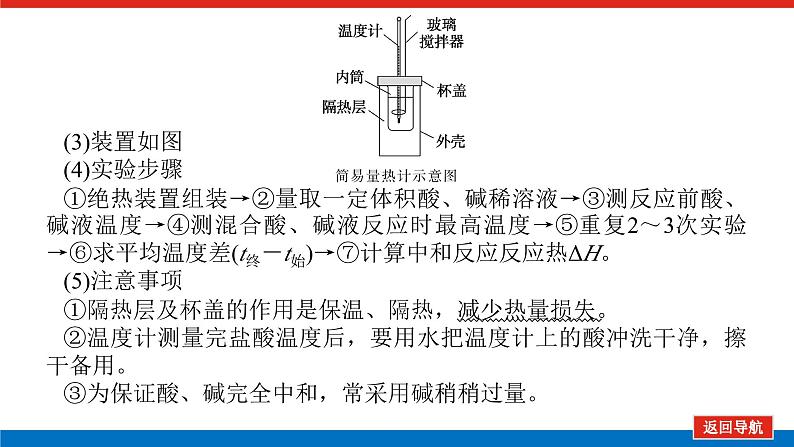
(3)装置如图(4)实验步骤①绝热装置组装→②量取一定体积酸、碱稀溶液→③测反应前酸、碱液温度→④测混合酸、碱液反应时最高温度→⑤重复2~3次实验→⑥求平均温度差(t终-t始)→⑦计算中和反应反应热ΔH。(5)注意事项①隔热层及杯盖的作用是保温、隔热,减少热量损失。②温度计测量完盐酸温度后,要用水把温度计上的酸冲洗干净,擦干备用。③为保证酸、碱完全中和,常采用碱稍稍过量。
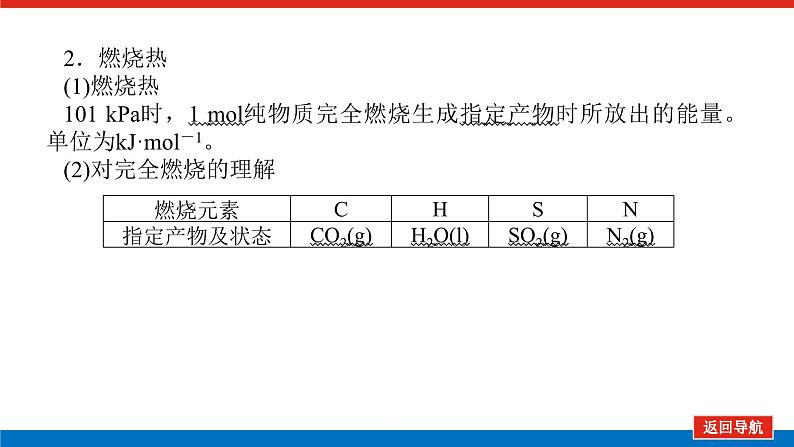
2.燃烧热(1)燃烧热101 kPa时,1 ml纯物质完全燃烧生成指定产物时所放出的能量。单位为kJ·ml-1。(2)对完全燃烧的理解
3.燃料的选择 能源(1)选择原则
【易错诊断】 判断正误,错误的说明理由。1.实验时可用铜丝搅拌器代替玻璃搅拌器:_________________________________________________________。2.已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·ml-1,则稀H2SO4和Ba(OH)2溶液反应的ΔH=2×(-57.3)kJ·ml-1:_________________________________________________________。3.在测定中和反应反应热的实验中,应把NaOH溶液分多次倒入:_________________________________________________________。4.为测定反应H+(aq)+OH-(aq)===H2O(l)的ΔH,也可以选用0.1 ml·L-1 NaHSO4溶液和0.1 ml·L-1 NaOH溶液进行实验:_________________________________________________________。
错误。铜丝搅拌器易散热,不能使用。
错误。应将NaOH溶液迅速全部倒入量热计中。
解析:电解液态水制备1 ml O2(g),电解反应的ΔH=+572 kJ·ml-1,由此可以判断,2 ml H2(g)完全燃烧消耗1 ml O2(g)生成液态水,放出的热量为572 kJ,故1 ml H2(g)完全燃烧生成液态水放出的热量为286 kJ,因此,H2(g)的燃烧热(焓)ΔH=-286 kJ·ml-1。
【师说·延伸】 以典例1为例,细说描述燃烧热的两种方式:①H2(g)的燃烧热为286 kJ·ml-1;②H2(g)的燃烧热ΔH=-286 kJ·ml-1。
典例2 [2020·全国卷Ⅱ,28(1)①]乙烷在一定条件可发生如下反应:C2H6(g)===C2H4(g)+H2(g) ΔH1,相关物质的燃烧热数据如表所示:则ΔH1=________ kJ·ml-1。
解析:先写出三种气体的燃烧热的热化学方程式,然后根据盖斯定律,ΔH1=-1 560 kJ·ml-1-(-1 411 kJ·ml-1)-(-286 kJ·ml-1)=+137 kJ·ml-1。
【对点演练】考向一 能源的开发与利用1.据某网报道,欧洲一集团公司拟在太空建立巨大的集光装置,把太阳光变成激光用于分解海水制氢,其反应可表示为2H2OTiO2 2H2↑+O2↑。有下列几种说法,其中叙述正确的是( )①水分解反应是放热反应 ②若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件 ③使用氢气作燃料有助于控制温室效应 ④氢气是一级能源A.①② B.③④ C.②③ D.①②③④
解析:①水分解反应是吸热反应;②若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可以减少二氧化碳的量,同时得到新能源甲醇,可改善生存条件;③氢气燃烧只生成水,不生成CO2,有助于控制温室效应;④氢气是二级能源。
2.为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想。下列说法正确的是( )A.H2O的分解反应是放热反应B.氢能源已被普遍使用C.2 ml液态H2O具有的能量低于2 ml H2和1 ml O2的总能量D.氢气不易储存和运输,无开发利用价值
解析:2H2O(l)===2H2(g)+O2(g)是吸热反应,说明2 ml液态H2O的能量低于2 ml H2和1 ml O2的能量。因由水制取H2耗能多且H2不易贮存和运输,所以氢能源利用并未普及,但发展前景广阔。
4.CH3OH(l)汽化时吸收的热量为27 kJ·ml-1,CH3OH(g)的燃烧热为677 kJ·ml-1,请写出CH3OH(l)燃烧热的热化学方程式:____________________________________________________________。
5.油酸甘油酯(相对分子质量为884)在体内代谢时可发生如下反应:C57H104O6(s)+80O2(g)===57CO2(g)+52H2O(l)。已知燃烧1 kg该化合物释放出3.8×104 kJ热量,油酸甘油酯的燃烧热为( )A.3.8×104 kJ·ml-1B.-3.8×104 kJ·ml-1C.3.4×104 kJ·ml-1D.-3.4×104 kJ·ml-1
反应热规范答题指导(1)描述反应热时,无论是用“反应热”“焓变”表示还是用ΔH表示,其后所跟数值都需要带“+”“-”符号。如:某反应的反应热(或焓变)为ΔH=-Q kJ·ml-1或ΔH=+Q kJ·ml-1。(2)由于中和反应和燃烧均是放热反应,表示中和热和燃烧热时可不带“-”号。如:某物质的燃烧热为ΔH=-Q kJ·ml-1或Q kJ·ml-1。
考向三 中和反应反应热的测定6.利用如图所示装置测定中和反应反应热的实验步骤如下:①用量筒量取50 mL 0.50 ml·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 ml·L-1NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液的最高温度。
回答下列问题:(1)NaOH溶液稍过量的原因是_________________。(2)倒入NaOH溶液的正确操作是________(填字母,下同)。A.沿玻璃棒缓慢倒入 B.分三次倒入C.一次迅速倒入(3)使盐酸与NaOH溶液混合均匀的正确操作是________。A.用温度计小心搅拌B.揭开杯盖用玻璃棒搅拌C.轻轻地振荡烧杯D.用套在温度计上的玻璃搅拌器轻轻地搅动
(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 ml·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3、则ΔH1、ΔH2、ΔH3的大小关系为________________。
ΔH1=ΔH2<ΔH3
-51.8 kJ·ml-1
考点二 盖斯定律1.盖斯定律:不管化学反应分一步完成或几步完成,最终的反应热相同。化学反应的反应热只与反应体系的始态和终态有关,与反应途径无关。
2.“盖斯定律”型反应热(焓变)的运算规则
【师说·延伸】 概括为:察唯一、定加减、调系数、做运算。
典例2 [2022·山东卷,20(1)]利用γ-丁内酯(BL)制备1,4-丁二醇(BD),反应过程中伴有生成四氢呋喃(THF)和1-丁醇(BuOH)的副反应,涉及反应如下:已知:因反应Ⅰ在高压H2氛围下进行,故H2压强近似等于总压。以5.0×10-3 ml BL或BD为初始原料,在493 K、3.0×103 kPa的高压H2氛围下,分别在恒压容器中进行反应。达平衡时,以BL为原料,体系向环境放热X kJ;以BD为原料,体系从环境吸热Y kJ。忽略副反应热效应,反应Ⅰ焓变ΔH(493 K,3.0×103 kPa)=__________ kJ·ml-1。
解析:结合已知信息,可推定在同温同压下,以同物质的量的BL或BD为初始原料,分别从正、逆方向建立相同的平衡时状态。以5.0×10-3 ml的BL为原料,若完全转化为BD放出的热量为(X+Y)kJ,则1 ml BL为原料完全转化为BD放出的热量为200(X+Y)kJ,反应Ⅰ的焓变ΔH=-200(X+Y)kJ·ml-1。
【师说·延伸】 可逆反应的反应热(ΔH)与可逆无关,是指给定反应物完全转化时的反应热。
-213 kJ·ml-1
3.[2024·河北唐县模拟]室温下,将1 ml CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将1 ml的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2;CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s)===CuSO4(s)+5H2O(l),热效应为ΔH3。下列判断正确的是( )A.ΔH2>ΔH3B.ΔH1<ΔH3C.ΔH1+ΔH3=ΔH2D.ΔH1+ΔH2>ΔH3
考向三 根据盖斯定律确定热化学方程式4.NOx是造成大气污染的主要物质,用还原法将其转化为无污染的物质,对于消除环境污染有重要意义。已知:2C(s)+O2(g)⇌2CO(g) ΔH1=-221.0 kJ·ml-1N2(g)+O2(g)⇌2NO (g) ΔH2=+180.5 kJ·ml-12NO(g)+2CO(g)⇌2CO2(g)+N2(g) ΔH3=-746.0 kJ·ml-1则用焦炭还原NO生成无污染气体的热化学方程式为:__________________________________________。
2NO(g)+C(s)⇌CO2(g)+ N2(g)ΔH=-573.75 kJ·ml-1
解析:①2C(s)+O2(g)⇌2CO(g) ΔH1=-221.0 kJ·ml-1②N2(g)+O2(g)⇌2NO(g) ΔH2=+180.5 kJ·ml-1③2NO(g)+2CO(g)⇌2CO2(g)+N2(g)ΔH3=-746.0 kJ·ml-1根据盖斯定律,由(③+①-②)/2得该反应的ΔH=(ΔH3+ΔH1-ΔH2)/2=-573.75 kJ·ml-1。
5.含碳化合物在生产生活中广泛存在,Andren Dasic等提出在M+的作用下以N2O为氧化剂可以氧化乙烯生成乙醛,催化体系氧化还原循环如图所示,请回答下列问题。已知N2O(g)+M+(s)===N2(g)+MO+(s) ΔH1=+678 kJ·ml-1MO+(s)+C2H4(g)===C2H4O(g)+M+(s) ΔH2=-283 kJ·ml-1请写出在M+的作用下以N2O为氧化剂氧化乙烯生成乙醛的热化学方程式:____________________________________________。
N2O(g)+C2H4(g)===N2(g)+C2H4O(g) ΔH=+395 kJ·ml-1
解析:已知:①N2O(g)+M+(s)===N2(g)+MO+(s) ΔH1=+678 kJ·ml-1②MO+(s)+C2H4(g)===C2H4O(g)+M+(s)ΔH2=-283 kJ·ml-1根据盖斯定律①+②可得N2O(g)+C2H4(g)===N2(g)+C2H4O(g) ΔH=ΔH1+ΔH2=+678 kJ·ml-1+(-283 kJ·ml-1)=+395 kJ·ml-1。
考向四 盖斯定律在能量图像中的应用6.氨的合成是重要的化工生产之一。工业上合成氨用的H2有多种制取方法:
①用焦炭跟水反应:C(s)+H2O(g)高温CO(g)+H2(g);②用天然气跟水蒸气反应:CH4(g)+H2O(g)催化剂,高温CO(g)+3H2(g)。已知有关反应的能量变化如图所示,且方法②的反应只能在高温条件下发生,则方法②中反应的ΔH=____________ kJ·ml-1。
解析:先抓三种物质,这三种物质既在目标热化学方程式里,又在已知图中只出现过1次,它们分别是图3的CH4、图1的CO、图2的H2。其中CH4在图3和②中都是反应物,位置相同,系数也相同,即+(-c kJ·ml-1);CO的位置在图1和②中不同,系数相同,即-(-a kJ·ml-1);H2的位置在图2和②中不同,且目标热化学方程式中H2的系数是图2的3倍,即-(-3b kJ·ml-1)。所以ΔH=(-c kJ·ml-1)-(-a kJ·ml-1)-(-3b kJ·ml-1)=(a+3b-c)kJ·ml-1。
解析:(题给条件为物质的标准摩尔生成焓,运用ΔH=生成物的标准摩尔生成焓-反应物的标准摩尔生成焓计算)ΔH2=(-241.8 kJ·ml-1)+(-110.5 kJ·ml-1)-(-393.5 kJ·ml-1)=+41.2 kJ·ml-1。
【师说·延伸】 计算反应热模型构建
【对点演练】1.[2024·湖北武汉检测节选]甲醇制烯烃是一项非石油路线烯烃生产技术,可以减少我国对石油进口的依赖。甲醇制烯烃的反应是不可逆反应,烯烃产物之间存在如下转化关系:反应Ⅰ.2C3H6(g)⇌3C2H4(g) ΔH1=+117 kJ·ml-1;反应Ⅱ.3C4H8(g)⇌4C3H6(g) ΔH2=+78 kJ·ml-1;反应Ⅲ.C4H8(g)⇌2C2H4(g) ΔH3。①则反应Ⅲ的ΔH3=________ kJ·ml-1。
2.[2024·河北邯郸摸底考节选]以氢气、一氧化碳为主要组分的合成气是一种重要的化工原料,可以合成甲醇等许多重要的化工产品。合成甲醇的热化学方程式为CO(g)+2H2(g)⇌CH3OH(g) ΔH=-90.0 kJ·ml-1。相关化学键的键能如表所示,则表中的x=________。
解析:(题给条件为键能,则运用ΔH=反应物的键能总和-生成物键能总和计算)ΔH=(x kJ·ml-1+436 kJ·ml-1×2)-(413 kJ·ml-1×3+351 kJ·ml-1+465 kJ·ml-1)=-90.0 kJ·ml-1,解得x=1 093。
2025届高中化学全程复习构想课件全套36新型化学电源: 这是一份2025届高中化学全程复习构想课件全套36新型化学电源,共44页。PPT课件主要包含了考点一,考点二,考点三,考点四,答案C,答案B,答案D,答案A等内容,欢迎下载使用。
2025届高中化学全程复习构想课件全套33反应热 热化学方程式: 这是一份2025届高中化学全程复习构想课件全套33反应热 热化学方程式,共43页。PPT课件主要包含了考点一,考点二,ΔH=Qp,答案-45,答案C,放热反应,akJ·mol-1等内容,欢迎下载使用。
2025届高中化学全程复习构想课件全套05氧化还原反应的配平与计算: 这是一份2025届高中化学全程复习构想课件全套05氧化还原反应的配平与计算,共40页。PPT课件主要包含了考点一,考点二,配平依据,配平步骤,OH-,Al2O3,归纳总结补项原则,模型构建,7∶3,mol等内容,欢迎下载使用。













