




- 华师大版科学九上2.2《重要的酸1》课件+素材 课件 0 次下载
- 华师大版科学九上2.2《重要的酸2》课件+素材 课件 0 次下载
- 华师大版科学九上2.3《重要的碱1》课件+素材 课件 0 次下载
- 华师大版科学九上2.3《重要的碱2》课件+素材 课件 0 次下载
- 华师大版科学九上2.3《重要的碱3》课件 课件 0 次下载
科学九年级上册2 重要的酸试讲课课件ppt
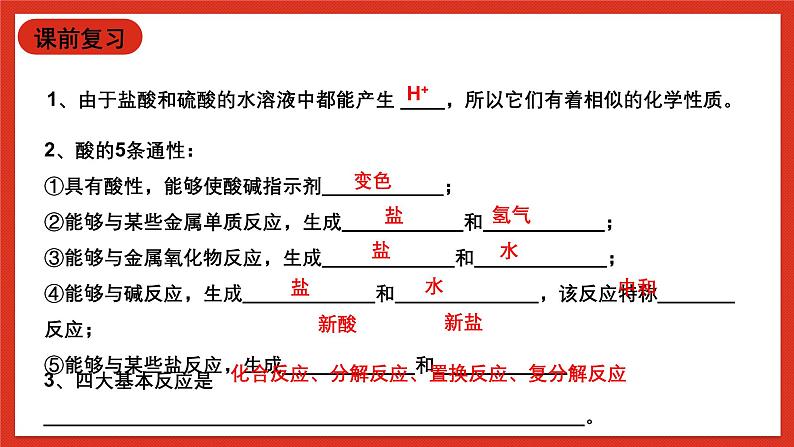
展开1、由于盐酸和硫酸的水溶液中都能产生 ____,所以它们有着相似的化学性质。
2、酸的5条通性:①具有酸性,能够使酸碱指示剂___________;②能够与某些金属单质反应,生成___________和___________;③能够与金属氧化物反应,生成____________和____________;④能够与碱反应,生成____________和_____________,该反应特称_______反应;⑤能够与某些盐反应,生成____________和____________。
3、四大基本反应是_________________________________________________。
化合反应、分解反应、置换反应、复分解反应
学习了酸的个性和酸的通性,酸的性质有什么作用呢?
现在实验桌上有一瓶装有无色液体的试剂瓶,可能为盐酸或硫酸。思考:如何区分/鉴别盐酸和硫酸?
根据目前所学可以辨别的方法:1.闻气味(硫酸没有明显的气味,盐酸有刺激性气味)。
但酸的浓度较低时,无法有效辨别
2.观察液体状态,水状为盐酸,油状为硫酸。
3.将液体分别滴在纸上,观察。(如白纸变为黑色,则为硫酸,利用硫酸的脱水性)
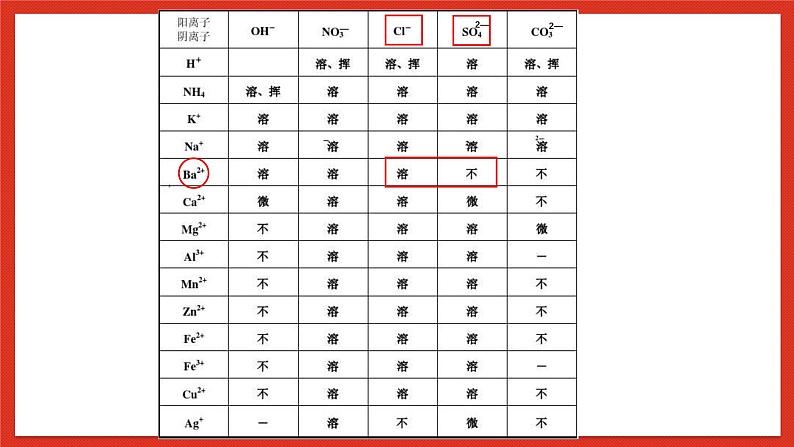
稀盐酸HCl、稀硫酸H2SO4在水中都会电离出H+,差别在于阴离子( Cl- 和 SO42-)
鉴别稀盐酸HCl、稀硫酸H2SO4,实际上是鉴别 Cl- 和 SO42- 。
查阅“部分酸碱盐的溶解性表”
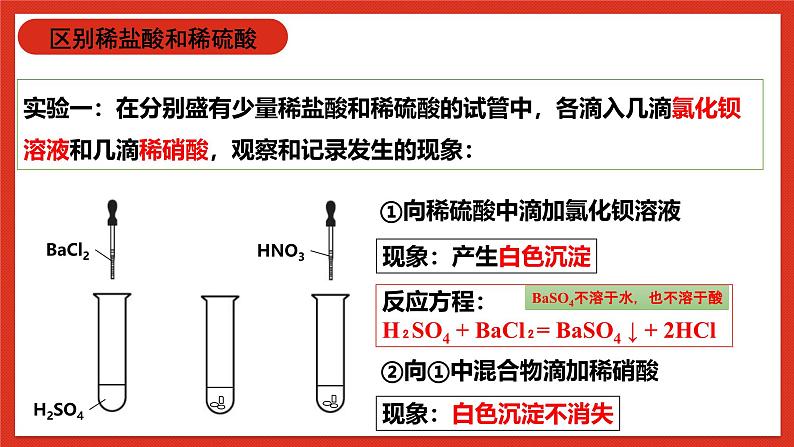
实验一:在分别盛有少量稀盐酸和稀硫酸的试管中,各滴入几滴氯化钡溶液和几滴稀硝酸,观察和记录发生的现象:
①向稀盐酸中滴加氯化钡溶液
②向①中混合物滴加稀硝酸
①向稀硫酸中滴加氯化钡溶液
反应方程: H₂SO4 + BaCl₂= BaSO4 ↓ + 2HCl
BaSO4不溶于水,也不溶于酸
实验二:在分别盛有少量稀盐酸和稀硫酸的试管中,各滴入几滴硝酸银溶液和几滴稀硝酸,观察和记录发生的现象:
①向稀盐酸中滴加硝酸银溶液
反应方程: HCl+AgNO₃ =AgCl↓+HNO₃
AgCl不溶于水,也不溶于酸
①向稀硫酸中滴加硝酸银溶液
反应方程: H₂SO4 +2AgNO3= Ag2SO4 ↓ + 2HNO3
Ag2SO4 不溶于水,但溶于硝酸
区别稀盐酸和稀硝酸方法小结
若向某溶液中加入BaCl2溶液后,有白色沉淀生成,是否说明该溶液中一定含有SO42-?
若向某溶液中加入AgNO3溶液后,有白色沉淀生成,是否说明该溶液中一定含有Cl-?
现象:四支试管均产生白色沉淀
→无法判断白色沉淀成分,进而无法确定液体中是否存在Cl-/SO42-
在鉴别盐酸和硫酸的实验中,我们可以根据产物在水中溶解性的差异便可以进行区分,为什么还要加入稀硝酸?
现象:第一、第三支试管中白色沉淀不消失;第二、第四支试管中白色沉淀逐渐消失
为了排除碳酸根的干扰。
注意:1、 BaSO4和AgCl都是不溶于水、不溶于酸的白色沉淀; Ag2SO4为微溶于水、溶于稀硝酸的白色沉淀。2、滴加稀硝酸是为了①排除碳酸盐的干扰②溶解硫酸银以区分氯化银沉淀。
1.下列能鉴别区分稀盐酸和稀硫酸的试剂是( ) A.紫色石蕊试剂 B.氯化钡溶液 C.硝酸钡溶液 D. 硝酸银溶液
硝酸银和稀盐酸反应生成不溶的氯化银白色沉淀,和稀硫酸反应形成微溶的硫酸银白色沉淀,无法通过现象区分。可再滴加稀硝酸进去,由于硫酸银与硝酸反应消失,氯化银无变化,得以区分。
稀盐酸溶液中存在氯离子(Cl-),氯化钠等物质的溶液中也含有氯离子。如何来检验Cl-的存在呢?
选用的试剂:硝酸银溶液、稀硝酸
实验步骤:在装有氯化钠、氯化钡、氯化钙、氯化钾等溶液的试管中,加入适量的硝酸银溶液,并滴加稀硝酸溶液,观察现象。
现象: 。
各试管中都产生不溶于稀硝酸的白色沉淀。
NaCl+AgNO₃ =AgCl↓+NaNO₃BaCl₂+2AgNO₃ =2AgCl↓+Ba(NO₃) ₂KCl+ AgNO₃ =AgCl↓+KNO₃CaCl ₂+2AgNO₃ =2AgCl↓+Ca(NO₃) ₂
溶液中氯化钠形成的微观实质:氯离子与银离子结合形成氯化银沉淀。
Cl- +Ag+ = 2AgCl↓
稀硫酸溶液中存在硫酸根离子(SO42-),硫酸钠等物质的溶液中也存在硫酸根离子。如何来检验SO42- 的存在呢?
选用的试剂:氯化钡溶液、稀硝酸
实验步骤:在装有硫酸钠、硫酸钾、硫酸铜、硫酸钙等溶液的试管中,加入适量的氯化钡溶液,并滴加稀硝酸溶液,观察现象。
SO42- +Ba2+ = BaSO4 ↓
溶液中硫酸钡形成的微观实质:硫酸根与钡离子结合形成硫酸钡沉淀。
BaCl₂+NaSO4 =BaSO4↓+2NaClBaCl₂+K₂SO4 = BaSO4↓+2KClBaCl₂+ CuSO4 = BaSO4 ↓ +2CuCl₂BaCl₂+ CaSO4 = BaSO4 ↓ +2CaCl₂
HCl+AgNO₃ =AgCl↓+HNO₃
BaCl₂+H₂SO4 = BaSO4 ↓ + 2HCl
H2SO4+AgNO3=
2HCl+CuSO4 = CuCl2+H2SO4
怎么样才是有新物质生成?
进一步理解 复分解反应发生条件
生成物至少一种为沉淀、气体或水。
CuO+2HCl=CuCl2+ H2O
Ca(OH) 2+H2SO4=CaSO4+2H2O
AgNO3 +HCl= HNO3 +AgCl↓
CaCO3 +HCl= CaCl2 +H2O+CO2↑
复分解反应:两种化合物相互交换成分生成另两种 化合物的反应。
NaCl中混有少量Na2CO3
HCl中混有少量BaCl2
Zn+H2SO4= ZnSO4+H2↑
CaCO3 +2HCl= CaCl2 +H2O+CO2↑
生物体内的酸有一些叮人的蚂蚁会分泌蚁酸,蚁酸又叫甲酸。很久以前,人们曾将蚂蚁放在大锅里用水煮沸后提取甲酸,现在人们已能用化学方法制造甲酸了。甲酸可用来保存青饲料,在制造纸张和纺织品时也用到甲酸。蜜蜂蜇人很痛,因为蜜蜂蜇针放出的液体是酸性的,如果用肥皂或其他碱性的溶液涂抹被蜇处,可中和酸性,缓解疼痛。
生物体内的酸人体内也产生酸。人在剧烈运动时,会因缺氧而不能将葡萄糖转化为水和二氧化碳,只能将葡萄糖转化为乳酸,乳酸在肌肉中积累,会使人感到肌肉酸痛甚至引起肌肉痉挛(抽筋)。另一种乳酸存在于酸奶中,是细菌分解鲜奶的产物。人的胃壁分泌胃酸,胃酸是pH约为1的盐酸,它帮助人们消化食物。但胃酸过多也会引起不适,需服用一些药物来治疗。
3.某同学为了区别稀盐酸和稀硫酸,设计了如下图所示的四组实验方案,其中能达到目的的是( )
4.下列各物质的溶液,能分别和硫酸、盐酸、硝酸铜溶液反应,并可观察到不同实验现象的是( )A.碳酸钠 B.氢氧化钡 C.氢氧化钠 D.氯化钾
5.为了鉴别一桶实验室用的蒸馏水是否被某种酸污染,不可 取的方法是( )A.取样品用pH计测定样品的pHB.测定样品的密度C.取样品滴入酚酞试液D.测试样品的导电性
6.要把含有盐酸的氯化钙溶液中和到中性,在不用指示剂的条件下,最好加入的试剂是( )A.石灰石粉末 B.氨水C.氢氧化钠溶液 D.碳酸钠溶液
初中科学华师大版九年级上册2 重要的酸优质课课件ppt: 这是一份初中科学华师大版九年级上册2 重要的酸优质课课件ppt,文件包含22《重要的酸》课件pptx、22《重要的酸》练习doc、22《重要的酸》教案3doc等3份课件配套教学资源,其中PPT共26页, 欢迎下载使用。
科学九年级上册2 重要的酸试讲课课件ppt: 这是一份科学九年级上册2 重要的酸试讲课课件ppt,文件包含《重要的酸》课件第二课时pptx、《重要的酸》教案酸的化学性质doc、《重要的酸》练习第二课时doc等3份课件配套教学资源,其中PPT共24页, 欢迎下载使用。
初中科学2 重要的酸优秀课件ppt: 这是一份初中科学2 重要的酸优秀课件ppt,文件包含《重要的酸》课件第一课时pptx、《重要的酸》教案第一课时doc、《重要的酸》练习第一课时doc、盐酸的物理性质asf、视频mp4等5份课件配套教学资源,其中PPT共25页, 欢迎下载使用。













