





华东师大版(2024)九年级上册2 重要的酸试讲课ppt课件
展开浓盐酸和浓硫酸分别有什么特性?
无色、油状、难挥发、易溶于水、吸水性
在日常生活中,酸处处可见,人们对酸的利用大多与其化学性质有关,那么酸有何化学性质?我们通过怎样的方式去探究酸的化学性质?
探究稀盐酸和稀硫酸的化学性质
试管、试管夹、烧杯、酒精灯,稀盐酸,稀硫酸
金属:镁条、锌片、铁片、铜片
盐:石灰石(CaCO3) 、碳酸钠
金属氧化物:氧化铁、氧化铜
酸碱指示剂:石蕊试液,酚酞试液、pH试纸
步骤:将紫色石蕊试剂滴入盛有稀盐酸和稀硫酸的试管中, 观察溶液颜色的变化。
现象:稀盐酸和稀硫酸滴入紫色石蕊试剂后变红
结论:稀盐酸和稀硫酸具有__________。
稀盐酸 稀硫酸
实验一:稀盐酸和稀硫酸与指示剂的作用
步骤:将镁条、锌片、铁片、铜片投入到盛有稀盐酸和稀硫酸的试管中,观察试管中的变化。
实验二:稀盐酸和稀硫酸与金属的反应
有爆鸣声(气体燃烧)火焰变为淡蓝色
为什么铜片表面无现象?
Cu化学性质不够活泼。
现象:在镁条、锌片、铁片表面产生气泡,铜片表面无现象。
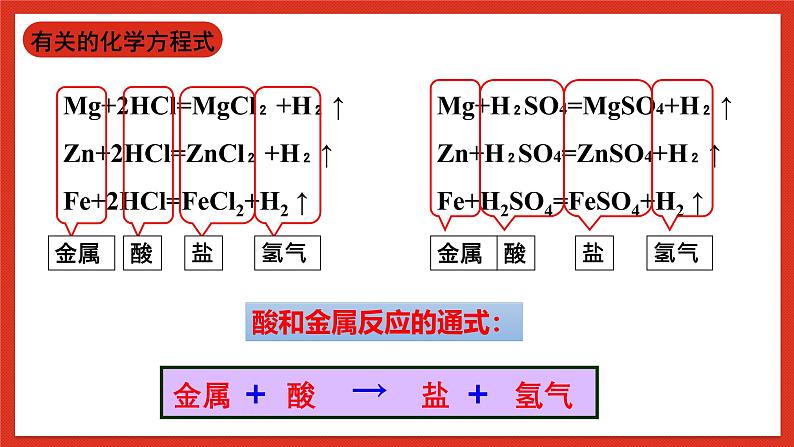
结论:稀盐酸和稀硫酸能够与某些金属发生反应,并生成氢气
补充:目前常见的能与稀盐酸和稀硫酸反应的金属有Mg、Zn、Fe; 不反应的金属有Cu、Ag。
Mg+2HCl=MgCl₂ +H₂ ↑Zn+2HCl=ZnCl₂ +H₂ ↑Fe+2HCl=FeCl2+H2 ↑
Mg+H₂SO4=MgSO4+H₂ ↑Zn+H₂SO4=ZnSO4+H₂ ↑Fe+H2SO4=FeSO4+H2 ↑
置换反应:一种单质和另一种化合物反应生成另一种单质和一种化合物的反应。
化学方程式书写规则可以简单理解为:A+BC→AC+B注:实际书写的时候并不是简单的交换成分,还要注意化学式自身书写是否符合规则。
Fe+2HCl=FeH2+Cl2 ↑
Fe+HCl=FeCl+H ↑
化合物的化学式中各元素皆为+价或-价,不满足化合价总代数和为0
仅仅交换了成分,但不满足化合价总代数和为0
试正确写出以下置换反应的方程式:
下列方程式的书写正确吗?
2Al+3H2SO4= Al2(SO4)3+3H2↑
2Fe+6HCl=2FeCl3+3H2 ↑
不符合化学反应事实,不会生成Fe3+
步骤:将氧化铁、氧化铜投入到盛有稀盐酸和稀硫酸的试管中, 观察试管中的变化。
实验三:稀盐酸和稀盐酸与金属氧化物的反应
现象:红色的氧化铁逐渐消失,溶液逐渐变为黄色; 黑色的氧化铜逐渐消失,溶液逐渐变为蓝色(与稀硫酸) 或蓝绿色(与稀盐酸)。
结论:稀盐酸和稀硫酸能够与金属氧化物发生反应。
Fe2O3 + 6 HCl = 2FeCl3 + 3 H2O
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3 H2O
CuO + 2 HCl = CuCl2 + H2O
CuO + H2SO4 = CuSO4 + H2O
酸和金属氧化物反应的通式:
复分解反应:两种化合物相互交换成分生成另两种化合物的反应。
化学方程式书写规则可以简单理解为:AB+CD→AD+BC注:实际书写的时候并不是简单的交换成分,还要注意化学式自身书写是否符合规则。
CuO+2HCl=CuH2+Cl2O
CuO+2HCl=CuCl+H2O↑
试正确写出以下复分解反应的方程式:
Al2O3+3H2 SO4 =
Al2(SO4)3+3H2O
步骤:向两个装有氢氧化钠溶液的容器中滴加紫色石蕊试液,再分别加入稀盐酸和稀硫酸,观察试管中的变化。
现象:溶液先变蓝色后转变为红色。
结论:稀盐酸和稀硫酸能够与碱发生反应。
实验四:稀盐酸和稀硫酸与碱的反应
HCl + NaOH=NaCl + H2O
H2SO4+2NaOH=Na2SO4+2H2O
酸和碱生成盐和水的反应,我们称之为中和反应。
中和反应本质上也属于复分解反应。
2KOH+H2SO4 =
Ca(OH)2+2HCl =
CaCl2+2H2O
步骤:将碳酸钠投入至盛有稀盐酸、稀硫酸的容器中,观察现象。
现象:容器中有气泡产生
结论:稀盐酸和稀硫酸能够与某些盐发生反应。
石灰石(CaCO3)?
实验五:稀盐酸和稀硫酸与盐的反应
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2↑
酸和盐反应本质上也属于复分解反应。
试正确写出以下酸和盐反应的方程式:
BaCl2+H2SO4 =
AgNO3+HCl =
BaSO4 ↓ +2HCl
AgCl ↓+HNO3
注:硫酸钡BaSO4和氯化银AgCl不溶于酸。
稀盐酸和稀硫酸具有相似的化学性质的原因?
氯化氢分子和硫酸分子溶于水中发生电离,且都电离出氢离子(H+)。
盐酸: HCI = H + + CI-硝酸: H NO3 = H + + NO3-硫酸: H2SO4 = 2H + + SO 42-碳酸: H2CO3 = 2H + + CO 32-醋酸: CH3OOH = H + + CH3OO - 通式: 酸 = H+ + 酸根离子
酸的概念:电离时产生的阳离子全部是氢离子( H+ )的化合物。
可以理解为:5条酸的通性,其实都是H+与物质反应所体现的。
以上写法称为酸的电离方程式。
2.苯甲酸的酸性比醋酸强。下列对苯甲酸性质的推测不合理的是 ( )A.苯甲酸溶液的pH小于7B.苯甲酸溶液能与铜反应生成氢气 C.苯甲酸溶液能使紫色石蕊试液变红 D.苯甲酸溶液能与碱发生中和反应
1.酸具有相似的化学性质的主要原因是( )A.酸都能和指示剂作用B.酸在水溶液中都能电离出H+C.酸都能和碱反应D.酸都含有酸根离子
3.下列物质和盐酸反应生成黄色溶液的是( )A. Fe B. MgO C. Cu(OH)2 D. Fe(OH)3
4.下列关于H2SO4性质的描述中,不属于酸的通性的是( ) A.使紫色石蕊试液变红B.与NaOH发生中和反应C.浓硫酸滴到白纸上使纸变黑D.与Mg反应放出氢气
5.不能用金属跟酸直接反应得到的物质是( ) A.FeCl2 B.ZnCl2 C.FeCl3 D.MgSO4
6.把一根洁净的铁钉放入稀硫酸中,下列叙述正确的是( ) ①在铁钉表面产生气泡 ②溶液由无色逐渐变为浅绿色 ③铁钉的质量增加 ④溶液的质量减轻. A.②③ B.①②③ C.①②④ D.①②
7.下列反应中,不属于置换反应的是( )A. Cl2+2NaBr 2NaCl+Br2 B. Zn+CuSO4 ZnSO4+CuC. Fe2O3+3CO 2Fe+3CO2 D. CuO+H2 Cu+H2O
初中科学华师大版九年级上册2 重要的酸优质课课件ppt: 这是一份初中科学华师大版九年级上册2 重要的酸优质课课件ppt,文件包含22《重要的酸》课件pptx、22《重要的酸》练习doc、22《重要的酸》教案3doc等3份课件配套教学资源,其中PPT共26页, 欢迎下载使用。
科学九年级上册2 重要的酸试讲课课件ppt: 这是一份科学九年级上册2 重要的酸试讲课课件ppt,文件包含《重要的酸》课件第二课时pptx、《重要的酸》教案酸的化学性质doc、《重要的酸》练习第二课时doc等3份课件配套教学资源,其中PPT共24页, 欢迎下载使用。
初中科学2 重要的酸优秀课件ppt: 这是一份初中科学2 重要的酸优秀课件ppt,文件包含《重要的酸》课件第一课时pptx、《重要的酸》教案第一课时doc、《重要的酸》练习第一课时doc、盐酸的物理性质asf、视频mp4等5份课件配套教学资源,其中PPT共25页, 欢迎下载使用。













