





高中化学人教版 (2019)必修 第一册第一节 原子结构与元素周期表背景图课件ppt
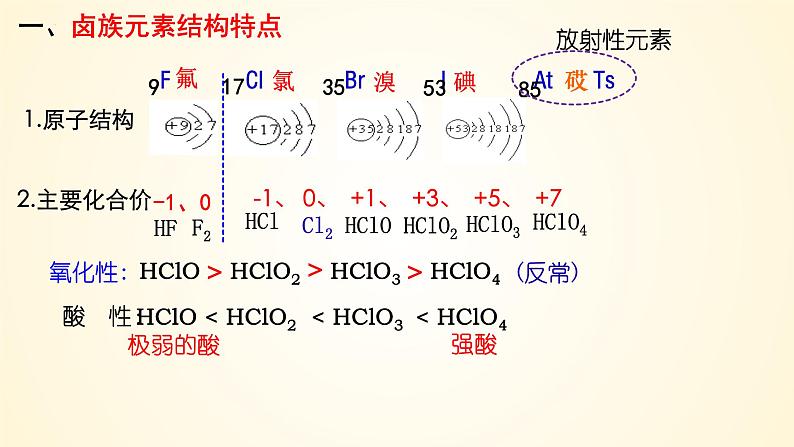
展开F Cl Br I At Ts
得e-能力逐渐 。
非金属性逐渐 。
元素的非金属性:单质的氧化性:离子的还原性:
F > Cl > Br > I
F2 > Cl2 > Br2 > I2
F- < Cl- < Br- < I-
HClO HClO2 HClO3 HClO4
-1、 0、 +1、 +3、 +5、 +7
HClO < HClO2 < HClO3 < HClO4
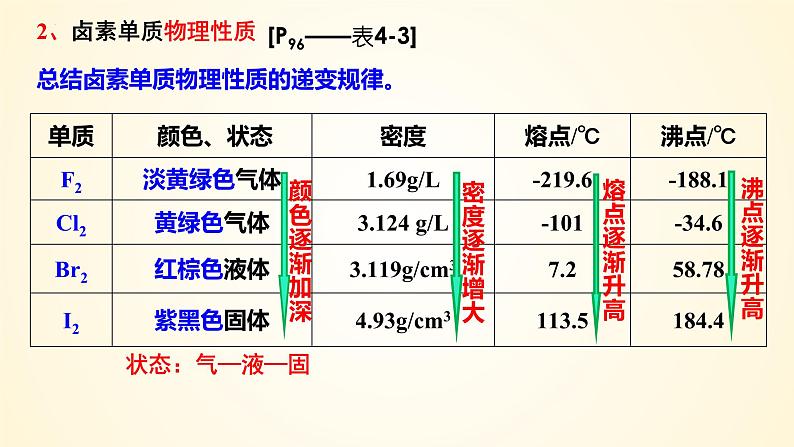
总结卤素单质物理性质的递变规律。
[P96——表4-3]
都有颜色 有毒 在水中溶解度不大,易溶于有机溶剂
总结归纳:卤素单质的物理性质
2. 递变性随着核电荷数逐渐增大,颜色逐渐加深,熔、沸点逐渐_____,密度逐渐_____。
(特殊:F2与水反应)
(从 F 到 I2 )
了解:溴和碘在不同溶剂中所生成溶液的颜色变化
碘酒就是碘的 溶液,呈 色。
溴/有机溶剂:橙红碘/有机溶剂:紫红
3.卤素单质的化学性质
1)与金属单质(除金、铂外)反应2)与某些非金属单质(如H2、P、C等)反应3)与水反应4)与碱液反应【制漂白粉、漂白液等】5) 与一些还原性物质反应
Fe2+\ SO32-\ SO2\ I- \ Br- \ S2- \
根据原子结构特点,试推测F2、Cl2、Br2、I2在化学性质上所表现的相似性和递变性。
(I2的氧化能力弱,跟变价金属反应时,生成低价态)
1).卤素与金属单质的反应
[注意: 与氯气性质对比]
∴ 氧化性: F2 > Cl2 > Br2 > Fe3+ > I2
①F2可与所有金属单质反应 (它甚至可与惰性气体反应)
(X=F、Cl、Br)
F2+H2 = 2HF
I2+H2 2HI
Br2+H2 2HBr
Cl2+H2 2HCl
[持续加热,反应可逆]
(1)单质的氧化性:F2 Cl2 Br2 I2
2).卤素与氢气的反应
(2)生成的HX稳定性关系:HF > HCl > HBr > HI
HF < HCl < HBr < HI
HF(弱酸) < HCl < HBr < HI
【教材P97 表4-4】
Br2+ H2O HBr+HBrO
2F2+2H2O=4HF+O2
I2 +H2O HI+HIO
问题: IBr + H2O = HIO + HBr 是氧化还原反应吗?
Cl2 + H2O HCl+HClO
通式:X2 + H2O = HX + HXO (X:Cl、Br、I)
4)、卤素单质与碱反应?:
X2 + 2NaOH = NaX + NaXO + H2O
所以,NaOH可使氯水、溴水、碘水褪色
(X=Cl、Br、I)
IBr+ 2NaOH = NaIO+ NaBr +H2O
思考: IBr与NaOH溶液反应的方程式?
5)卤素间的置换反应?
〖思考〗F2与氯、溴、碘的盐溶液可以置换出相应的卤素单质吗?
(P98 实验4-1)
①氯水与KBr溶液混合
Cl2 + 2KI =I2 + 2KCl
Cl2+ 2KBr=2KCl+Br2
Br2+ 2KI = 2KBr + I2
(Cl2可使湿润的淀粉KI试纸变蓝)
证明氧化性:Cl2>Br2>I2
①最高价氧化物对应水化物的酸性强弱:
元素非金属性强弱判断依据
②非金属元素单质与H2化合的难易程度:
化合越容易,非金属性越强
③形成气态氢化物的稳定性:
气态氢化物越稳定,元素的非金属性越强
⑤对应阴离子的还原性:
阴离子的还原性越强,元素的非金属性越弱
酸性越强,对应非金属元素非金属性越强
下列事实能说明氯元素的非金属性比硫元素强的是 。①HCl的溶解度比H2S大 ②HCl的酸性比H2S强 ③HCl的稳定性比H2S大 ④HCl的还原性比H2S弱 ⑤HClO4的酸性比H2SO4强 ⑥Cl2与铁反应生成FeCl3,而S与铁反应生成FeS ⑦Cl2能与H2S反应生成S ⑧还原性:Cl-<S2-
至此我们可以看到同一主族元素,无论是金属还是非金属在性质方面都具有一定的相似性和递变性。
最高价氧化物对应的水化物碱性增强
最高价氧化物对应的水化物酸性减弱
6)卤素离子与硝酸银反应
Ag+ + Cl– = AgCl ↓ 白色
Ag+ + Br– = AgBr ↓ 浅黄色
Ag+ + I– = AgI↓ 黄色
溶解度逐渐减小,颜色越来越深。
F - + Ag+ _____ (无变化)
①除AgF外,均有感光性, 其中AgBr作感光材料,可用于照相。
②AgI可进行人工降雨。
3.卤素离子的检验方法
(1)AgNO3溶液——沉淀法
防止Ag2CO3、Ag3PO4等的干扰
紫色、浅紫色或紫红色,表明有
红棕色或橙红色,表明有
加入CCl4(下层)或汽油(上层)
―――――――――――→
(3)氧化——淀粉法检验I-
加适量新制饱和氯水(H2O2)
――――――――――――→
色溶液,表明有I-
[补充]:卤素单质及其化合物的特性
①F无正价和含氧酸,非金属性最强。
③HF是弱酸,有毒;能腐蚀玻璃,保存在铅制器皿或塑料瓶中;
甚至可与某些稀有气体反应
2F2+2H2O=4HF+O2
在HX中HF沸点最高。 (HF常温下为液态)
④AgF易溶于水,CaF2(萤石)难溶。
F2可氧化所有的金属
CaF2 +H2SO4(浓) = CaSO4 + 2HF↑
① Br2是深红棕色液体(常温下唯一的液态非金属单质)
④ Br2易溶于有机溶剂。
③ Br2会腐蚀橡胶、皮肤。
②I2易升华(可用来分离I2与沙子、食盐晶体等)
③ I2易溶于有机溶剂。
④食盐中加入KIO3可防治甲状腺肿大。
(用于鉴定I2的存在)
→紫黑色固体,碘的蒸气呈紫色
卤素单质及其化合物的用途
1. 碘单质(I2)被用于制作碘酊(别名:碘酒)
用于一般皮肤消毒和手术前手术局部皮肤的消毒 。
2. 溴化银(AgBr)被用于制作感光胶卷和变色玻璃。
3. 碘化银(AgⅠ)被用于人工降雨
1.下列说法不正确的是( )A.HBr比HCl的还原性强B.卤素是较强的非金属元素,故其单质只有氧化性C.碘难溶于水,易溶于有机溶剂D.碘单质能使湿润的碘化钾淀粉试纸变蓝
还原性:F-> Cl- > Br- > I-
Cl2 + H2O = HCl + HClO,Cl元素既体现出氧化性,也体现出还原性
2.下列关于卤素(用X表示)的叙述中,正确的是( )A.卤素单质都可与水反应生成相应的无氧酸和含氧酸B.HX的热稳定性随卤素核电荷数增加而增强C.少量Cl2通入到NaBr和NaI的混合溶液中,Cl2优先氧化I-D.X-的还原性依次为F->Cl->Br->I-
3.氯化碘( ICl )的化学性质跟氯气相似,预计它跟水反应的最初生成物是A.HI和HClOB.HCl和HIOC.HClO3和HIOD.HClO和HIO
4.向含有NaBr和KI的混合溶液中通入过量Cl2充分反应后将溶液蒸干,并灼烧所得物质,最后剩下的物质是( )。A、NaCl和 KI B、 KCl和NaClC、 NaCl、KCl和I2D、 NaCl、 KCl、 I2和Br2
5、砹(At)原子序数85,与F、Cl、Br、I 同族,推测砹或砹的化合物不可能具有的性质是( )A、砹易溶于某些有机溶剂 B、砹能与水剧烈反应C、HAt非常不稳定 D、砹氧化性弱于碘
7.下列有关化学研究的说法正确是( )。A.酸性:B.碱性:C.依据丁达尔现象可将分散系分为溶液、胶体与浊液D.从HF、HCl、HBr、HI酸性递增的事实, 可推出F、Cl、Br、I的非金属性递增的规律
高中化学人教版 (2019)必修 第一册第二节 元素周期律集体备课课件ppt: 这是一份高中化学人教版 (2019)必修 第一册<a href="/hx/tb_c161998_t3/?tag_id=26" target="_blank">第二节 元素周期律集体备课课件ppt</a>,共34页。
化学第四章 物质结构 元素周期律第二节 元素周期律课前预习课件ppt: 这是一份化学<a href="/hx/tb_c161998_t3/?tag_id=26" target="_blank">第四章 物质结构 元素周期律第二节 元素周期律课前预习课件ppt</a>,共27页。PPT课件主要包含了二位置决定性质,问题导学,CsOH,HClO4等内容,欢迎下载使用。
人教版 (2019)必修 第一册第四章 物质结构 元素周期律第一节 原子结构与元素周期表教课课件ppt: 这是一份人教版 (2019)必修 第一册第四章 物质结构 元素周期律第一节 原子结构与元素周期表教课课件ppt,共1页。













