






课件 高考化学一轮复习第八单元 化学反应速率与化学平衡 第32讲 化学反应的方向与调控
展开第32讲 化学反应的方向与调控
考点一 化学反应的方向考点二 反应条件的调控经典真题·明考向作业手册
夯实必备知识 | 提升关键能力
考点一 化学反应的方向
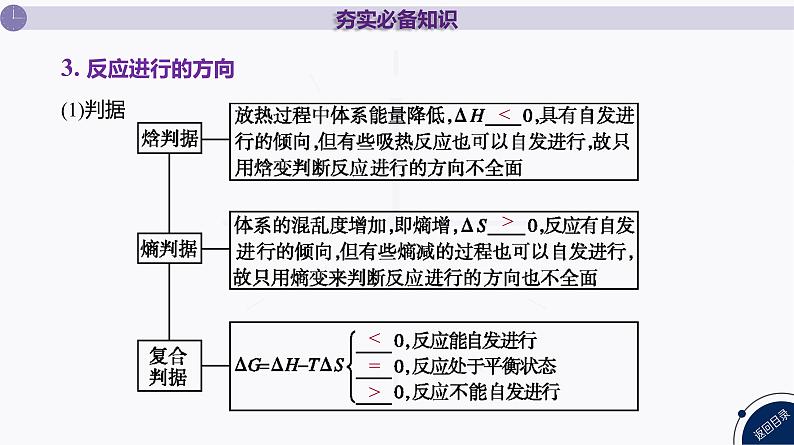
(1)含义在温度和压强一定的条件下 就能自发进行的反应称为自发反应。(2)特点①体系趋向于从 状态转变为 状态(体系对外部 或 热量)。 ②在密闭条件下,体系有从 自发地转变为 的倾向性(无序体系更加稳定)。
(1)熵是量度体系 的物理量,符号为S。 (2)影响熵大小的因素:①相同条件下,物质不同熵不同。②同一物质:S(g) S(l) S(s)。 (3)熵变(ΔS)= 的总熵- 的总熵。
(2)一般规律:①ΔH 0,ΔS 0的反应任何温度下都能自发进行; ②ΔH 0,ΔS 0的反应任何温度下都不能自发进行; ③ΔH和ΔS的作用相反,且相差不大时, 对反应的方向起决定性作用。当ΔH<0,ΔS<0时 下反应能自发进行;当ΔH>0,ΔS>0时, 下反应能自发进行。 说明:对于一个特定的气相反应,熵变的大小取决于反应前后气体物质的化学计量数的大小。
1.判断正误(正确的打“√”,错误的打“×”)(1)能自发进行的反应,一定是放热反应( )(2)同种物质不同状态时熵值不同,气态时最大( )(3)在同一条件下不同物质有不同的熵值,其体系的混乱程度越大,熵值越大( )(4)熵增的反应一定能自发进行( )
[解析] (1)吸热反应也可能自发进行。
[解析] (4)反应的自发性由焓判据和熵判据共同决定。
(5)一个反应能否自发进行取决于该反应是放热还是吸热( )(6)用焓判据或熵判据判断同一反应进行的方向其结果相同( )
[解析] (5)反应能否自发进行与ΔH、ΔS有关。
[解析] (6)用焓判据或熵判据判断同一反应进行的方向其结果不一定相同。
2.25 ℃和1.01×105 Pa时,反应:2N2O5(g) = 4NO2(g)+O2(g) ΔH=+56.7 kJ·ml-1能自发进行,其原因是 。
[解析] 根据熵判据,该反应是熵增反应,能自发进行;根据焓判据,该反应是吸热反应,不能自发进行。事实上该反应能自发进行,说明熵增效应大于能量效应。
题组 化学反应进行的方向
1.下列说法正确的是( )A.非自发反应一定不能实现B.同种物质气态时熵值最小,固态时熵值最大C.反应NH3(g)+HCl(g) = NH4Cl(s)在室温下可自发进行,则该反应的ΔH<0D.恒温恒压下,ΔH<0且ΔS>0的反应一定不能自发进行
[解析] 反应是否自发进行,由熵变、焓变、温度共同决定,非自发反应在改变条件时可以发生,A错误;熵是度量体系混乱度的物理量,同种物质熵值:气态>液态>固态,B错误;
反应能自发进行说明:ΔH-TΔS<0,由化学方程式NH3(g)+HCl(g) = NH4Cl(s)可知该反应的ΔS<0,要使ΔH-TΔS<0,必须满足ΔH<0,C正确;恒温恒压下,ΔH<0且ΔS>0的反应的ΔH-TΔS<0,反应一定可以自发进行,D错误。
2.下列有关化学反应方向及其判据的说法中错误的是( )A.1 ml H2O在不同状态时的熵值:S[H2O(l)]
[解析] 物质聚集状态不同熵值不同,气体>液体>固体,1 ml H2O在不同状态时的熵值:S[H2O(l)]
反应自发进行只能说明ΔH-TΔS<0,不能说明ΔH和ΔS的变化相同,C错误;反应物有气体物质,生成物只有固体,ΔS<0,若反应能自发进行,ΔH-TΔS<0,则ΔH必须小于0,D正确。
3.反应的焓变、熵变随温度的变化较小,假设它们不随温度变化,根据下表数据,思考回答下列问题:(1)根据表中数据可知:反应①在 温度下, 正向自发进行。
(2)有人提出采用适当的催化剂,用热分解法分解CO2,以减少CO2的排放,你认为是否可行?阐述判断的理由: 。 (3)利用综合判据,计算反应③能正向自发进行的温度范围: 。 (4)利用综合判据,计算CaCO3分解的温度条件: 。
不可行,该反应为吸热、熵减的化学反应,在任何温度下都不能正向自发进行
[解析] (1)由表中数据知,反应①2H2O2(aq) = 2H2O(l)+O2(g)的ΔH<0、ΔS>0,在任何温度下都有ΔH-TΔS<0,故反应①在任何温度下,都能正向自发进行。(2)由表中数据知,反应②CO2(g) = C(s,石墨)+O2(g)的ΔH>0、ΔS<0,在任何温度下都有ΔH-TΔS>0,所以在任何温度下都不能正向自发进行。(3)反应③的ΔH=-176 kJ·ml-1,ΔS=-285 J·ml-1·K-1,ΔH-TΔS<0,则-176 kJ·ml-1+0.285 kJ·ml-1·K-1×T<0,T<617.5 K≈344.5 ℃,即低于344.5 ℃时反应③能正向自发进行。(4)CaCO3分解的条件是ΔH-TΔS<0,代入数据178.2 kJ·ml-1-0.169 6 kJ·ml-1·K-1×T<0,解得T>1051 K≈778 ℃,即当温度高于778 ℃时,CaCO3开始分解。
【归纳总结】 四象限法判断反应能否自发进行 在温度、压强一定的条件下,反应总是向ΔG=ΔH-TΔS<0的方向进行,直至达到平衡状态。化学反应方向可归纳为如下四个方面:
考点二 反应条件的调控
1. 控制反应条件的目的
(1)促进有利的化学反应通过控制反应条件,可以 化学反应速率, 反应物的转化率,从而促进有利的化学反应进行。 (2)抑制有害的化学反应通过控制反应条件,可以 化学反应速率,减少甚至消除有害物质的产生或控制副反应的发生,从而抑制有害的化学反应继续进行。
2. 控制反应条件的基本措施
(1)控制化学反应速率的措施通过改变反应体系的 、溶液的浓度、气体的 (或浓度)、固体的 以及使用催化剂等途径调控反应速率。 (2)提高转化率的措施通过改变可逆反应体系的温度、溶液的浓度、气体的压强(或浓度)等改变可逆反应的限度,从而提高转化率。如:以工业合成氨为例,理解运用化学反应原理选择化工生产中的适宜条件
①反应原理N2(g)+3H2(g) ⇌ 2NH3(g) ΔH=-92.4 kJ·ml-1② ③从反应快慢和反应限度两个角度选择反应条件
1.判断正误(正确的打“√”,错误的打“×”)(1)合成氨反应在高温下能自发进行( )(2)温度越高越利于合成氨反应平衡正向移动( )(3)合成氨反应中,压强越大越利于反应速率加快和平衡正向移动( )(4)使用催化剂能提高合成氨反应物的平衡转化率( )
[解析] (2)合成氨反应ΔH<0,温度越低越利于平衡正向移动。
[解析] (1)合成氨反应ΔH<0、ΔS<0,ΔH-TΔS在低温下小于0。
[解析] (4)催化剂同倍数加快正、逆反应速率,对平衡转化率无影响。
2.乙烯是石油化工最基本的原料之一。(1)乙烷在一定条件下可脱氢制得乙烯:C2H6(g) ⇌ C2H4(g)+H2(g) ΔH1>0。提高乙烷平衡转化率的措施有 、 。
[解析] (1)C2H6(g) ⇌ C2H4(g)+H2(g) ΔH1>0,该反应是气体分子数增大的吸热反应,提高乙烷平衡转化率的措施有减小压强、升高温度或及时移出生成物。
升高温度(或及时移出生成物)
(2)在乙烷中引入O2可以降低反应温度,减少积碳。涉及如下反应:a.2C2H6(g)+O2(g) ⇌ 2C2H4(g)+2H2O(g) ΔH2<0b.2C2H6(g)+5O2(g) ⇌ 4CO(g)+6H2O(g) ΔH3<0c.C2H4(g)+2O2(g) ⇌ 2CO(g)+2H2O(g) ΔH4<0氧气的引入可能导致过度氧化。为减少过度氧化,需要寻找催化剂降低反应 (填“a”“b”或“c”)的活化能,判断的依据是 。
制备的目标产品是C2H4,b、c均为副反应,应加快反应a的反应速率
(3)常压下,在某催化剂作用下按照n(C2H6)∶n(O2)=1∶1投料制备乙烯,体系中C2H4和CO在含碳产物中的物质的量百分数及C2H6转化率随温度的变化如图所示。①乙烯的物质的量百分数随温度升高而降低的原因是 。
[解析] (3)①分析反应a、c都为放热反应,升高温度,两者反应平衡均逆向移动,但反应a平衡逆向移动的程度较大,则乙烯的物质的量百分数降低。
反应a、c是放热反应,升高温度,a反应平衡逆向移动程度较大
②在570~600 ℃温度范围内,下列说法正确的是 (填字母)。 A.C2H4产率随温度升高而增大B.H2O的含量随温度升高而增大C.C2H6在体系中的物质的量百分数随温度升高而增大D.此催化剂的优点是在较低温度下降低CO的平衡产率
[解析] ②根据图中信息,C2H4产率随温度升高而降低,故A错误;乙烷转化率增大,生成水的量增大,而乙烯量减小,说明发生反应c,水的量增大,因此H2O的含量随温度升高而增大,故B正确;根据图中信息C2H6转化率增大,则C2H6在体系中的物质的量百分数随温度升高而降低,故C错误;根据图中信息,CO在较高温度时含量较大,因此该催化剂的优点是在较低温度下降低CO的平衡产率,故D正确。
1.合成氨反应的正反应是气体分子数减小的放热反应。合成氨工业的生产流程如下:关于合成氨工业的说法中不正确的是( )A.混合气体进行循环利用遵循绿色化学思想B.合成氨反应须在低温下进行C.对原料气进行压缩是为了增大原料气的转化率D.使用催化剂可以提高反应的速率,但是不能使平衡向正反应方向移动
[解析] 低温虽然有利于平衡正向移动,但低温会导致反应速率降低,不利于提高生产效率, B符合题意。
2.已知:2SO2(g)+O2(g) ⇌ 2SO3 (g) ΔH=-197.8 kJ·ml-1。起始反应物为SO2和O2(物质的量之比为2∶1,且总物质的量不变)。SO2的平衡转化率(%)随温度和压强的变化如下表,下列说法不正确的是( )A.一定压强下降低温度,SO2的转化率增大B.在不同温度、压强下,转化相同物质的量的SO2所需要的时间相等C.使用催化剂可以缩短反应达到平衡所需的时间D.工业生产通常不采取加压措施是因为常压下SO2的转化率已相当高
[解析]由表格数据及勒夏特列原理知,针对放热反应,一定压强下降低温度,平衡正向移动,反应物SO2的转化率增大,A正确;由于在不同温度、压强下,化学反应速率不一定相等,故转化相同物质的量的SO2所需要的时间不一定相等,B错误;催化剂对化学平衡移动无影响,但可以缩短到达平衡所需时间,C正确;由图中数据知,不同温度下,1.01×105 Pa(常压)下SO2的转化率分别为99.2%、97.5%、93.5%,已经相当高了,且加压后转化率升高并不明显,所以没有必要通过加压提高转化率,D正确。
【归纳总结】化工生产适宜条件选择的一般原则
N2分子中N≡N键能很高,解离为N原子所需能量最多
(3)合成氨催化剂前驱体(主要成分为Fe3O4)使用前经H2还原,生成α-Fe包裹的Fe3O4。已知α-Fe属于立方晶系,晶胞参数a=287 pm,密度为7.8 g·cm-3。则α-Fe晶胞中含有Fe的原子数为 (列出计算式,阿伏伽德罗常数的值为NA)。
合成氨为气体分子数减少的反应,相同温度下,压强越大,产物氨的平衡产率越高,摩尔分数越大
[解析] (4)①由图丙可知,在温度相同时,压强从p1到p3,反应达平衡时氨的摩尔分数增大。该正反应方向气体的分子数减小,增大压强,平衡正向移动,氨的摩尔分数增大,故有p1
[解析] ②由图丙及图丁可知,在温度相同、压强相同时,图丁所示的氨的摩尔分数更低。该正反应方向气体分子数减小,恒压通入Ar,相当于减小各组分浓度,各组分分压减小,平衡逆向移动,氨的摩尔分数降低,故图丁的进料组成中含有惰性气体Ar。
2. [2022·辽宁卷节选] 工业合成氨是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖,其反应为N2(g)+3H2(g) ⇌ 2NH3(g) ΔH=-92.4 kJ·ml-1 ΔS=-200 J·K-1·ml-1。回答下列问题:(1)合成氨反应在常温下 (填“能”或“不能”)自发。
[解析] (1)对于合成氨反应,常温下,ΔG=ΔH-TΔS=-92.4 kJ·ml-1-298 K×(-0.2 kJ·K-1·ml-1)=-32.8 kJ·ml-1<0,故合成氨反应在常温下能自发进行。
(2) 温(填“高”或“低”,下同)有利于提高反应速率, 温有利于提高平衡转化率,综合考虑催化剂(铁触媒)活性等因素,工业常采用400~500 ℃。 针对反应速率与平衡产率的矛盾,我国科学家提出了两种解决方案。方案一:双温-双控-双催化剂。
[解析] (2)其他条件一定时,升高温度,可以提供更多的能量,使活化分子百分数增大,反应速率加快;合成氨反应是放热反应,要提高平衡转化率,即使平衡正向移动,应降低温度。
(3)方案二:M-LiH复合催化剂。下列说法正确的是 。 a.300 ℃时,复合催化剂比单一催化剂效率更高b.同温同压下,复合催化剂有利于提高氨的平衡产率c.温度越高,复合催化剂活性一定越高
[解析] (3)由题图可知,300 ℃时,复合催化剂催化时合成氨反应的反应速率比单一催化剂催化时大很多,说明300 ℃时复合催化剂比单一催化剂效率更高,a正确;同温同压下,复合催化剂能提高反应速率,但不能使平衡发生移动,故不能提高氨的平衡产率,b错误;温度过高,复合催化剂可能会失去活性,催化效率反而降低,c错误。
(4)某合成氨速率方程为v=kcα(N2)cβ(H2)·cγ(NH3),根据表中数据,γ= ; 在合成氨过程中,需要不断分离出氨的原因为 。 a.有利于平衡正向移动b.防止催化剂中毒c.提高正反应速率
[解析] (4)将实验1、3中数据分别代入合成氨的速率方程可得:q=k·mα·nβ·pγ,10q=k·mα·nβ·(0.1p)γ,可得γ=-1。合成氨过程中,不断分离出氨,即降低体系中c(NH3),生成物浓度降低,有利于平衡正向移动,但不会提高正反应速率,a正确,c错误;反应的生成物氨不能使催化剂中毒,b错误。
3. [2021·辽宁卷节选] 苯催化加氢制备环己烷是化工生产中的重要工艺,一定条件下, 发生如下反应:Ⅰ.主反应: (g)+3H2(g) ⇌ (g) ΔH1<0Ⅱ.副反应: (g) ⇌ (g) ΔH2>0回答下列问题:(1)已知:Ⅲ.2H2(g)+O2(g) = 2H2O(l) ΔH3Ⅳ.2 (g)+15O2(g) = 12CO2(g)+6H2O(l) ΔH4Ⅴ. (g)+9O2(g) = 6CO2(g)+6H2O(l) ΔH5则ΔH1= (用ΔH3、ΔH4和ΔH5表示)。
(2)有利于提高平衡体系中环己烷体积分数的措施有 。 A.适当升温B.适当降温C.适当加压D.适当减压(3)反应Ⅰ在管式反应器中进行,实际投料往往在n(H2)∶n(C6H6)=3∶1的基础上适当增大H2用量,其目的是 。
[解析] (2)根据主反应 (g)+3H2(g) ⇌ (g)的正反应是一个气体体积减小的反应,且为放热反应,结合勒夏特列原理,可采用适当降低温度和适当加压的方法来促进平衡正向移动,而升温和减压都将使平衡逆向移动。(3)反应Ⅰ在管式反应器中进行,实际投料往往在n(H2)∶n(C6H6)=3∶1的基础上适当增大H2用量,使平衡正向移动,从而提高苯的转化率即利用率。
(4)氢原子和苯分子吸附在催化剂表面活性中心时,才能发生反应,机理如图所示。当H2中混有微量H2S或CO等杂质时,会导致反应Ⅰ的产率降低,推测其可能原因为 。
[解析] (4)氢原子和苯分子吸附在催化剂表面活性中心时,才能发生反应,机理如题图。当H2中混有微量H2S或CO等杂质时,会导致反应Ⅰ的产率降低,推测其可能原因为金属催化剂会与H2S或CO反应从而失去催化活性。
金属催化剂会与H2S或CO反应从而失去催化活性
[解析] (1)由C3H8(g) ⇌ C3H6(g)+H2(g) ΔH1=+125 kJ·ml-1,可知反应中需要断裂2 ml C—H、形成1 ml碳碳π键和1 ml H—H,则416 kJ·ml-1×2-E(碳碳π键)-436 kJ·ml-1=+125 kJ·ml-1,解得:E(碳碳π键)=271 kJ·ml-1,所以形成1 ml碳碳π键放出的能量为271 kJ。
(2)对于反应Ⅰ,总压恒定为100 kPa,在密闭容器中通入C3H8和N2的混合气体(N2不参与反应),从平衡移动的角度判断,达到平衡后“通入N2”的作用是 ;在温度为T1时,C3H8的平衡转化率与通入气体中C3H8的物质的量分数的关系如图a所示,计算T1时反应Ⅰ的平衡常数Kp= kPa(以分压表示,分压=总压×物质的量分数,保留一位小数)。
减小气体浓度,使平衡右移,提高C3H8(g)转化率
(3)在温度为T2时,通入气体分压比为p(C3H8)∶p(O2)∶p(N2)=10∶5∶85的混合气体,各组分气体的分压随时间的变化关系如图b所示。0~1.2 s生成C3H6的平均速率为 kPa·s-1;在反应一段时间后,C3H8和O2的消耗速率比小于2∶1的原因为 。
H2和C3H6都消耗O2
(4)恒温刚性密闭容器中通入气体分压比为p(C3H8)∶p(O2)∶p(N2)=2∶13∶85的混合气体,已知某反应条件下只发生如下反应(k、k'为速率常数):反应Ⅱ:2C3H8(g)+O2(g) = 2C3H6(g)+2H2O(g) k反应Ⅲ:2C3H6(g)+9O2(g) = 6CO2(g)+6H2O(g) k'实验测得丙烯的净生成速率方程为v(C3H6)=kp(C3H8)-k'p(C3H6),可推测丙烯的浓度随时间的变化趋势为 ,其理由是 。
反应开始时,体系中主要发生反应Ⅱ,c(C3H6)逐渐增大,随着反应进行,p(C3H8)减小,p(C3H6)增大,v(C3H6)减小,体系中主要发生反应Ⅲ,c(C3H6)逐渐减小
[解析] (4)反应开始时,反应Ⅱ向右进行,c(C3H6)逐渐增大,且体系中以反应Ⅱ为主,随着反应进行,p(C3H8)减小,p(C3H6)增大,使得v(C3H6)减小,体系中以反应Ⅲ为主,因此丙烯的浓度随时间的变化趋势为先增大后减小。
考点一 化学反应的方向
[解析] 大多数放热反应能自发进行,有些吸热反应也能自发进行,A错误;电解水是在外加电场的作用下强制发生的氧化还原反应,不是自发反应,B错误;
1. 下列说法正确的是( )A.放热反应都能自发进行,吸热反应都不能自发进行B.电解水为自发反应C.反应NH3(g)+HCl(g) = NH4Cl(s)在室温下可自发进行,则该反应的ΔH>0D.W(s)+xG(g) = 2Q(g) ΔH<0,能自发进行,x可能等于1
反应能自发进行的判据是ΔH-TΔS<0,由反应方程式NH3(g)+HCl(g) = NH4Cl(s)可知,该反应的ΔS<0,要使ΔH-TΔS<0,必须满足ΔH<0,C错误;反应ΔH<0,若x为1,ΔS>0,该反应一定能自发进行,D正确。
[解析] 反应后气体分子数增大,这是一个熵增的反应,ΔS>0,A错误、C正确;熵值越大,体系混乱度就越大,B错误;同一物质三态的熵值大小关系为S(g)>S(l)>S(s),D错误。
2. 关于恒容密闭容器进行的反应C(s)+CO2(g) ⇌ 2CO(g) ΔH>0,下列说法正确的是( )A.ΔS<0B.熵值越大,体系的混乱度越小C.该反应为熵增反应D.同一物质三态的熵值大小关系为S(g)
[解析] A(s) = B(g)+C(s)为气体分子数增大的反应,ΔS>0,ΔH>0,在高温条件下能自发进行,A错误;A(g)+2B(g) = 2C(g)+3D(g)为气体分子数增大的反应,ΔS>0,所以当ΔH<0时,一定满足ΔH-TΔS<0,反应一定能够自发进行,当ΔH>0时,高温下,ΔH-TΔS<0成立,也可以自发进行,B错误;M(s)+N(g) = 2Q(s)为气体分子数减小的反应,ΔS<0,当ΔH>0时,ΔH-TΔS>0,一定不能自发进行,D错误。
[解析] 该反应为熵减的反应,且在一定温度下能自发进行,故根据ΔH-TΔS<0知,该反应属于放热反应,A错误;该反应为熵减反应,且一定温度下能自发进行,故根据ΔH-TΔS<0知,该反应属于放热反应,B错误;
4. 下列判断正确的是( )A.一定温度下,反应2A(g)+B(g) = 2C(g)能自发进行,该反应的ΔH>0B.反应4Fe(s)+3O2(g) = 2Fe2O3(s)常温下可自发进行,该反应为吸热反应C.反应N2(g)+3H2(g) ⇌ 2NH3(g)的ΔH<0,ΔS>0D.2NO(g)+2CO(g) = N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH<0
该反应为熵减反应,ΔS<0,C错误;该反应为熵减反应,且在常温下能自发进行,故根据ΔH-TΔS<0知,该反应属于放热反应,D正确。
5. 回答下列问题:(1)用钌的配合物作催化剂,一定条件下可直接光催化分解CO2,发生反应:2CO2(g) = 2CO(g)+O2(g),该反应的ΔH (填“>”“<”或“=”,下同)0,ΔS 0;在低温下,该反应 (填“能”或“不能”)自发进行。
[解析] (1)由于CO燃烧生成CO2为放热反应,则CO2分解生成CO和O2为吸热反应,ΔH>0,根据反应式可知,ΔS>0,故低温下ΔH-TΔS>0,反应不能自发进行。
(2)已知在100 kPa、298 K时石灰石分解反应CaCO3(s) = CaO(s)+CO2(g)的ΔH>0,ΔS>0,则:①该反应常温下 (填“能”或“不能”)自发进行。 ②据本题反应数据分析,温度 (填“能”或“不能”)成为反应方向的决定因素。
[解析] (2)①常温下石灰石不分解,ΔH>0,ΔS>0,ΔH-TΔS在常温下大于0,不能自发进行。②根据ΔH-TΔS<0时反应自发进行,已知ΔH>0,ΔS>0,则高温下该反应能自发进行,常温下不能自发进行,升高温度可使反应自发进行,温度能成为反应方向的决定因素。
(3)已知CaSO4(s)+CO(g) ⇌ CaO(s)+SO2(g)+CO2(g) ΔH=+218 kJ·ml-1,该反应能够自发进行的反应条件是 (填“高温”或“低温”)。
[解析] (3)根据ΔH-TΔS<0,已知该反应ΔS>0,ΔH>0,则高温时能自发进行。
6. 下图为工业合成氨的流程图,下列有关说法不正确的是( )A.步骤①中“净化”可以防止催化剂“中毒”B.步骤②中“加压”既可以提高原料的转化率,又可以增大反应速率C.步骤③④⑤均有利于提高原料的平衡转化率D.液态NH3除可生产化肥外,还可作制冷剂
[解析] 步骤①中“净化”可以除去原料气中的杂质气体,防止杂质气体降低催化剂的催化效果,A正确;合成氨反应是气体分子数减小的反应,则步骤②中“加压”可使平衡正向移动,即可提高原料转化率,增大压强,可以使反应物浓度增大,则可增大反应速率,B正确;步骤③为“催化反应”,催化剂只能改变反应速率,不能使平衡移动,故不能改变平衡转化率,C错误;氨是制备氮肥的原料,液氨汽化时吸收热量,可以作为制冷剂,D正确。
[解析] 根据勒夏特列原理结合图像知,温度升高,SO2平衡转化率下降,平衡逆向移动,说明该反应为放热反应,ΔH<0,A正确;该反应为气体分子数减小的反应,增大压强,平衡正向移动,SO2平衡转化率升高,故p1=5.0 MPa、p2=2.5 MPa、p3=0.5 MPa,B错误;由图像知,在5.0 MPa、550 ℃时的α=97.5%,C正确;压强越大反应速率越快,500 ℃时,p1比p2压强大,反应速率快,D正确。
8. 据报道,在300 ℃、70 MPa下由二氧化碳和氢气合成乙醇已成为现实:2CO2(g)+6H2(g) ⇌ CH3CH2OH(g)+3H2O(g)。下列叙述错误的是( )A.使用Cu-Zn-Fe催化剂可大大提高生产效率B.反应需在300 ℃下进行,可推测该反应一定是吸热反应C.充入大量CO2气体可提高H2的转化率D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
[解析] 使用催化剂可加快反应速率,从而提高生产效率,A正确;加热可以加快化学反应速率,放热反应也可能在加热条件下进行,由ΔG=ΔH-TΔS<0可知,该反应是放热反应,B错误;
充入大量CO2气体可使平衡正向移动,提高H2的转化率,C正确;从平衡混合气体中分离出CH3CH2OH和H2O可促使平衡正向移动,从而提高CO2和H2的利用率,D正确。
②pH<7氨氮脱除率较低的原因是 , pH>10造成氨氮脱除率随pH增大而减小的可能原因是 。
Ⅱ.氧化法(3)NO和NH3在有氧条件及催化剂作用下发生反应:4NO(g)+4NH3(g)+O2(g) ⇌ 4N2(g)+6H2O(g) ΔH<0,当温度升高到550~700 ℃时,NO转化率明显下降,NO2产率明显上升,可能原因是 。
[解析] (3)4NO(g)+4NH3(g)+O2(g) ⇌ 4N2(g)+6H2O(g) ΔH<0,当温度升高至一定范围后,平衡逆向移动,同时NH3能被O2氧化并转化为NO2,因此当温度升高到550~700 ℃时,NO转化率明显下降,NO2产率明显上升。
当温度升高到550~700 ℃时,平衡逆移,导致NO转化率下降,同时NH3在催化剂作用下与O2反应转化为NO2
10. [2023·辽宁大连育明高中模拟] “有序介孔碳”和“纳米限域催化”的研究双双获得国家自然科学奖一等奖。利用介孔限域催化温室气体CO2加氢制甲醇,再通过甲醇制备燃料和化工原料等,是解决能源问题与实现双碳目标的主要技术之一,反应如下:ⅰ.CO2(g)+3H2(g) ⇌ CH3OH(g)+H2O(g) ΔH1ⅱ.CO2(g)+H2(g) ⇌ CO(g)+H2O(g) ΔH2=+41.2 kJ·ml-1ⅲ.CO(g)+2H2(g) ⇌ CH3OH(g) ΔH3=-90.6 kJ·ml-1(1)ΔH1= 。
[解析] (1)由盖斯定律可知反应ⅰ=ⅱ+ⅲ,则ΔH1=ΔH2+ΔH3=+41.2 kJ·ml-1+(-90.6 kJ·ml-1)=-49.4 kJ·ml-1。
-49.4 kJ·ml-1
[解析] (2)随反应进行c(CO2)减小,c(CO)增加,则反应过程中c(CO2)∶c(CO)减小,当比值不变时反应达到平衡状态,故A选;反应前后气体总质量不变,容器容积恒定,则容器内气体密度始终保持不变,不能据此判断平衡状态,故B不选;
(3)将H2、CO2以体积比3∶1充入恒容密闭容器中,在某介孔限域催化剂存在下发生反应ⅰ和ⅱ。CO2的平衡转化率及CH3OH的选择性(生成目标产物所消耗的反应物的物质的量与参与反应的反应物的物质的量之比)随温度变化曲线如图所示。①CO2加氢制甲醇, 温(填“高”或“低”,下同)有利于提高反应速率, 温有利于提高平衡时CH3OH的产率。结合图像,阐述实际选用300~320 ℃反应温度的原因: 。
温度低,反应速率太慢,且CO2平衡转化率低;温度太高,甲醇的选择性低
[解析] (3)①CO2加氢制甲醇,升高温度反应速率加快,故高温有利于提高反应速率;反应ⅰ为放热反应,降温平衡正向移动,故低温有利于提高平衡时CH3OH的产率;实际选用300~320 ℃反应温度的原因为温度低,反应速率太慢,且CO2平衡转化率低;温度太高,甲醇的选择性低。
②312 ℃时反应ⅰ的Kx= 。(Kx是以组分体积分数代替物质的量浓度表示的平衡常数,列计算式)
[解析] ②由图可知312 ℃时CO2的平衡转化率为12.5%,甲醇的选择性为80%,假设初始充入H2为3 ml,CO2为1 ml,则反应ⅰ消耗CO2的物质的量为1 ml×12.5%×80%=0.1 ml,反应ⅱ消耗CO2的物质的量为1 ml×12.5%-0.1 ml=0.025 ml,则可列转化关系: CO2(g)+3H2(g) ⇌ CH3OH(g)+H2O(g)起始/ml 1 3 0 0转化/ml 0.1 0.3 0.1 0.1
2025届高考化学一轮总复习第8章化学反应速率与化学平衡第40讲化学平衡常数化学反应的方向与调控课件: 这是一份2025届高考化学一轮总复习第8章化学反应速率与化学平衡第40讲化学平衡常数化学反应的方向与调控课件,共58页。PPT课件主要包含了答案48,答案01,答案2120,混乱程度,熵的变化,自发进行,增大反应物浓度,无影响等内容,欢迎下载使用。
新教材(广西专版)高考化学一轮复习第7章第3讲化学平衡常数化学反应的方向与调控课件: 这是一份新教材(广西专版)高考化学一轮复习第7章第3讲化学平衡常数化学反应的方向与调控课件,共60页。PPT课件主要包含了内容索引,强基础增分策略,增素能精准突破,研专项前沿命题,明考向真题演练,课程标准,2掌握四个公式,针对训练,陌生图像综合考查,第二步找数据等内容,欢迎下载使用。
备战2025届新高考化学一轮总复习第7章化学反应速率与化学平衡第37讲化学反应的方向与调控课件: 这是一份备战2025届新高考化学一轮总复习第7章化学反应速率与化学平衡第37讲化学反应的方向与调控课件,共46页。PPT课件主要包含了课标指引,目录索引,素养发展进阶,必备知识•梳理,无需外界帮助,混乱度,熵的变化,自发进行,关键能力•提升,增大反应物浓度等内容,欢迎下载使用。












