











沪科技版(2020)必修第一册氧化还原反应优秀ppt课件
展开从化合价角度分析氧化还原反应的特征
从电子转移角度分析氧化还原反应的本质
1.阅读课本p53内容
氧化反应得到氧的反应
还原反应失去氧的反应
同一反应,一种物质得氧,必然有一种物质失氧!
氧化反应和还原反应在一个反应中同时发生!
CuO失去氧,发生还原反应;H2得到氧,发生氧化反应
结论:一种物质得到氧发生氧化反应,同时另一种物质失去氧发生还原反应的反应叫氧化还原反应。
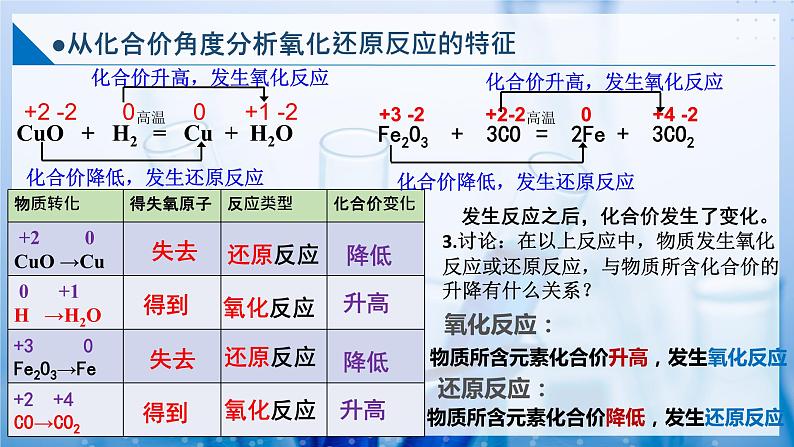
●从化合价角度分析氧化还原反应的特征
以上反应在得氧失氧的同时,元素的化合价是否发生了变化?
+2 -2 0 0 +1 -2
+3 -2 +2-2 0 +4 -2
化合价升高,发生氧化反应
化合价降低,发生还原反应
发生反应之后,化合价发生了变化。
3.讨论:在以上反应中,物质发生氧化反应或还原反应,与物质所含化合价的升降有什么关系?
物质所含元素化合价升高,发生氧化反应
物质所含元素化合价降低,发生还原反应
下列两个反应是否属于氧化还原反应,如果是,请说明理由,并说一说你对氧化还原反应有什么新的认识?
化合价升高,发生氧化反应
1、并不是所有的氧化还原反应发生氧的得失,但一定会有元素化合价变化
2、元素化合价升降是氧化还原反应的重要特征,也是判断反应是否氧化还原反应的依据。
0 +2 +2 0
0 0 +1 -1
结论:凡是有元素化合价升降的反应,都是氧化还原反应
氧化还原反应的重要特征是反应前后有元素的化合价变化。
氧化还原反应的判断依据是: 有无化合价的升降
那么,是什么原因导致元素的化合价发生变化的呢?
●从电子转移角度分析氧化还原反应的本质
化合价的变化是不是跟电子的转移有关呢?
Zn+H2SO4=ZnSO4+H2↑
以钠在氯气中燃烧、氢气在氯气中燃烧生成氯化氢为例,结合原子结构分析引起化合价变化的根本原因?
引起化合价变化的根本原因?
钠元素化合价升高,是因为钠原子_____电子,Na发生氧化反应,被氧化。
氯元素化合价降低,是因为氯原子_____电子,Cl2发生还原反应,被还原。
H2+Cl2 2HCl
氢元素化合价升高,是因为共用电子对______氢原子,H2发生氧化反应,被氧化。
氯元素化合价降低,是因为共用电子对______氯原子,Cl2发生还原反应,被还原。
结论:有电子转移(电子得失或共用电子对偏移)的反应是氧化还原反应。
——氧化还原反应的本质
化合反应、分解反应 氧化还原反应;置换反应 氧化还原反应;复分解反应 氧化还原反应;
●氧化还原反应与四种基本反应类型之间的关系
化合反应:有单质参加的是氧化还原反应;分解反应:有单质生成的是氧化还原反应;置换反应:全部是氧化还原反应;复分解反应:都是非氧化还原反应。
——表示反应前后_________由反应物转化为生成物时电子转移的情况。
正确标出反应前后各元素的化合价
明确变价元素的化合价升降关系
始于被还原的物质中的降价元素,止于产物中相应的元素
始于被氧化的物质中的升价元素,止于产物中相应的元素
标出“失去”或“得到”电子的总数
●氧化还原反应中电子转移的表示方法
箭头、箭尾必须对应化合价变化的同种元素的原子;
必须注明“得到”或“失去”;
电子转移数用a×be-形式表示,a表示发生氧化反应或还原反应的原子个数,b表示每个原子得到或失去的电子数,当a=1或b=1时,要省略;
被还原的物质和被氧化的物质得失电子数守恒。
请用双线桥法标出以下反应的电子转移:
——表示反应过程中_________原子间的电子转移情况。
Fe+2HCl===FeCl2+H2↑
始于被氧化的物质中的化合价升高的元素,止于被还原的物质中的化合价降低的元素
2Na+Cl2 2NaCl
不需要标明“得到”或“失去”,只标明电子转移数目;
要用箭头标明电子转移的方向;
箭头由反应物中失电子元素原子指向得电子元素原子。
氧化还原反应中一定有氧元素的得失( )氧化还原反应中得电子的物质发生还原反应( )氧化还原反应中所有元素的化合价都一定发生变化( )一个反应中可以只有元素化合价升高,而无元素化合价降低( )有单质参加的反应一定是氧化还原反应( )
1.请同学们认真思考并判断正误:
2.完成下列填空(1)C+H2O(g) CO+H2中发生氧化反应的物质是____,被还原的元素是_____。(2)2KClO3 2KCl+3O2↑中被氧化的元素是___,被还原的元素是____。(3)2H2S+SO2===3S↓+2H2O中被还原的物质是_____,被氧化的物质是_____,被氧化的元素是____,被还原的元素是___。(4)MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑中发生氧化反应的物质是______,发生还原反应的物质_______,被氧化的元素是_____,被还原的元素是_____。
3.氧化还原反应与四种基本反应类型的关系如图所示,下列化学反应属于阴影3区域的是( )A.2HClO 2HCl+O2↑B.NH4HCO3 NH3↑+H2O+CO2↑C.4Fe(OH)2+O2+2H2O===4Fe(OH)3D.Fe2O3+3CO 2Fe+3CO2
4.已知铜在常温下能被稀硝酸溶解,其反应的化学方程式为:3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O。(1)被氧化的元素是_____,被还原的元素是____。(2)发生氧化反应的物质是______,发生还原反应的物质是______。(3)用单线桥法表示反应电子得失的方向和数目:____________________________________________。
高中化学沪科技版(2020)必修第一册氯气的性质优质课件ppt: 这是一份高中化学沪科技版(2020)必修第一册<a href="/hx/tb_c4025822_t3/?tag_id=26" target="_blank">氯气的性质优质课件ppt</a>,文件包含212氯气的性质同步课件pptx、212氯气的性质分层练习原卷版docx、212氯气的性质分层练习解析版docx等3份课件配套教学资源,其中PPT共21页, 欢迎下载使用。
沪科技版(2020)必修第一册第1章 化学研究的天地化学中常用的实验方法物质的制备一等奖ppt课件: 这是一份沪科技版(2020)必修第一册<a href="/hx/tb_c4025812_t3/?tag_id=26" target="_blank">第1章 化学研究的天地化学中常用的实验方法物质的制备一等奖ppt课件</a>,文件包含131物质的制备同步课件pptx、131物质的制备docx等2份课件配套教学资源,其中PPT共23页, 欢迎下载使用。
化学必修第一册分散系一等奖课件ppt: 这是一份化学必修第一册<a href="/hx/tb_c4025807_t3/?tag_id=26" target="_blank">分散系一等奖课件ppt</a>,文件包含112分散系同步课件pptx、112分散系分层练习原卷版docx、112分散系分层练习解析版docx等3份课件配套教学资源,其中PPT共26页, 欢迎下载使用。













