





有机化学基础知识(提高班) 课件 2024年化学奥林匹克竞赛
展开一、有机化合物的结构特征选讲 二、有机反应类型和试剂的分类 三、两类控制反应 四、电子效应五、有机化合物酸碱的概念六、溶剂的分类及溶剂化作用
一、有机化合物的结构特征选讲
1.关于有机化合物分子中共价键形成的两种理论2.共价键的基本属性选讲3.有机化合物构造式的表示方法选讲
⑴ 价键理论 从形成共价键的电子只处于形成共价键两原子之间的定域观点出发,解决分子中原子间互相连接(成键)问题的理论是价键理论。杂化轨道理论是它的发展,这种方法处理的结果,对分子的空间形象描述得直观、清楚、容易理解,是常用的方法。
1. 关于有机化合物分子中共价键形成的两种理论
⑵ 分子轨道理论 以“形成共价键的电子是分布在整个分子之中”的离域观点为基础处理分子中原子相互连接问题的方法称为分子轨道理论。这种方法对电子离域体系描述得更为确切。多用于处理具有明显离域现象的有机分子结构,如芳环、1,3-丁二烯等共轭体系。
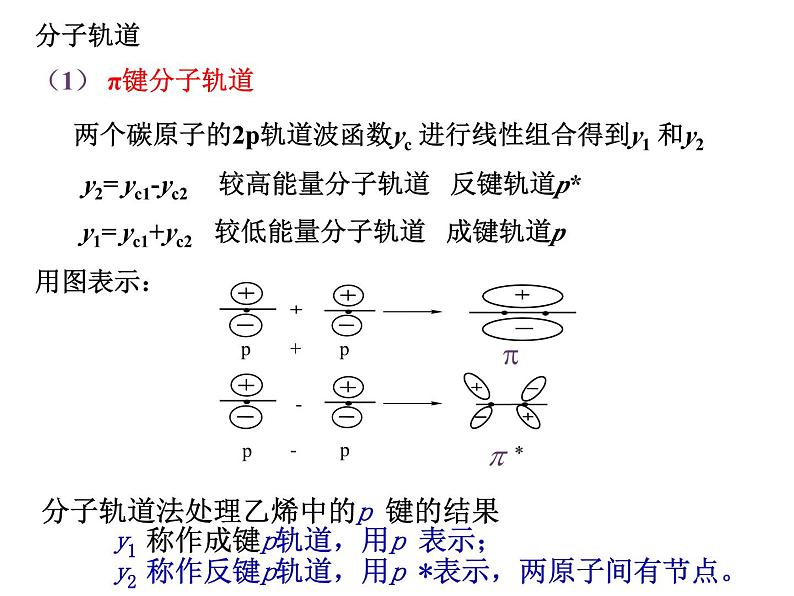
分子轨道 (1) π键分子轨道 两个碳原子的2p轨道波函数yc 进行线性组合得到y1 和y2 y2= yc1-yc2 较高能量分子轨道 反键轨道p* y1= yc1+yc2 较低能量分子轨道 成键轨道p 用图表示:
分子轨道法处理乙烯中的p 键的结果 y1 称作成键p轨道,用p 表示; y2 称作反键p轨道,用p *表示,两原子间有节点。
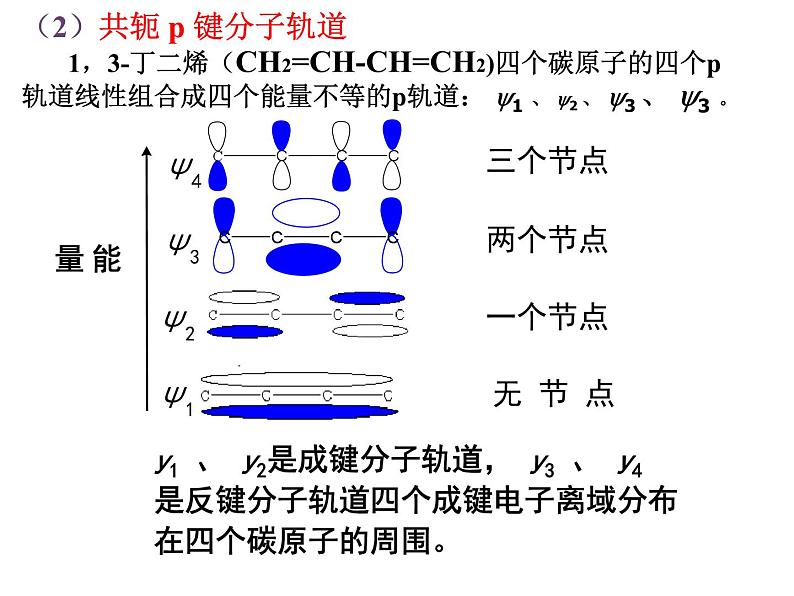
(2)共轭 p 键分子轨道 1,3-丁二烯(CH2=CH-CH=CH2)四个碳原子的四个p轨道线性组合成四个能量不等的p轨道: y1 、 y2 、 y3 、 y3 。
y1 、 y2是成键分子轨道, y3 、 y4 是反键分子轨道四个成键电子离域分布在四个碳原子的周围。
1、键长:形成共价键的两个原子核之间的距离称为键长。
d:a、b两原子的键长 r1:b原子的范德华半径 r2: b原子的共价半径 r3: a原子的共价半径 r4: a原子的范德华半径
⑵ 影响键长的因素:
① 不同原子成键,键长与原子半径有关。② 相同原子成键键长:单键 > 双键 > 三键。
③无论C—C还是C—H,键长都与C的杂化状态有关。
原子的杂化状态及分子中其它键对键长的影响
⑴ 概念 由原子形成共价键所放出的能量,或共价键断裂成两个原子所吸收的能量称为该键的键能。后者又称键的解离能。键能的单位:kJ/ml。 例1 H2(g)——2H· 吸收436.0 kJ/ml能量,即 H—H 键的键能,也称为H—H的解离能(Ed=436.0 kJ/ml表示)。
X : Y ——> X. + Y. 共价键断裂时形成共价键的两个电子平均分到形成共价键的两个原子或基团上的断裂方式称共价键的均裂。
X:Y ——> X: - + Y+ X:Y ——> X+ + Y:- 共价键断裂时,形成共价键的两个电子非均匀地分在形成共价键的两原子或基团上,形成带有一对电子的负离子和未带电子的正离子,这种断裂方式称为共价键的异裂。
例2. 甲烷分子中有四个C—H键,其解离能如下:
每一种C-H键的解离能Ed不相等。 在甲烷中C—H键的键能是各C—H键解离能的平均值: (423+439+448+347)/4=414 kJ/ml 化合物的键能数据可从手册中查到。
常见共价键的键能(单位:kJ/ml, 25C, 气相)
⑶ 注意:键能与键解离能是两个不同的概念,两者有联系又有区别,键能是分子中同种键解离能的平均值。 手册中给的键能多数是标准态(25℃,气相)值。在热力学计算时,化学键断裂吸收的能量为正值;化学键形成放出的能量为负值。
5. 键的极性和极化性
⑴ 极性键和非极性键 两个电负性不同的原子形成共价键,成键的两电子的电子云非均匀分布在两原子的周围,电负性大的原子周围有较多的电子云,电负性小的原子周围有较少的电子云,即键的两端出现微小正、负电荷,常用δ+和δ-表示,这种现象称为键的极性,这种键称为极性共价键。
如果形成共价键的两原子电负性相同,成键电子均匀分布在两原子周围,这种键无极性,称为非极性共价键。 例:H—H,Cl—Cl,CH3—CH3等。
(2)键的极化性 ① 键的极化性 在外电场作用下,共价键的极性发生变化称做键的极化性。 带电荷的试剂(分子、离子等)都可以看作外电场。例如在极性溶剂中,C—X键的极性变大,就是碳卤键的极化性。
② 用极化度来度量键的极化性 极化度反映成键两原子核电荷对共价键的电子对约束的相对程度,极化度不仅与成键原子的体积、电负性、键的种类有关,还与外电场强度有关。 碳卤键的极化度顺序: C—I > C—Br> C—Cl> C—F; C=C的极化度比C-C的大; 外电场越强(带电荷多)键的极化度越大。 成键电子和原子核都在运动中,也能使非极性键在瞬间产生极性。
1.2.4 有机化合物构造式表示法 1. 概念
分子中原子间相互连接的顺序叫分子的构造。
表示分子构造的化学式叫构造式。
⑴ 路易斯构造式:也称电子构造式。用两个圆点表示形成共价键的两个电子,放到成键两原子之间。这种表示优点是各原子的成键关系、价电子数清楚。
有机化合物构造式的表示方法选讲
⑵ 短线构造式:用一短线表示一个共价键,放在成键两原子间。其缺点是书写麻烦,占篇幅。
⑶ 缩简构造式:把成键的两原子放在一起,必要 时再用短线表示共价键,这是目前使用较为普遍的书写方法。
⑷ 键线式构造式:只表示出碳链或碳环(统称碳架或分子骨架)和除碳氢原子以外的原子或基团与碳原子连接关系,在链或环的端点、折角处表示一个碳原 子,这种方法简便,表示清楚,被普遍接受。
分子的结构除了指分子的构造外,还包括了原子在空间的排列方式,即他们的立体结构。
处于纸面上的键用实线表示,伸向纸面里面的键用虚楔形线表示,伸向纸面外面的键用实楔形线表示。
有机化合物的立体结构表达方式
2)锯架式:从C-C键轴斜45°方向看,每个碳原子上的其它三根键夹角均为120°。
3)纽曼式:从C-C键的轴线上看,前面的C原子用 表示,后面的碳原子用 表示。
4)Fischer投影式
i) 十字线交叉点表示手性碳原子;ii)主链碳放在垂直方向,氧化态高的在上端;iii)横前,竖后(左右朝前,上下朝后)。
Fischer 投影式
1H 2H 3H 1C 2C 3C 4C (伯) (仲) (叔) (季)
与一个碳原子相连的碳为一级碳原子;与二个碳原子相连的碳为二级碳原子;与三个碳原子相连的碳为三级碳原子;与四个碳原子相连的碳为四级碳原子。
正丁基 二级丁基 异丁基
甲基 乙基 正丙基 异丙基
*2 烷基的命名及英文缩写:
Me Et n-Pr i-Pr
n-Bu s-Bu i-Bu
三级丁基(叔丁基) t-Bu
二、 有机反应类型和试剂的分类
有机反应中共价键的断裂方式与反应类型有机反应中间体的概念试剂的分类
有机反应中共价键的断裂方式与反应类型
X : Y ——> X. + Y. 共价键断裂时形成共价键的两个电子平均分到形成共价键的两个原子或基团上的断裂方式称共价键的均裂。共价键均裂的反应称为均裂反应,也称为自由基型反应。
产生均裂反应的条件: ①共价键本身多数为非极性共价键如C-C,C-H键; ②光照、受热(高温)、电磁辐射等外部条件影响; ③自由基引发剂的引发
X:Y ——> X: - + Y+ X:Y ——> X+ + Y:- 共价键断裂时,形成共价键的两个电子非均匀地分在形成共价键的两原子或基团上,形成带有一对电子的负离子和未带电子的正离子,这种断裂方式称为共价键的异裂。共价键异裂的反应称为异裂反应,也称为离子型反应。
产生异裂反应的条件: ① 共价键本身多数为极性共价键,极性越强,越容易异裂 ② 催化剂的作用 ③ 多数是极性试剂作用的结果 ④ 溶剂是极性的
3. 有机反应的类型
⑴自由基型反应 ⑵离子型反应 ⑶协同反应(周环反应)
有机化学反应中间体的概念
1. 反应中间体 多数有机化学反应不是一步完成的,经过几步反应完成时,在反应过程中生成中间体。这些中间体是高度活泼的物种,很难分离出来,故又称为活性中间体,但用现代仪器可以测定出来。中间体来自共价键的均裂和异裂,如碳自由基、碳正离子,碳负离子。
2. 碳正离子 碳正离子是平面形结构,带正电荷的碳原子是sp2杂化状态
(CH3)3C+的结构
多数碳负离子是四面体结构,带负电荷的碳原子是sp3杂化状态
大多数碳自由基是平面结构,带有未配对电子的碳原子是sp2杂化状态。随着这个碳原子连接的原子或基团不同,碳原子由sp2杂化逐步转成sp3杂化,碳自由基由平面结构,经过扁平的四面体结构变成正四面体结构。
1.3.3 试剂的分类
1. 自由基试剂 在光或热作用下,能发生均裂形成自由基引起反应的试剂为自由基试剂,卤素是自由基试剂。
自由基试剂中还有一类试剂,称为自由基引发剂,在反应中加入少量自由基引发剂,反应就能引发并继续下去,这类试剂有过氧化物和偶氮化合物等: R—O—O—R R—N=N—R
在反应过程中,如果试剂从有机化合物中与它反应的那个原子获得电子对,并与之共有形成化学键,这种试剂称为亲电试剂。如:亲电试剂多数是正离子或缺电子物种。
有机化合物与亲电试剂的反应称为亲电反应。如:
在反应中,如果试剂把电子对给予有机化合物中与它反应的那个原子,并与之共有形成化学键,这种试剂称为亲核试剂。如:
-OH,-NH2,-CN,H3C-, H2O, NH3
亲核试剂多数是负离子或有孤对电子物种。有机 化合物与亲核试剂的反应称为亲核反应。如:
4. 试剂的相对性 有些试剂,如H2O可以是亲核试剂,也可以是亲电试剂,取决于反应物和反应条件。有些试剂,如Cl2,高温或光照下是自由基试剂,而在极性介质中是亲电试剂。又如HBr在有过氧化物时是自由基试剂,而在极性条件下是亲电试剂。
1 .动力学控制和热力学控制2 .广义的动力学控制
1. 动力学控制和热力学控制反应 CH2=CH—CH=CH2+HBr CH3CHBrCH=CH2 … (1) CH2=CH—CH=CH2+HBr CH3CH=CHCH2Br…(2) 反应(1)称1,3-丁二烯的1,2 -亲电加成; 反应(2)称1,3-丁二烯的1,4-亲电加成。 (1)与(2)是竞争反应
反应(3)是萘的α-H被亲电取代;反应(4)是萘的β-H被亲电取代;反应(3)与(4)是竞争反应。
1,2-加成反应活化能小,低温下反应速率决定产物组成,是动力学控制反应;
1,4-加成反应活化能大,反应速率慢,但1-溴-2-丁烯稳定,高温下,反应达到平衡,1-溴-2-丁烯是主要产物, 是热力学控制反应。 萘的α-亲电取代反应是动力学控制为主的反应;萘的β-亲电取代反应是热力学控制为主的反应。 一个平衡反应,反应远离平衡时是动力学控制,达到平衡时是热力学控制。
2. 广义的动力学控制
CH3CH2CH2CH2Br+NaOH CH3CH2CH2CH2OH+NaBr (5)CH3CH2CH2CH2Br+NaOH CH3CH2CH=CH2+H2O+NaBr(6)
(5)与(6)是竞争反应,却是非平衡反应,都是动力学控制反应。 改变反应介质,催化剂等能改变反应速率,控制反应。 水溶液中反应,主要生成醇; 醇溶液中反应,主要生成烯。 高温一有利于烯烃生成,低温有利于醇生成。
四、有机化合物酸碱的概念
在有机化学反应中酸碱的重要性质子酸碱理论电子酸碱理论质子酸碱与电子酸碱的比较
在有机化学中酸碱的重要性
⒈ 很多有机化合物是酸或碱。⒉ 许多有机化学反应是酸碱反应。⒊ 有些有机化学反应是酸或碱催化的反应。⒋ 常用酸、碱概念来说明有机化合物结构与性质的关系,分析反应机理,选择试剂、溶剂和催化剂。有机化学中常用的是质子酸碱和电子酸碱。
质子酸碱理论是布朗斯特提出来的,又称布朗斯特酸碱。
⒈ 酸:能提供质子的物种为酸。 如:HCl,CH3COOH,CH3COCH2COCH3, H2O,HSO3-,NH4+等
⒉ 碱:能接受质子的物种为碱。 如:Cl- ,CH3COO-, -OH, SO42- ,NH3等
⒊ 共轭酸碱对 酸给出质子后剩下的物种是它的共轭碱;碱接受质子后生成的物种是它的共轭酸。给出质子能力强的酸是强酸,其共轭碱是弱碱;接受质子力强的碱是强碱,其共轭酸是弱酸。利用互为共轭酸碱的强度关系,可以判断碱或酸的相对强度。例如: 判断OH-,RCH2O-和RCOO-碱性相对强度,可用它们共轭酸H2O,RCH2OH和RCOOH的强度判断。例H2O的pKa=15.7,RCH2OH的pKa=18,RCOOH的pKa=4~6。因此,酸的强度顺序为:RCOOH > H2O > ROH; 共轭碱的强度:RCH2O->HO->RCOO-。
⒋ 质子酸碱的相对性
一个给定物种,它表现出的酸碱性与介质有关系。例如:乙酸在酸性比它弱的H2O中有酸性,表现为酸,H2O是碱:
乙酸在酸性比它强的H2SO4中有碱性,表现为碱,H2SO4是酸:
酸碱反应的本质是质子转移。
电子酸碱理论是路易斯提出来的,又称路易斯酸碱。
⒈ 酸:能够接受电子对的物种是酸 如:BF3,AlCl3,H+,Ag+等 酸结构上的特点:有空的价电子轨道
⒉ 碱:能够提供电子对的物种是碱 如:NH3、H2O、ROH、RNH2、ROR、CH2=CHR、冠醚和某些芳香化合物等。 碱结构上的特点:有含电子对的元素 酸碱反应生成酸碱配合物。
有机化合物反应常用H+、BF3、AlCl3、ZnCl2、FeBr3等路易斯酸作催化剂。
下列反应能否发生,如能反应,写出产物(1)HC三CH+NaNH2(2) HC三CNa+H2O(3) HC三CNa+CH3COOH(4) HC三CNa+C2H5OH(5) HC三CH+NaCN(6) HC三CH+CH3Li
酸性:CH3COOH>HCN>H2O>C2H5OH>HC三CH>NH3>CH4
质子酸碱与电子酸碱比较
1. 质子酸碱与电子酸碱的范围是不一致的。 2. 路易斯酸的范围比质子酸的范围大。 3. 路易斯酸碱几乎包括了所有的无机化合物和有机化合物。因此路易斯酸碱又称为广义酸碱。
诱导效应共轭效应场效应电子效应的应用
存在于不同的原子形成的极性共价键中如: Xd- ← Ad+ 在多原子分子中,这种极性还可以沿着分 子链进行传递 Xd- ← Ad+ ←Bdd+ ← Cddd+ Yd+ → Ad- →Bdd- → Cddd- 由于原子或原子团电负性的影响,引起 分 子中电子云沿 σ键传递的效应称为诱导效 应。
1.定义:因分子中原子或基团的极性(电负性)不同而引起成键电子云沿着原子链向某一方向移动的效应称为诱导效应。
例如:氟代乙酸中的电子云沿σ键向氟原子移动,这是由于氟的电负性比碳强引起的。
2.特点 *电子云沿着原子链传递。 *诱导作用随着距离的增长迅速下降,一般只考虑三根键的影响。
计算含氯的碳链上原子静电荷分布情况为:
诱导效应一般是以乙酸α氢为比较标准。用I表示 Xd- ← d+CR3 H—CH2COOH Yd+ → d-CR3 标准
吸电子诱导效应(-I )
给电子诱导效应(+I)
3 .判断诱导效应大小的一般规律
(1)与碳原子直接相连的原子:同一主族的元素由上 往下电负性减弱,原子吸电子诱导效应降低; 同一周期的主族元素自左 向右电负性增强, 原子吸电子诱导效应增强。
—F > — Cl > — Br > — I
—OR > — SR
—F > — OR > — NR2 > — CR3
(2)吸电子诱导能力:炔基>烯基>烷基
即吸电子诱导效应 —C CR> — CH=CR2 > — CH2 —CR3
解释:炔基、烯基、烷基碳分别是sp 、 sp2 、 sp3杂化,杂化轨道上S轨道成分越多,吸电子能力越强。
(3)带正电荷的基团具有吸电子诱导效应, 带负电荷的基团具有给电子诱导效应。
常见的具有+I 效应的基团有:―O― > (CH3)3C― > (CH3)2CH― > CH3CH2― > CH3― > H ―
(4)液相中烷基具有给电子的诱导效应
注意:各基团的诱导效应大小不是一成不变的.常常因为所连母体化合物的不同以及取代后原子间的相互影响等一些复杂因素的存在而有所不同,因此在不同的母体化合物中他们的诱导效应的顺序不完全一样.
共轭体系:单双键交替出现的体系 或双键碳的相邻原子上有P轨道的体系
C=C–C=C–C=C
共轭效应:在共轭体系中,由于原子间的一种相互影响而使体系内的电子( 或p电子)分布发生变化的一种电子效应。
特点:共轭效应只能在共轭体系中传递;无论共轭体系有多大,共轭效应能沿共轭体系一直传递下去,不会明显减弱。
共轭效应是通过π电子(或p 电子转移)沿共轭链传递,只要共轭体系没有中断,如π-π共轭体系只要共平面,其共轭效应则一直可以沿共轭链传递至很远的距离。如:
共轭效应作用(总结) 分子中由于共轭体系的形成而引起的性质改变. (1) 键长趋向平均化. 共轭体系的形成使电子云的分布趋向平均化, 结果使共轭体系中单键键长缩短, 双键键长加长. 例: CH2=CH–CH=CH2 苯 (2) 共轭体系的能量降低, 趋于稳定. 共轭二烯烃的氢化热比孤立二烯烃要低, 说明共轭二烯烃比孤立二烯烃稳定. 而且共轭体系越大, 体系的稳定性越高. (3) 共轭效应的传递与诱导效应不同, 不因共轭链的增长而减弱. 共轭效应和诱导效应都属于电子效应.
不同基团的共轭效应以— CH=CH2为参照。用C表示
使体系π电子云密度降低的基团有吸电子共轭效应(-C)
使体系π电子云密度增高的基团有给电子共轭效应(+C)
吸电子共轭效应(-C效应)
共轭体系上能降低体系 电子云密度的基团有吸电子的共轭效应
具有-C效应的基团: ―C≡N ―NO2 ―SO3H ―COOH ―CHO ―COR ―COOR ―CONH2 ―COCl
给电子的共轭效应(+C效应)
共轭体系上能增加体系 电子云密度的基团有给电子的共轭效应
具有+C效应的基团: ―O― ―NR2 ―NHR ―NH2 ―OR ―OH ―NHCOR ―OCOR ―CH3 ―F ―Cl ―Br
给电子的共轭效应(+C效应)的强弱
―NH2 > ―OH > ―F > ―Cl > ―Br > ―I
同一周期,电负性小,共轭给电子能力强
同一主族,半径小,共轭给电子能力强
1. , -共轭体系
由π电子的离域所体现的共轭效应,称为π π - 共轭体系。
π ,π - 共轭体系的结构特征是:双键、单键、双键交替连接。组成该体系的不饱和键可以是双键,也可以是三键;组成该体系的原子也不是仅限于碳原子,还可以是氧、氮等其它原子。如:
双键相连的原子上的p轨道与π键的p轨道形成的共轭体系称做 p-π共轭体系。
(1)给电子p ,π - 共轭体系
与双键碳原子直接相连的原子上有 p 轨道,这个p 轨道与π 键的 p 轨道平行,从侧面重叠构成 p ,π - 共轭体系。如:
(2)吸电子p ,π - 共轭体系能形成 p ,π - 共轭体系的除具有未共用电子外,还有吸电子p ,π - 共轭体系。
烯丙基正离子
双键和苯环相当于电子库,当与缺电子基团连接时会供电子,与富电子基团连接时会吸电子
取代基的共轭效应和诱导效应方向有的一致,有的不一致
CH2=CH —CH=CH —CH=O
醛基:吸电子的共轭效应 吸电子的诱导效应
总的电子效应是吸电子的
CH2=CH —CH=CH —NH2
氨基:给电子的共轭效应 吸电子的诱导效应
氨基的给电子的共轭效应大于吸电子的诱导效应.总的电子效应是给电子的
CH2=CH —CH=CH —Cl
氯原子:给电子的共轭效应 吸电子的诱导效应
氯原子的给电子的共轭效应小于吸电子的诱导效应.总的电子效应是吸电子的
静态共轭效应:上面讨论的是在静止条件,由元素电负性或元素电子对引起的共轭效应称静态共轭效应。
动态共轭效应:在外电场的作用下,共轭体系产生的共轭电子沿共轭链δ-、δ+传递的电荷交替现象称做动态共轭效应。
在化学反应中,动态共轭效应作用比静态共轭效应作用大得多。
共轭效应与诱导效应比较
定义:由于碳原子与极小的氢原子结合,电子云屏蔽很小。当C-H 键与键(或P轨道)处于共轭(接近平行)位置时,电子会偏离原来的轨道趋向于轨道或p轨道,这种C-H键电子的离域现象做超共轭效应。
特点:1. 超共轭效应比共轭效应弱得多。 2. 在超共轭效应中, 键一般是给电子 的,C-H键越多,超共轭效应越大。
-CH3 > -CH2R > - CHR2 > -CR3
(1)σ-π超共轭体系:
丙烯分子中的甲基可绕C—Cσ键旋转,旋转到某一角度时,甲基中的C-Hσ键与C=C的π键在同一平面内,C-Hσ键轴与π键p轨道近似平行,形成σ-π共轭体系,称为σ-π超共轭体系。
σ,π- 超共轭体系
在超共轭体系中,电子偏转的趋向用弧型箭头表示。
(2) σ-p超共轭体系
C-H的σ键轨道与p轨道形成的共轭体系称做σ-p超共轭体系。如乙基碳正离子即为σ-p超共轭体系。
能形成σ, p - 超共轭体系的可以是碳正离子或碳自由基。
烷基碳自由基也能形成σ-p超共轭体系:
σ,π- 和σ, p -超共轭体系的共同特点是:参与超共轭的C―H σ越多,超共轭效应越强。
综上所述,在共轭体系中各种共轭效应对分子影响的相对强度是:
π ,π - 共轭> p ,π - 共轭> σ,π- 超共轭>σ, p - 超共轭
练习:请分析下列划线基团的电子效应,并用箭头表示
一、判断碳正离子的稳定性碳正离子的定义和结构 含有一个只带六个电子的带正电荷的碳氢基团
碳正离子中带正电荷的碳原子是sp2杂化,其p轨道是空的,与给电子基团相连能使电荷分散而稳定
1、烷基有给电子的诱导效应,因为sp2杂化的碳电负性强于sp3杂化的烷基碳。当烷基碳上有氢原子时,还有σ-p超共轭的给电子效应,
2、碳碳双键和苯环有p-π共轭效应,双键或苯环上的电子会离域到碳正离子的空轨道上,使碳正离子稳定
碳正离子稳定性的大致顺序
3、环上的碳形成碳正离子之后,由于环的束缚,环上的碳正离子不稳定。环越小,与sp2杂化轨道键角偏差越大,越不稳定。
4、桥头碳由于刚性,形成的碳正离子很不稳定。桥 碳原子数越少,环的刚性越大,桥头碳正离子越不稳定。
5、与小环烷基相连的碳正离子,由于小环烷烃的香蕉键会对碳正离子有很强的超共轭效应,可以很好的稳定碳正离子(与苯环相当)
练习:比较下列各组碳正离子的稳定性
碳正离子重排(Wagner-Meerwein重排)
碳正离子的一个比较特征的现象是常常会通过负氢迁移或烷基迁移来实现亲核重排.
重排的动力:一个相对不稳定的碳正离子转变为一个相对稳定的碳正离子.
通过负氢迁移, 由2 °C+ 转变为 3 ° C+
通过甲基迁移, 由2 °C+ 转变为 3 ° C+
练习:画出(CH3)3CCH2CH2转变为 (CH3)2CCH (CH3)2的反应机理
二、判断碳自由基的稳定性
碳自由基中带单电子的碳原子也是sp2杂化,能给碳自由基供电子的基团能使碳自由基稳定.
由于 C sp2的电负性大于C sp3,所以,CH3-表现出推电子诱导效应(+I)。 当C sp3杂化的电子云与C sp2杂化的电子云接近平行时,发生离域化作用,即σ-p 超共轭效应。这种离域化作用越强,σ-p 超共轭效应越显著,游离基就越容易生成,其稳定性也就越强。
用σ-p 超共轭效应解释自由基的相对稳定性
苯环和双键有给电子的p ,π - 共轭效应,能使自由基更稳定
三、判断碳负离子的稳定性
碳负离子中带负电荷的碳原子多数是sp3杂化, 连有给电子基团会使碳负离子不稳定,连有吸电子基团会使碳负离子稳定.
1.碳负离子连接的烷烃基越多越不稳定.
2.碳负离子连接苯环或双键会有部分电荷 转移到双键或苯环上,电荷分散而稳定.
同一周期的原子,从左往右,电负性增大,对电子束缚能力强,碱性降低
因此碱性:NH3 > H20 RNH2 > ROH
CH3- > NH2- > OH- > F-
同一主族的原子,从上往下,电负性减小,原子半径增大,电荷分散,碱性降低
F- > Cl- > Br- > I-
带电荷的比中性分子碱性高
OH- > H20
四、判断酸碱性大小
连有取代基的影响:连有吸电子基,会使碱性下降;连有给电子基,会使碱性增强
(1)>(3)>(2)>(4)
同一周期的原子形成的酸,从左往右,电负性增大,对 电子束缚能力强,容易失去质子形成共轭碱
酸性:CH4 < NH3 < H2O < HF
同一主族的原子形成的酸,从上往下,,原子半径增 大,电荷分散,容易失去电子形成共轭碱,酸性 增强
酸性 HF < HCl < HBr < HI RSH>ROH
酸失去质子后形成的共轭碱碱性越弱,反过来酸性就越大。
(2)连有取代基的影响:连有吸电子基,会使酸失去质子后形成的共轭碱电荷被分散,更稳定,酸性增大。连有给电子基,酸性减小
⑴ 以醋酸的H为标准判断取代基的电子性能 以取代基 X取代H原子以后,X←CH2COOH的pKa变小,X产生吸电子的诱导效应(-I效应) 称X为吸电子基,吸电子基又称拉电子基。取代基Y取代H原子后,Y→CH2COOH 的pKa变大,产生推电子的诱导效应(+I效应) 称Y为推电子基,又称给电子基或供电子基。
把取代酸的基按pKa由小到大排列顺序,即取代基吸电子能力从大到小顺序:
排在—H前面的取代基是吸电子取代基;排在—H后面的取代基是推电子取代基。具有+I效应的取代基还有少数负离子,如:—O-,—COO-。
场效应 Field effect
在微观世界中,分子与分子间、基团与基团间存在中间隙,间隙里面没有任何物质,也就是真空。因此微观世界中处处均存在真空。电场在真空中传递不会发生衰减。 若在键偶极的空间电场中,存在另一个共价键或分子,该分子或共价键就会受到键偶极的电场的作用,带正电的基团会受到与电场方向一致的静电作用力,带负电的基团会受到与电场方向相反的静电作用力。
空间电场的静电作用力,就是场效应的本质。
通过空间传递的诱导效应。 因分子中的原子或基团受到来至空间的分子内键偶极电场的影响,从而改变分子的性质的效应。
C-Cl键产生的空间电场,使羧基上的带正电的氢受到电场力的作用,作用力的方向使氢不易离开分子,酸性下降,Pka增大,比未被氯取代的分子的Pka还要大,与诱导效应的作用相反。
O-H键产生的空间电场,使另一羧基上的带正电的氢受到电场力的作用,作用力的方向使氢推离分子,酸性上升,pKa1减小。
C-O-键产生的空间电场,使另一羧基上的带正电的氢受到电场力的作用,作用力的方向使氢拉向分子,酸性下降,Pka2增大。
在溶液中,溶质被溶剂分子包围的现象称为溶剂化。 例如:氯化钠在溶液中,结构单元就是水化了的钠离子(Na+)和氯离子(Cl-),即氯化钠被水溶剂化。
2. 溶剂化的本质
一个极性溶剂分子有带部分正电荷的正端和带部分负电荷的负端,如R-O-H。正离子与溶剂的负端,负离子与溶剂的正端互相吸引,称为离子-偶极作用,也称为离子-偶极键。离子-偶极作用是溶剂化的本质。一个离子可形成多个离子-偶极键,结果离子被溶剂化,被溶剂分子包围。
质子溶剂的溶剂化作用除了离子-偶极键作用 外,往往还有氢键的作用。
稳定了离子,降低了离子的化学反应活性。 例如: 质子溶剂不仅稳定负离子,还急剧地降低 了负离子的反应活性,因为负离子的碱性及亲核 性是一致的。
路易斯碱是亲核试剂,路易斯酸是亲电试剂,两者是一致的。 质子碱的碱性强度是指与质子结合的能力,而亲核试剂的强度是指与碳反应的能力,它与亲核试剂中心原子的电子的可极化性、空间位阻等因素有关。
⒉ 相对亲核性与相对碱性
⑴在负离子系列中,如果亲核试剂的亲核中心是 相同原子时,负离子的亲核性与其碱性一致。 例如:氧为亲核中心的亲核试剂,亲核性相对 强度顺序为:RO->HO-≥RCO2-,与它们的碱性 强度RO->HO-≥RCO2-是一致的。
⑵亲核中心是元素周期表中同一族元素的原子时, 亲核性与其碱性一致。例如:R3C->R2N->RO->F-, 是负离子的亲核性顺序也是负离子碱性的顺序。
⒊ 亲核性与溶剂的关系
⑴反应使用的溶剂对试剂的亲核性有重要影响,在 质子溶剂中,亲核中心原子半径大的亲核试剂亲核性大,如S的亲核性大于O的亲核性。而碱性O>S,这是因为质子溶剂能与负离子形成氢键的原因,负离子越小,溶剂化作用越强,这个负离子作为亲核试剂去反应越困难。在质子溶剂中,一些负离子的亲核性相对强度顺序为:SH->CN->I->OH->N3->Br->CH3COO->Cl->F-。
消去反应在有机合成中的应用 (提高班) 课件 2024年化学奥林匹克竞赛: 这是一份消去反应在有机合成中的应用 (提高班) 课件 2024年化学奥林匹克竞赛,共1页。
热力学基础(提高班)课件 2024年化学奥林匹克竞赛: 这是一份热力学基础(提高班)课件 2024年化学奥林匹克竞赛,共102页。
取代反应 (提高班) 课件 2024年化学奥林匹克竞赛: 这是一份取代反应 (提高班) 课件 2024年化学奥林匹克竞赛,共60页。PPT课件主要包含了自由基取代反应,O2自由基抑制剂,氯代反应的选择性,溴代反应的选择性,反应通式,负离子型亲核试剂,分子型亲核试剂,取代反应小结,碳正离子,构型转换型反应等内容,欢迎下载使用。












