








第五单元 第一讲 化学反应与能量变化-2025年高考化学一轮复习方案课件
展开第1讲 化学反应与能量变化
1.了解化学反应中能量转化的原因及常见的能量转化形式。2.了解化学能与热能的相互转化,了解吸热反应、放热反应、反应热等概念。3.了解热化学方程式的含义,能正确书写热化学方程式。4.了解焓变(ΔH)与反应热的含义,掌握ΔH的计算。5.了解燃烧热的定义,了解中和反应反应热的测定方法。6.了解有关燃烧热、中和反应反应热的计算。
kJ·ml-1或kJ/ml
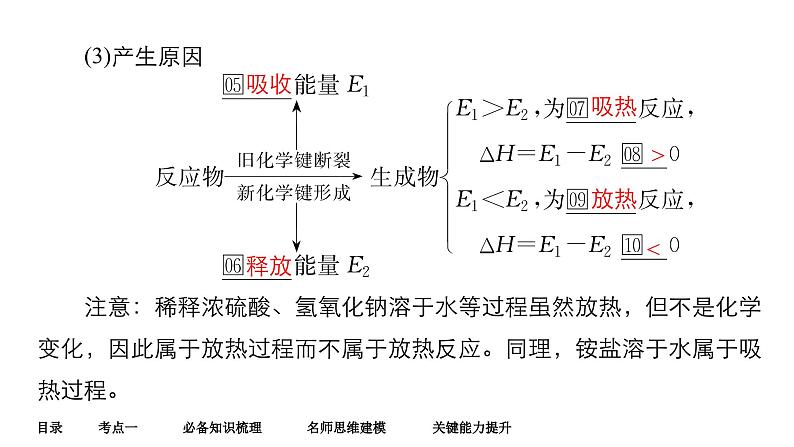
(3)产生原因注意:稀释浓硫酸、氢氧化钠溶于水等过程虽然放热,但不是化学变化,因此属于放热过程而不属于放热反应。同理,铵盐溶于水属于吸热过程。
物质的三态变化也伴有能量变化,但属于物理变化。
浓H2SO4稀释是放热过程,不是放热反应。
化学反应中能量变化的形式主要是热量变化,还有光能、电能等。
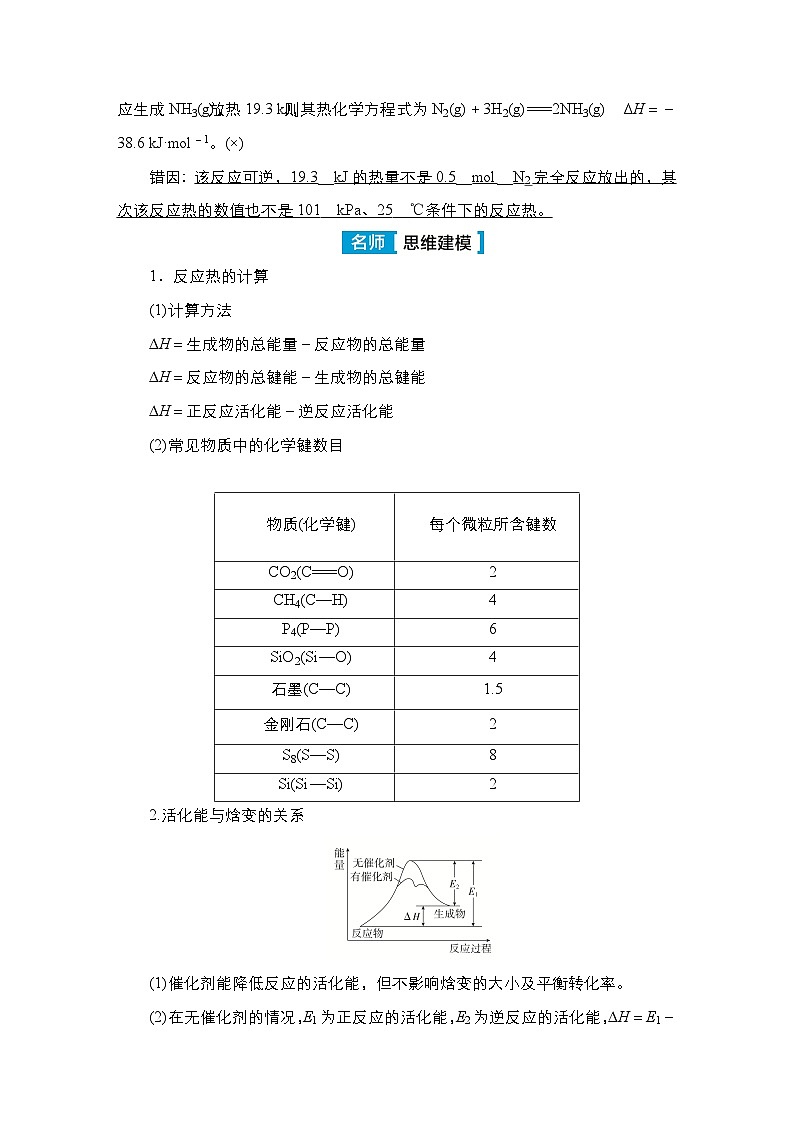
该反应可逆,19.3 kJ的热量不是0.5 ml N2完全反应放出的,其次该反应热的数值也不是101 kPa、25 ℃条件下的反应热。
燃烧都是放热反应,但也需要加热或点燃以引发反应,Ba(OH)2·8H2O与NH4Cl的反应是吸热反应,但在常温下就能发生。
1.反应热的计算(1)计算方法ΔH=生成物的总能量-反应物的总能量ΔH=反应物的总键能-生成物的总键能ΔH=正反应活化能-逆反应活化能
(2)常见物质中的化学键数目
2.活化能与焓变的关系(1)催化剂能降低反应的活化能,但不影响焓变的大小及平衡转化率。(2)在无催化剂的情况,E1为正反应的活化能,E2为逆反应的活化能,ΔH=E1-E2,活化能大小影响反应速率。(3)起点、终点能量高低决定反应的ΔH,并且物质的能量越低,物质越稳定。
角度一 理解与辨析焓变与反应热1.已知反应X+Y===M+N为吸热反应,对这个反应的下列说法中正确的是( )A.X的能量一定低于M的能量,Y的能量一定低于N的能量B.因为该反应为吸热反应,故一定要加热反应才能进行C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量D.X和Y的总能量一定低于M和N的总能量
2.下列说法中正确的是( )A.在化学反应过程中,发生物质变化的同时不一定发生能量变化B.破坏生成物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量时,该反应为吸热反应C.生成物的总焓大于反应物的总焓时,反应吸热,ΔH>0D.ΔH的大小与热化学方程式的化学计量数无关
角度二 能量图像分析与焓变的计算3.叔丁基氯与碱溶液经两步反应得到叔丁基醇,反应(CH3)3CCl+OH-―→(CH3)3COH+Cl-的能量变化与反应过程的关系如图所示。下列说法正确的是( )A.该反应为吸热反应B.(CH3)3C+比(CH3)3CCl稳定C.第一步反应一定比第二步反应快D.增大碱的浓度和升高温度均可加快反应速率
4.(1)(2023·北京卷节选)二十世纪初,工业上以CO2和NH3为原料在一定温度和压强下合成尿素。反应分两步:ⅰ.CO2和NH3生成NH2COONH4;ⅱ.NH2COONH4分解生成尿素。结合反应过程中能量变化示意图,下列说法正确的是________(填序号)。a.活化能:反应ⅰ<反应ⅱb.ⅰ为放热反应,ⅱ为吸热反应c.CO2(l)+2NH3(l)===CO(NH2)2(l)+H2O(l)ΔH=E1-E4
由反应物A转化为生成物C,需经过两步反应,其反应过程与能量变化如下图所示:(1)E3>E1,即第二步决定化学反应速率。(2)能量越低越稳定,稳定性:C>A>B。(3)该反应的反应热为E1-E2+E3-E4。
考点二 热化学方程式
1 ml液态水时放出285.8 kJ的热量
3.热化学方程式的书写方法
可逆反应的ΔH表示物质完全反应时的热效应,与化学平衡的移动无关。
热化学方程式前面的化学计量数只表示物质的量,不表示分子数。
反应热的单位应该是kJ·ml-1。
焓变只与反应的始态,终态有关,与反应条件无关。
1.书写热化学方程式的注意事项(1)热化学方程式不标“↑”“↓”,但必须用s、l、g、aq等标出物质的聚集状态。(2)热化学方程式的化学计量数表示物质的量,可以是整数,也可以是分数,其ΔH必须与化学方程式及物质的聚集状态相对应。(3)ΔH应包括“+”或“-”、数值和单位(kJ·ml-1)。(4)正、逆反应ΔH的数值相等、符号相反。
2.“五审”突破热化学方程式的正误判断
角度二 分析与应用热化学方程式的书写3.(1)1.6 g液态化合物N2H4与液态H2O2恰好完全反应生成两种对环境友好的气体,此时放出75 kJ的热量,请写出该反应的热化学方程式:______________________________________________________。(2)已知:①中和反应反应热为57.3 kJ·ml-1;②Ba2+(aq)+SO(aq)===BaSO4(s) ΔH=-a kJ·ml-1(视a为已知数)。请写出稀硫酸与稀Ba(OH)2溶液反应的热化学方程式:____________________________________________________________________
N2H4(l)+2H2O2(l)===N2(g)+4H2O(g) ΔH=-1500 kJ·ml-1
H2SO4(aq)+Ba(OH)2(aq)===BaSO4(s)+2H2O(l) ΔH=-(a+114.6) kJ·ml-1
4.热化学方程式中的ΔH实际上是热力学中的一个物理量,叫做焓变,其数值和符号与反应物和生成物的总能量有关,也与反应物和生成物的键能有关。(1)图甲表示的是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:______________________________________________________________________________。
NO2(g)+CO(g)===NO(g)+CO2(g) ΔH=-234 kJ·ml-1
(2)图乙表示氧族元素中的氧、硫、硒、碲在生成1 ml气态氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素,试写出硒化氢在热力学标准态下,发生分解反应的热化学方程式:______________________________________________________。
H2Se(g)===Se(s)+H2(g) ΔH=-81 kJ·ml-1
5.CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、101 kPa下,已知该反应每消耗1 ml CuCl(s),放热44.4 kJ,该反应的热化学方程式是_____________________________________________________________________________________________。
4CuCl(s)+O2(g)===2CuCl2(s)+2CuO(s) ΔH=-177.6 kJ·ml-1
考点三 燃烧热与中和反应的反应热 能源
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·ml-1
(2)实验装置(3)注意事项①为保证酸、碱完全中和,常使碱稍稍过量(0.5 ml·L-1 HCl、0.55 ml·L-1 NaOH溶液等体积混合)。②实验时不能用铜丝搅拌棒代替玻璃搅拌器,因为铜丝导热性好,比用玻璃搅拌器误差大。③隔热层及杯盖的作用是保温、隔热,减少热量损失。
1 ml H2O(l)
H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·ml-1
3.能源(1)能源分类
(2)解决能源问题的措施①提高能源的利用效率:a.改善开采、运输、加工等各个环节;b.科学控制燃烧反应,使燃料充分燃烧。②开发新能源:开发资源丰富、可以再生、没有污染或污染很小的新能源。
判断下列说法的正误,并指出错误说法的错因。(1)根据2H2(g)+O2(g)===2H2O(l) ΔH=-571 kJ·ml-1可知氢气的燃烧热为571 kJ·ml-1。( )错因:_________________________________________________(2)已知稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·ml-1,则稀醋酸与稀氢氧化钠溶液反应生成1 ml水时放出57.3 kJ的热量。( )错因:________________________________________________
燃烧热是以1 ml可燃物为标准。
醋酸电离要吸收热量,放出的热量小于57.3 kJ。
该反应生成BaSO4沉淀也有热效应
天然气不是可再生能源。
理解燃烧热和中和反应的反应热(1)有关燃烧热的判断,一看是否以1 ml可燃物为标准,二看是否生成指定产物。物质完全燃烧生成的指定产物示例:H―→H2O(l),C―→CO2(g),S―→SO2(g),N―→N2(g)。(2)中和反应的实质是H+和OH-反应生成H2O。①若反应过程中有其他物质生成(如生成不溶性物质,难电离物质等),这部分反应热不在中和反应反应热之内。
②若用浓溶液或固体,还有溶解热,放出热量增多。③若用弱酸代替强酸(或弱碱代替强碱),由于弱酸或弱碱电离要吸热,则放出热量减小。(3)当用热化学方程式表示中和反应反应热时,生成H2O(l)的物质的量必须是1 ml。
2.金刚石和石墨均为碳的同素异形体,它们燃烧时,若氧气不足生成一氧化碳,若充分燃烧生成二氧化碳,反应中放出的热量如图所示。
(1)等质量的金刚石和石墨完全燃烧,________(填“金刚石”或“石墨”)放出的热量更多,写出表示石墨燃烧热的热化学方程式:________________________________________________。(2)在通常状况下,________(填“金刚石”或“石墨”)更稳定,写出石墨转化为金刚石的热化学方程式: ________________________________________________________。(3)12 g石墨在一定量空气中燃烧,生成气体36 g,该过程中放出的热量为________。
C(石墨,s)+O2(g)===CO2(g) ΔH=-393.5 kJ·ml-1
C(石墨,s)===C(金刚石,s) ΔH=+1.9 kJ·ml-1
角度二 应用与创新中和反应反应热的测定3.在测定中和反应反应热的实验中,下列说法正确的是( )A.使用玻璃搅拌器是为了加快反应速率,减小实验误差B.为了准确测定反应混合溶液的温度,实验中温度计的水银球应与小烧杯底部接触C.用0.5 ml·L-1 NaOH溶液分别与0.5 ml·L-1的盐酸、醋酸溶液反应,若所取的溶液体积相等,则测得的反应热数值相同D.在测定中和反应反应热实验中需要使用的仪器有容量瓶、量筒、温度计、玻璃搅拌器
4.利用如图所示装置测定中和反应反应热的实验步骤如下:①用量筒量取50 mL 0.50 ml·L-1盐酸,打开杯盖,倒入量热计的内筒中,盖上杯盖,插入温度计,测出盐酸温度;②用另一量筒量取50 mL 0.55 ml·L-1 NaOH溶液,并用同一温度计(已洗净擦干)测出其温度;③打开杯盖,将NaOH溶液倒入量热计的内筒中,立即盖上杯盖,设法使之混合均匀,测得混合液的最高温度。
回答下列问题:(1)为什么所用NaOH溶液要稍过量?______________________。(2)倒入NaOH溶液的正确操作是________(填字母,下同)。A.沿玻璃棒缓慢倒入 B.分三次倒入C.一次迅速倒入
(3)使盐酸与NaOH溶液混合均匀的正确操作是________。A.用温度计小心搅拌B.揭开杯盖用玻璃棒搅拌C.轻轻地振荡烧杯D.用套在温度计上的玻璃搅拌器轻轻地搅动(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 ml·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为________________。
ΔH1=ΔH2<ΔH3
(5)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和反应反应热,某学生实验记录数据如下:
依据该学生的实验数据计算,该实验测得的中和反应反应热ΔH=________________(结果保留一位小数)。(6)________(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是________________________________________________________________________________。
-51.8 kJ·ml-1
H2SO4与Ba(OH)2反应生成BaSO4沉淀,沉淀的生成热会影响中和反应反应热的测定结果
中和反应反应热的测定实验中的注意事项(1)实验所用的酸和碱溶液应为稀溶液,否则会造成较大误差。(2)量取酸溶液和碱溶液时,应当分别使用两个量筒量取。(3)使用同一支温度计分别先后测量酸、碱溶液及混合液的最高温度,测完一种溶液后必须用水冲洗干净并用滤纸擦干后再测另一种溶液的温度。(4)取多次实验终止温度(t2)和起始温度(t1)温度差的平均值代入公式计算,计算时应注意单位的统一。
2.(2023·浙江1月选考)标准状态下,气态反应物和生成物的相对能量与反应历程示意图如下[已知O2(g)和Cl2(g)的相对能量为0],下列说法不正确的是( )A.E6-E3=E5-E2B.可计算Cl—Cl键能为2(E2-E3) kJ·ml-1C.相同条件下,O3的平衡转化率:历程Ⅱ>历程ⅠD.历程Ⅰ、历程Ⅱ中速率最快的一步反应的热化学方程式为ClO(g)+O(g)===O2(g)+Cl(g) ΔH=(E5-E4) kJ·ml-1
4.(2022·浙江6月选考)标准状态下,下列物质气态时的相对能量如下表:
可根据HO(g)+HO(g)===H2O2(g)计算出H2O2中氧氧单键的键能为214 kJ·ml-1。下列说法不正确的是( )A.H2的键能为436 kJ·ml-1B.O2的键能大于H2O2中氧氧单键的键能的两倍C.解离氧氧单键所需能量:HOO
②该盐酸浓度为________ml·L-1。(2)热量的测定:取上述NaOH溶液和盐酸各50 mL进行反应,测得反应前后体系的温度值(℃)分别为T0、T1,则该过程放出的热量为___________J(c和ρ分别取4.18 J·g-1·℃-1和1.0 g·mL-1,忽略水以外各物质吸收的热量,下同)。
418(T1-T0)
(3)借鉴(2)的方法,甲同学测量放热反应Fe(s)+CuSO4(aq)=== FeSO4(aq)+Cu(s)的焓变ΔH(忽略温度对焓变的影响,下同)。实验结果见下表。①温度:b________c(填“>”“<”或“=”)。②ΔH=________________________________________(选择表中一组数据计算)。结果表明,该方法可行。
-20.9(b-a) kJ·ml-1或-41.8(c-a) kJ·ml-1
6.(2022·海南高考节选)某空间站的生命保障系统功能之一是实现氧循环。回答问题:(1)已知:电解液态水制备1 ml O2(g),电解反应的ΔH=+572 kJ·ml-1。由此计算H2(g)的燃烧热(焓)ΔH=________ kJ·ml-1。
课时作业[建议用时:40分钟]
一、选择题(每小题只有1个选项符合题意)1.下列既属于氧化还原反应,又属于吸热反应的是( )A.铝片与稀盐酸反应B.Ba(OH)2·8H2O与NH4Cl的反应C.灼热的炭与水蒸气的反应D.甲烷(CH4)在O2中的燃烧反应
2.十氢萘是具有高储氢密度的氢能载体,经历“十氢萘(C10H18)→四氢萘(C10H12)→萘(C10H8)”的脱氢过程释放氢气。已知:Ⅰ.C10H18(l)===C10H12(l)+3H2(g) ΔH1Ⅱ.C10H12(l)===C10H8(l)+2H2(g) ΔH2假设某温度下,ΔH1>ΔH2>0。下列“C10H18→C10H12→C10H8”的“能量-反应过程”示意图正确的是( )
4.(2023·北京市朝阳区高三期末质量检测)已知某些化学键键能如下,下列说法不正确的是( ) A.根据键能可估算反应H2(g)+Cl2(g)===2HCl(g)的ΔH=-185 kJ·ml-1B.根据原子半径可知键长:H—Cl
7.(2023·黄冈市高三质量抽测)《丁烯双键异构化的方法》获得了第二十届中国专利优秀奖。在100 kPa和298 K下,丁烯双键异构化反应的机理如图所示。下列说法错误的是( )
11.(2023·湖北重点中学高三联考)以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图所示。下列说法正确的是( )
A.过程①中钛氧键断裂会释放能量B.CO2分解反应的热化学方程式为2CO2(g)===2CO(g)+O2(g) ΔH=+30 kJ·ml-1C.使用TiO2作催化剂可以降低反应的焓变,从而提高化学反应速率D.该反应中,光能和热能转化为化学能
12.依据事实,写出下列反应的热化学方程式。(1)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下2 g SiH4自燃放出热量89.2 kJ。SiH4自燃的热化学方程式为___________________________________________________________________________________________________________。(2)已知拆开1 ml H—H键、1 ml N—H键、1 ml N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为_________________________________________________。
SiH4(g)+2O2(g)===SiO2(s)+2H2O(l) ΔH=-1427.2 kJ·ml-1
(3)在25 ℃、101 kPa下,一定质量的无水乙醇完全燃烧时放出热量Q kJ,其燃烧生成的CO2用过量饱和石灰水吸收可得100 g CaCO3沉淀,则乙醇燃烧的热化学方程式为___________________________________________________________________________________。
C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=-2Q kJ·ml-1
(4)(2023·重庆卷节选)银及其化合物在催化与电化学等领域中具有重要应用。在银催化下,乙烯与氧气反应生成环氧乙烷(EO)和乙醛(AA)。根据下图所示,回答下列问题:①中间体OMC生成吸附态EO(ads)的活化能为________kJ/ml。②由EO(g)生成AA(g)的热化学方程式为____________________________________________________________。
EO(g)===AA(g) ΔH=-102 kJ/ml
+123 kJ·ml-1
使用更高效的催化剂或增大催化剂比表面积
第四单元 第一讲 碳、硅及无机非金属材料-2025年高考化学一轮复习方案课件: 这是一份第四单元 第一讲 碳、硅及无机非金属材料-2025年高考化学一轮复习方案课件,文件包含第1讲ppt、第1讲doc等2份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
第三单元 第一讲 钠及其化合物-2025年高考化学一轮复习方案课件: 这是一份第三单元 第一讲 钠及其化合物-2025年高考化学一轮复习方案课件,文件包含第1讲ppt、第1讲doc等2份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
第二单元 第一讲 物质的量 气体摩尔体积-2025年高考化学一轮复习方案课件: 这是一份第二单元 第一讲 物质的量 气体摩尔体积-2025年高考化学一轮复习方案课件,文件包含第1讲ppt、第二单元第1讲物质的量气体摩尔体积doc等2份课件配套教学资源,其中PPT共60页, 欢迎下载使用。












