









第八单元 第一讲 原电池 化学电源-2025年高考化学一轮复习方案课件
展开第1讲 原电池 化学电源
1.以原电池为例认识化学能可以转化为电能,从氧化还原反应的角度认识原电池的工作原理,设计简单原电池。2.能正确判断原电池的两极,正确书写电极反应式和总反应方程式。3.了解常见的化学电源,能利用相关信息分析化学电源的工作原理,并能书写几种新型电池的电极反应式。4.能综合考虑化学变化中的物质变化和能量变化来分析、解决实际问题,如新型电池的开发等。
考点一 原电池的工作原理及应用
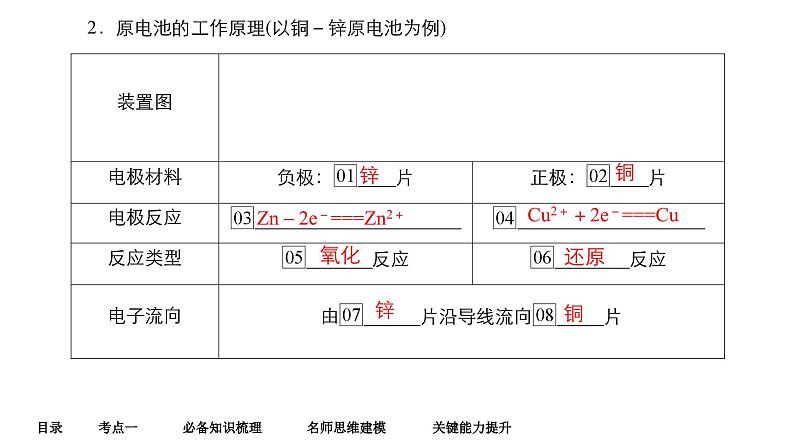
Zn-2e-===Zn2+
Cu2++2e-===Cu
Zn+Cu2+===Zn2++Cu
电子不能通过电解质溶液。
原电池中,阳离子移向正极。
较活泼的金属不一定作负极,如:MgNaOHAl形成的原电池,铝作负极。
加入少量CuSO4后,Fe与Cu2+反应生成Cu,可以形成CuFe原电池,反应速率加快。
自发进行的氧化还原反应才能设计成原电池。
原电池工作原理模型图注意:①若有盐桥,盐桥中的阴离子移向负极区,阳离子移向正极区。②电子不能通过电解质溶液,溶液中的离子不能通过盐桥和导线(即电子不下水,离子不上岸)。③负极失去电子总数一定等于正极得到电子总数。
考点二 化学电源
Zn+2OH--2e-===Zn(OH)2
2MnO2+2H2O+2e-===2MnO(OH)+2OH-
Ag2O+H2O+2e-===2Ag+2OH-
LixCy-xe-===xLi++Cy
Li1-xCO2+xLi++xe-===LiCO2
2H2-4e-===4H+
2H2-4e-+4OH-===4H2O
O2+4e-+4H+===2H2O
O2+4e-+2H2O===4OH-
MnO2是正极反应物。
手机、电脑中使用的锂电池可以充、放电,属于二次电池。
放电时,正、负极的质量均增加。
碱性介质中,负极反应为H2-2e-+2OH-===2H2O。
正极O2得电子,电极反应式为O2+4e-+2CO2===2CO。
充电时二次电池的负极连接电源的负极,即作电解池的阴极,得电子,发生还原反应。
1.化学电源电极反应式的书写书写电极反应式时,首先要根据原电池的工作原理准确判断正、负极;然后结合电解质溶液的环境确定电极产物;最后再根据质量守恒和电荷守恒写出反应式。电极反应式书写的一般方法有:(1)拆分法①写出原电池的总反应,如2Fe3++Cu===2Fe2++Cu2+。
课时作业[建议用时:40分钟]
CH3OH-6e-+H2O===CO2↑+6H+
使用时间长、工作电压稳定
氯化铵(或NH4Cl)
2024届高考化学一轮复习原电池化学电源课件: 这是一份2024届高考化学一轮复习原电池化学电源课件,共35页。PPT课件主要包含了考点二化学电源,链接高考等内容,欢迎下载使用。
2024年高考化学一轮复习原电池化学电源课件: 这是一份2024年高考化学一轮复习原电池化学电源课件,共1页。
人教版高考化学一轮复习6.2原电池化学电源课件: 这是一份人教版高考化学一轮复习6.2原电池化学电源课件












