





模块1 主题2 第2讲 氧化还原反应 课件 2025高考化学一轮复习
展开1. 知道氧化还原反应的本质是电子的转移,认识常见的氧化剂、还原剂。2. 能判断氧化剂、还原剂、氧化产物、还原产物,理解物质被氧化、被还原的概念。3. 能通过化合价变化规律判断某些陌生氧化还原反应的产物。4. 会用单线桥、双线桥表示电子转移的方向和数目。
1. 判断下列反应是否为氧化还原反应(请在后面的括号中用“”或“”表示)。若为氧化还原反应,用单线桥或双线桥标出电子转移的方向和数目,并指出氧化剂、还原剂、氧化产物、还原产物。
活动一 氧化还原反应的本质
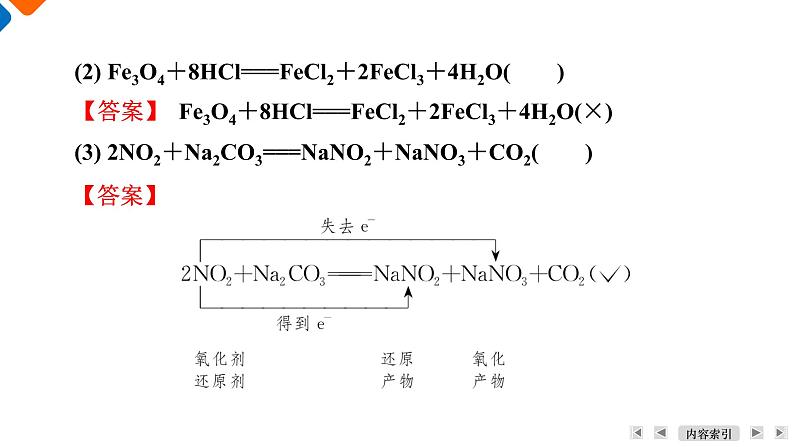
(2) Fe3O4+8HCl===FeCl2+2FeCl3+4H2O( )
【答案】 Fe3O4+8HCl===FeCl2+2FeCl3+4H2O(×)
(3) 2NO2+Na2CO3===NaNO2+NaNO3+CO2( )
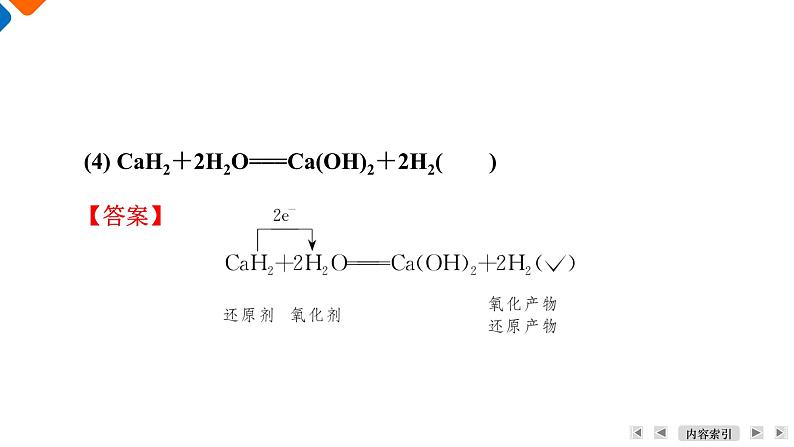
(4) CaH2+2H2O===Ca(OH)2+2H2( )
2. 通过上述分析,你认为氧化还原反应的最佳判据是什么?
【答案】 通过是否有化合价的升降判断是否是氧化还原反应。
1. 氧化剂、还原剂的分类。回忆所学元素化合物知识,将常见氧化剂、还原剂按下列标准进行分类。
活动二 常见氧化剂、还原剂
H+、Ag+、Fe3+、Cu2+等
某些氧化物:MnO2、NO2、H2O2、Na2O2等;氧化性酸:浓硫酸、硝酸;某些盐:KMnO4、KClO3、FeCl3等
Na、Mg、Al、Zn等
某些氧化物:CO、SO2;还原性酸:HCl、H2S;某些盐:Na2S,FeCl2等
通常能将Fe2+氧化为Fe3+的物质称为强氧化剂。能够实现Fe2+―→Fe3+的强氧化剂有____________________________。能够实现Cl-―→ Cl2的强氧化剂有__________________________________________。
O2、H2O2、浓硝酸、Cl2
KMnO4、MnO2、K2Cr2O7、KClO3、Ca(ClO)2
2. 物质氧化性、还原性强弱的比较。物质氧化性、还原性强弱的实质是物质得失电子的难易。其判断方法通常有以下几种,请你根据提示,对有关物质氧化性、还原性的强弱进行判断(用“>”或“<”表示),并分别归纳出你判断的一般规律。(1) 根据金属活动性顺序判断。比较下列各组物质氧化性、还原性的强弱。①还原性:Mg______Fe、Ag______Cu。②氧化性:Cu2+______Fe2+、H+______Zn2+。
【答案】 一般规律:金属活动性越强,金属单质的还原性越强;对应阳离子(注意:Fe对应阳离子为Fe2+)的氧化性越弱。
(2) 根据元素周期律判断。比较下列各组物质氧化性、还原性的强弱。①还原性:Mg______Ba、Al______K。②氧化性:F2________O2、Cl2________I2。
【答案】 一般规律:在元素周期表中,同一周期从左到右单质的氧化性依次增强,还原性依次减弱;同一主族从上到下单质的氧化性依次减弱,还原性依次增强。
(3) 根据化学方程式判断。臭氧能迅速使淀粉-KI试液变蓝,反应式:KI+O3+H2O―→KOH+I2+O2(未配平)。长期放置的KI溶液遇淀粉也能显蓝色,反应式:KI+O2+H2O―→KOH+I2(未配平)。写出氧气、臭氧、碘的氧化性由强到弱的顺序。
【答案】 O3>O2>I2 一般规律:氧化剂的氧化性强于氧化产物的氧化性,还原剂的还原性强于还原产物的还原性。
(4) 已知氧化性:HNO3>Fe3+>I2,下列反应不能发生的是________(填序号,下同)。
(5) 已知还原性:S2-> I-> Fe2+>Cl-,下列反应不能发生的是________。①Cl2+S2-===S+2Cl-②Cl2+2FeCl2===2FeCl3③S+2I-===I2+S2-
3. 酸碱性对氧化性的影响。
4. 氧化产物、还原产物的判断。氧化产物、还原产物是从实验得出的。对于一些我们不熟悉的氧化还原反应,可以根据化合价变化的规律,分析氧化产物、还原产物。下表中给出的氧化剂与还原剂所发生的反应均在酸性条件下进行,你认为哪些产物理论上是可以确定的,将其化学式写出来,不能确定的在空格中注明。
氧化还原反应中,氧化反应与还原反应总是同时发生的。一个完整的氧化还原反应方程式可以拆写成两个“半反应”,一个是“氧化反应”,一个是“还原反应”。如2Fe3++Cu===2Fe2++Cu2+的拆写结果:氧化反应为Cu-2e-===Cu2+;还原反应为2Fe3++2e-===2Fe2+。试将下列离子反应拆写为两个“半反应”式。
活动三 氧化反应与还原反应的关系
NO2+2e-+2H+===NO+H2O
4H2O+2O2+8e-===8OH-
1 (2023全国乙卷)下列应用中涉及氧化还原反应的是( )A. 使用明矾对水进行净化B. 雪天道路上撒盐融雪C. 暖贴中的铁粉遇空气放热D. 荧光指示牌被照发光
【解析】 明矾净水是明矾中的铝离子水解生成氢氧化铝胶体,不涉及氧化还原反应,A错误;撒盐是为了降低溶液凝固点,是物理变化,B错误;暖贴中铁粉发生原电池反应,涉及氧化还原反应,C正确;荧光指示牌被照发光,是因为光被指示牌反射,不涉及化学变化,D错误。
2 (江苏卷)黑火药是中国古代四大发明之一,其爆炸反应为2KNO3+S+3C===K2S+N2↑+3CO2↑。下列说法正确的是( )A. 黑火药中含有两种单质B. 爆炸时吸收热量C. 反应中S作还原剂D. 反应为置换反应
3 (2023广东卷)按图装置进行实验。将稀硫酸全部加入Ⅰ中的试管,关闭活塞。下列说法正确的是( )A. Ⅰ中试管内的反应,体现H+的氧化性B. Ⅱ中品红溶液褪色,体现SO2的还原性C. 在Ⅰ和Ⅲ的试管中,都出现了浑浊现象D. 撤掉水浴,重做实验,Ⅳ中红色更快褪去
4 (2023湖南卷)油画创作通常需要用到多种无机颜料。研究发现,在不同的空气湿度和光照条件下,颜料雌黄(As2S3)褪色的主要原因是发生了以下两种化学反应。
下列说法正确的是( )
5 某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。(1) 请将除Au2O3之外的反应物与生成物分别填入以下空格内。(2) 反应中,被还原的元素是________,还原剂是__________。
【答案】 Na2S2O3 H2O Na2S4O6 Au2O NaOH(前2空顺序任意,后3空顺序任意)
(3) 将氧化剂与还原剂的化学式及配平后的系数填入下列方框中,并标出电子转移的方向和数目。(4) 纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为________。
6 某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。(1) 已知KBrO3在反应中得到电子,则该反应的还原剂是_______。(2) 已知0.2 ml KBrO3在反应中得到1 ml e-生成X,则X的化学式为________。
(3) 将氧化剂和还原剂的化学式及配平后的系数填入下列方框中,并标出电子转移的方向和数目。
模块1 主题1 第1讲 物质的组成、结构与分类 课件 2025高考化学一轮复习: 这是一份模块1 主题1 第1讲 物质的组成、结构与分类 课件 2025高考化学一轮复习,共31页。PPT课件主要包含了学习目标,活动方案,高沸点酸,低沸点酸挥发性酸,链接真题等内容,欢迎下载使用。
2025届高考化学一轮总复习第1章物质及其变化第4讲氧化还原反应的基本概念和规律课件: 这是一份2025届高考化学一轮总复习第1章物质及其变化第4讲氧化还原反应的基本概念和规律课件,共42页。PPT课件主要包含了Mn2+,Cr3+,NO或NO2,SO2,Cl-,Fe2+或Fe,Zn2+,CO2,Fe3+,H2O等内容,欢迎下载使用。
2025版高考化学一轮总复习第1章化学物质及其变化第4讲氧化还原反应的概念和规律课件: 这是一份2025版高考化学一轮总复习第1章化学物质及其变化第4讲氧化还原反应的概念和规律课件,共60页。PPT课件主要包含了MnO2,HCl,Cl2,mol,还原性,失电子,得电子,O2F2,H2S,SF6等内容,欢迎下载使用。












