






模块2 主题1 第2讲 铝及其化合物 课件 2025高考化学一轮复习
展开1. 了解铝与氧气、酸、碱溶液反应的情况。2. 了解氧化铝与酸、碱溶液反应的情况。3. 了解氢氧化铝的制备方法;了解氢氧化铝的两性和氢氧化铝的受热分解。
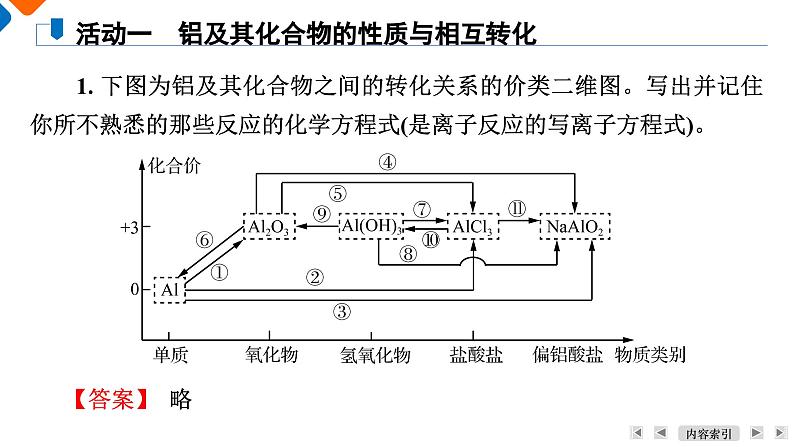
1. 下图为铝及其化合物之间的转化关系的价类二维图。写出并记住你所不熟悉的那些反应的化学方程式(是离子反应的写离子方程式)。
活动一 铝及其化合物的性质与相互转化
2. 通过上面的转化关系图,我们发现无论是Al、Al2O3还是Al(OH)3,在强酸或强碱性环境下,铝元素的存在形式都是相同的。分别写出它们在强酸和强碱性环境下,铝元素的存在形式(用化学式表示)。
活动二 铝及其化合物区别于其他金属及其化合物的特殊性质
请根据要求回答问题。1. 理论上,可以采用金属与酸反应的原理制取氢气。实验发现金属与硫酸反应速率很小,不能满足需要;金属与盐酸反应速率虽然较大,但H2纯度存在问题。(1) 金属与盐酸反应制取的氢气中含有的杂质是什么?
【答案】 HCl气体。
(2) 如何能较快、高纯度地制取氢气?写出反应的离子方程式。
2. 在金属活动性顺序中,铝比铁活泼,但是生活中我们却发现铝制品比铁制品更耐腐蚀(即使用砂纸将铝制品打磨后,铝制品仍有较强的耐腐蚀性),试解释其原因。
【答案】 铝制品表面很容易形成致密的氧化铝保护膜。
3. 通常情况下,装运浓硫酸或浓硝酸均可以使用铁或铝制的槽罐车,运用了什么原理?
【答案】 常温下,浓硫酸、浓硝酸都能使铝、铁发生钝化。
4. 铝热反应既可用来冶炼高熔点金属,又可用来野外焊接铁轨等。请你分别举例说明(各写一个化学方程式),并简要说明在实验室引发铝热反应的操作。
5. 铝土矿、刚玉、红宝石和蓝宝石虽然名称各异,其主要化学成分都相同。家庭装修采用的复合地板的表面也涂有该物质,既耐磨、又耐高温。该物质是什么?该物质特殊的物理性质是什么?
【答案】 该物质是Al2O3,其熔点高、硬度大。
6. 分别写出Al(OH)3酸式电离和碱式电离的电离方程式,并用平衡移动原理解释为什么Al(OH)3既能与氢氧化钠溶液反应,又能与盐酸反应?
7. 明矾作为一种混凝剂被广泛应用于水处理中。结合离子方程式简述明矾可用来进行水处理的原理。
Ⅰ. 提纯氧化铝。铝土矿的主要成分是Al2O3,此外,还含有少量SiO2、Fe2O3等杂质,冶炼金属铝很重要的一个过程就是氧化铝的提纯。氧化铝的提纯通常有以下两种方法。1. 碱溶法。工艺流程如下:
活动三 工业上从铝土矿中提取铝
(1) 写出“溶解”和“酸化”两步中主要反应的离子方程式。
(2) 写出“灼烧”时主要反应的化学方程式。
(3) “酸化”时不用盐酸或稀硫酸代替CO2的原因是什么?
【答案】 因为偏铝酸钠与酸反应生成的Al(OH)3具有两性,可以溶于强酸,用盐酸或稀硫酸,不易控制加入的量;另外CO2廉价,而且生成的副产物NaHCO3用途广泛,经济效益好。
(4) “灼烧”得到的“较纯的Al2O3”可能混有的杂质是什么?在电解时它不会影响铝的纯度的原因是什么?
【答案】 杂质是SiO2;SiO2的熔点很高,在加热到1 000 ℃左右时不会熔化,易与铝分离。
2. 酸溶法。工艺流程如下:(1) 写出步骤“溶解”“除铁”两步中可能发生反应的离子方程式。
(2) “除铁”时不用氨水沉淀Fe3+的原因是什么?分别写出过量氨水与Al3+和Fe3+反应的离子方程式。
Ⅱ. 电解熔融氧化铝冶炼铝。电解时,常需要加入冰晶石(化学式为Na3AlF6),以降低氧化铝的熔点。冰晶石可通过下列流程制得。(1) 已知物质C常在医疗上用作石膏绷带,写出物质A的化学式,并说说反应①能够进行的原因。
【答案】 H2SO4。反应①能够进行的原因是能生成易挥发的HF气体。
(2) 写出反应②的化学方程式。
【答案】 12HF+3Na2CO3+2Al(OH)3===2Na3AlF6+3CO2+9H2O
(3) 写出电解熔融氧化铝冶炼铝的化学方程式。
1 (上海卷)在pH=1的100 mL 0.1 ml·L-1的AlCl3中,加入300 mL 0.1 ml·L-1的氢氧化钠溶液后铝的存在形式是( )
2 (江苏卷)下列有关物质的性质与用途具有对应关系的是( )A. 铝的活泼性强,可用于制作金属铝制品B. 氧化铝熔点高,可用作电解冶炼铝的原料C. 氢氧化铝受热分解,可用于中和过多的胃酸D. 明矾溶于水并水解形成胶体,可用于净水
3 (浙江卷)下列关于铝及其化合物的说法中,不正确的是( )A. 明矾可用作净水剂和消毒剂B. 利用铝热反应可冶炼高熔点金属C. 铝可用作包装材料和建筑材料D. 氢氧化铝可用作治疗胃酸过多的药物
4 (江苏适应性考试)由制铝工业废渣(主要含Fe、Ca、Si、Al等的氧化物)制取聚合硫酸铁铝净水剂的流程如下图所示。下列有关说法不正确的是( )A. 控制适当反应温度并不断搅拌,有利于提高铁、铝浸取率B. Al2O3与稀硫酸反应的离子方程式为Al2O3+6H+===2Al3++3H2OC. 滤液中主要存在的阳离子有H+、Fe2+、Ca2+、Al3+D. 聚合硫酸铁铝水解形成的胶体具有吸附作用
5 某兴趣小组用铝箔制备Al2O3、AlCl3·6H2O及明矾大晶体,具体流程如下图所示。已知:AlCl3·6H2O易溶于水、乙醇及乙醚;明矾在水中的溶解度如下表所示。
请回答:(1) 步骤Ⅰ中反应的化学方程式为_____________________________________。步骤Ⅱ中生成Al(OH)3的离子方程式为________________________________________。(2) 步骤Ⅲ,下列操作合理的是________(填字母)。A. 坩埚洗净后,无需擦干,即可加入Al(OH)3灼烧B. 为了得到纯Al2O3,需灼烧至恒重C. 若用坩埚钳移动灼热的坩埚,需预热坩埚钳D. 坩埚取下后放在陶土网上冷却待用E. 为确保称量准确,灼烧后应趁热称重
2Al+2NaOH+2H2O===2NaAlO2
(3) 由溶液A制备AlCl3·6H2O的装置如图所示。①通入HCl的作用是抑制AlCl3水解和_______________________________________。②步骤Ⅴ抽滤时,用玻璃纤维替代滤纸的理由是__________________________;洗涤时,合适的洗涤剂是__________。③步骤Ⅵ,为得到纯净的AlCl3·6H2O,宜采用的干燥方式是______________________。
增大c(Cl-),有利于AlCl3·
溶液有强酸性,会腐蚀滤纸
低温干燥(或减压干燥)
6 (江苏卷,改编)铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和 Fe2O3等杂质)为原料制备铝的一种工艺流程如下:
注:SiO2在“碱溶”时转化为Na2SiO3沉淀。
(1) “碱溶”时生成NaAlO2的离子方程式为________________________________________________________________________。(2) 向“过滤Ⅰ”所得滤液中加人NaHCO3溶液,溶液的pH________(填“增大”“不变”或“减小”)。(3) “电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是_______________________________________________。
(4) “电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为______________________________________________________,阴极产生的物质A的化学式为________。
(5) 铝粉在1 000 ℃时可与N2反应制备AlN。在铝粉中添加少量的NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是________________________________________________________________________。
模块2 主题2 第3讲 氮及其化合物 课件 2025高考化学一轮复习: 这是一份模块2 主题2 第3讲 氮及其化合物 课件 2025高考化学一轮复习,共43页。PPT课件主要包含了学习目标,活动方案,答案略,答案反应①③,答案取代反应,答案显色反应,链接真题,答案B,答案C,倒置的烧瓶内等内容,欢迎下载使用。
模块2 主题2 第1讲 氯及其化合物 课件 2025高考化学一轮复习: 这是一份模块2 主题2 第1讲 氯及其化合物 课件 2025高考化学一轮复习,共37页。PPT课件主要包含了学习目标,活动方案,链接真题等内容,欢迎下载使用。
模块2 主题1 第4讲 金属资源的开发 课件 2025高考化学一轮复习: 这是一份模块2 主题1 第4讲 金属资源的开发 课件 2025高考化学一轮复习,共28页。PPT课件主要包含了学习目标,活动方案,链接真题等内容,欢迎下载使用。












