



黑龙江省绥化市2024届高三下学期4月联考模拟化学试题(原卷版+解析版)
展开可能用到的相对原子质量:H 1 C 12 N 14 O 16 Ge 73 I 127
一、选择题(本题共15小题,每小题3分,共计45分。在每小题列出的四个选项中,只有一项是符合题目要求的)
1. 化学与生活、生产、科技联系紧密。下列说法正确的是
A. 纳米材料都属于胶体B. 氨基酸是构成生命物质的生物高分子
C. 建造桥梁的水泥属于硅酸盐材料D. 制白砂糖时用活性炭脱色属于化学变化
【答案】C
【解析】
【详解】A.纳米材料没有分散剂,不能叫胶体,故A错误;
B.氨基酸是构成蛋白质的基石,但氨基酸不是生物高分子,故B错误;
C.水泥属于硅酸盐材料,故C正确;
D.活性炭具有吸附性,可将色素杂质吸附,因此可用于白砂糖的脱色,属于物理变化,故D错误;
故选C。
2. 下列化学用语表述正确的是
A. 基态S原子结构示意图:
B. 环型碳、环型碳和金刚石均是碳元素的同素异形体
C. 的VSEPR模型:
D. 基态Si的价层电子排布图:
【答案】B
【解析】
【详解】A.S的原子序数为16,原子核内有16个质子,核外有16个电子,基态S原子结构示意图为,故A项错误;
B.环型碳、环型碳和金刚石都是碳元素的单质,是碳元素的同素异形体,故B项正确;
C.水分子的VSEPR模型为,故C项错误;
D.基态Si的核外电子排布式为,则价层电子排布图为,故D项错误;
故本题选B。
3. 化学实验操作是进行科学实验的基础。下列操作符合规范的是
A. AB. BC. CD. D
【答案】A
【解析】
【详解】A.碱式滴定管排气泡时,把橡皮管向上弯曲,轻轻挤压玻璃珠附近的橡皮管可以使溶液从尖嘴涌出,气泡即可随之排出,故A项操作符合规范;
B.装置未形成封闭体系,故B项操作不符合规范;
C.过滤时漏斗颈下端要紧靠烧杯内壁,故C项操作不符合规范;
D.转移溶液时,应使用玻璃棒引流,故D项操作不符合规范;
故本题选A。
4. 下列离子方程式书写正确的是
A. 过氧化钠溶于水:
B. 硅酸钠溶液中通入过量二氧化碳:
C. 用醋酸和淀粉-KI溶液检验加碘盐中的:
D. Cl2通入冷的Ca(OH)2溶液:
【答案】D
【解析】
【详解】A.属于氧化物,不能拆成离子形式,,A项错误;
B.硅酸的酸性小于碳酸,向硅酸钠溶液中通入过量二氧化碳,生成硅酸和碳酸氢钠,反应的离子方程式为,B项错误;
C.用醋酸和淀粉-KI溶液检验加碘盐中的的原理是在酸性条件下与I-发生归中反应生成I2,而I2遇淀粉变蓝,由于醋酸是弱酸,在离子方程式中不能用H+表示,C项错误;
D.Cl2通入冷的Ca(OH)2溶液中发生反应生成和,该反应的离子方程式为,D项正确;
故选D。
5. 为阿伏加德罗常数的值,下列说法正确的是
A. 的盐酸中含有的数目为
B. 0.1ml与0.1ml反应时,转移电子的数目为
C. 100mL溶液中含有的H―O键的数目为
D. 标准状况下,22.4L中C―Cl键的数目为
【答案】B
【解析】
【详解】A.溶液体积未知,故无法计算氢离子个数,故A项错误;
B.的还原性比强,先与反应,0.1ml中含0.2ml,0.2ml与0.1ml恰好完全反应生成0.2ml和0.1ml,转移电子0.2ml,电子数为,故B项正确;
C.溶液中的水分子中也含有H―O键,所以H―O键数目大于,故C项错误;
D.在标准状况下是液态,不能使用气体摩尔体积计算,故D项错误;
故本题选B。
6. 下列关于物质的结构与性质或应用的描述中错误的是
A. 葡萄糖可用于玻璃等材料表面化学覆银,因为葡萄糖具有还原性
B. AgCl溶于氨水,是由于AgCl与反应生成了可溶性配合物
C. 比的热稳定性强,因为氨分子间存在氢键
D. 利用除去HCl气体中混有的,可从和都是非极性分子的角度解释
【答案】C
【解析】
【详解】A.葡萄糖分子内含有醛基,具有较强的还原性,可用于玻璃等材料表面化学覆银,故A项正确;
B.可以和形成配离子,导致氯化银可以溶解在氨水中,故B项正确;
C.比稳定,是因为氮元素的非金属性强于磷元素,和分子间氢键没有关系,故C项错误;
D.氯气和四氯化碳都是非极性分子,根据相似相溶原理,氯气易溶于,则可利用除去氯化氢气体中混有的氯气,故D项正确;
故本题选C。
7. 一种综合处理含尾气的工艺流程如图所示。下列叙述错误的是
A. “吸收”过程中发生反应的离子方程式为
B. “吸收”和“氧化”两步反应均为熵减的反应
C. 分子和固体所含的化学键类型相同
D. 该流程中可以循环使用的物质为
【答案】C
【解析】
【分析】具有还原性,具有氧化性,则“吸收”过程中发生反应的离子方程式为,空气氧化后,Fe2+被氧化为Fe3+,又重新得到,可循环使用。
【详解】A.根据分析,“吸收”过程中发生反应的离子方程式为,A正确;
B.“吸收”和“氧化”两步反应中,都有气体参与反应,而没有气体生成,“吸收”和“氧化”两步反应均为熵减的反应,B正确;
C.分子中含有极性共价键,固体中含有离子键和极性共价键,则和所含化学键类型不相同,C错误;
D.在“吸收”过程中被消耗,在“氧化”过程中生成,则该流程中可以循环使用的物质为,D正确;
故选C。
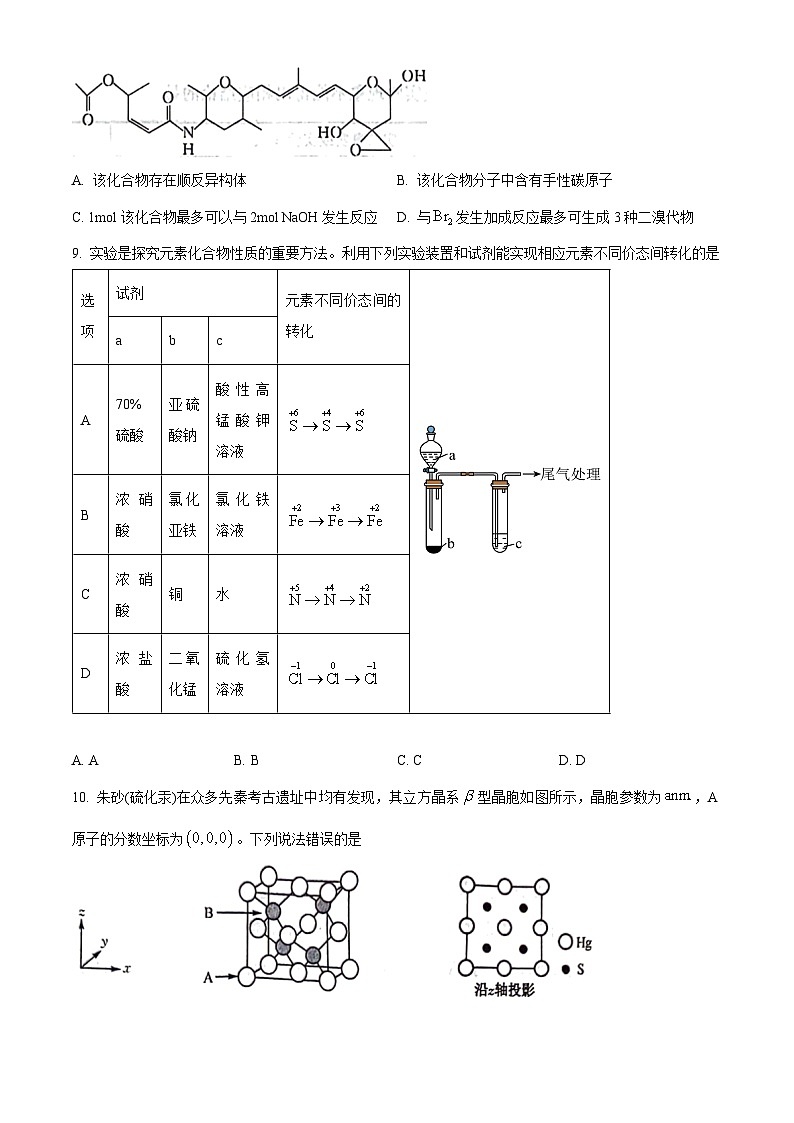
8. 某化合物具有抗癌活性,其分子结构如图所示。下列有关该物质的说法错误的是
A. 该化合物存在顺反异构体B. 该化合物分子中含有手性碳原子
C. 1ml该化合物最多可以与2ml NaOH发生反应D. 与发生加成反应最多可生成3种二溴代物
【答案】D
【解析】
【详解】A.该化合物中含有碳碳双键,通过分析分子结构可知分子存在顺反异构体,A项正确;
B.手性碳原子是指与四个互不相同原子或基团相连的碳原子,该有机物含有手性碳原子,如最右侧与羟基相连的碳原子等,B项正确;
C.该化合物中含有酯基和酰胺基,它们都可以在NaOH溶液中发生水解反应,1ml该化合物最多可以与2ml NaOH发生反应,C项正确;
D.该化合物中含有碳碳双键,可以和发生1,2加成反应生成3种二溴代物,发生1,4加成反应生成1种二溴代物,最多可生成4种二溴代物,D项错误;
故本题选D。
9. 实验是探究元素化合物性质的重要方法。利用下列实验装置和试剂能实现相应元素不同价态间转化的是
A. AB. BC. CD. D
【答案】C
【解析】
【详解】A.70%硫酸和亚硫酸钠反应生成,没有发生氧化还原反应,S的化合价没有变化,A项不符合题意;
B.浓硝酸具有强氧化性,和氯化亚铁溶液反应时,可以将铁从+2价氧化到+3价,生成的和氯化铁溶液中的反应生成和NO,不能把铁从+3价还原到+2价,B项不符合题意;
C.浓硝酸和铜反应生成,N元素从+5价转化为+4价,和水反应生成和NO,N元素化合价从+4变为+5和+2,C项符合题意;
D.浓盐酸和二氧化锰固体在加热条件下才能发生反应生成,D项不符合题意;
答案选C。
10. 朱砂(硫化汞)在众多先秦考古遗址中均有发现,其立方晶系型晶胞如图所示,晶胞参数为,A原子的分数坐标为。下列说法错误的是
A. 晶体中Hg的配位数为4B. 晶胞中B原子分数坐标为
C. 电负性:D. S与Hg之间的最短距离为
【答案】B
【解析】
【详解】A.由晶胞图知汞位于顶点和面心,按均摊法晶胞内含个汞,晶胞内有4个S,则该晶体的化学式为HgS,原子个数比为1∶1,一个S原子周围最近的Hg原子数目为4,一个Hg原子周围最近的S原子数目为4,故Hg原子的配位数为4,A项正确;
B.由A原子的分数坐标为,结合投影图知,晶胞中B原子分数坐标为,B项错误;
C.一般非金属元素的电负性大于金属元素的电负性,故电负性:,C项正确;
D.S与Hg之间的最短距离为体对角线的四分之一,即为,D项正确;
选B。
11. 某含铜催化剂阴离子的结构如图所示。W、X、Y、Z是原子序数依次增大的短周期主族元素,其中X、Y、Z位于同一周期,基态X原子的价电子排布式为,Z的非金属性最强。下列说法错误的是
A. 该阴离子中铜原子的配位数为4B. X原子杂化方式为和
C. 基态原子的第一电离能:X
【解析】
【分析】由基态X原子的价电子排布式为nsnnpn可知n=2,X为C,W、X、Y、Z是原子序数依次增大的短周期主族元素,其中X、Y、Z位于同一周期,结合图示,即W为H,Y为N,Z为F。
【详解】A.由图可知,该阴离子为,其中铜原子的配位数为4,A项正确;
B.该化合物中含有饱和碳原子和碳氮三键,碳原子杂化方式为和sp,B项错误;
C.同周期元素从左往右,第一电离能总体逐渐增大,但部分原子由于全充满或半充满结构较为稳定等结构的特殊性,导致其第一电离能较高,基态原子的第一电离能:,C项正确;
D.由图可知,该阴离子为,其中铜元素的化合价为+3,基态铜原子失去三个电子,该阴离子中铜的价电子排布式为,D项正确;
故选B。
12. 根据下列实验事实或实验现象不能得出相应结论的是
A. AB. BC. CD. D
【答案】C
【解析】
【详解】A.向溶液中同时通入和,有白色沉淀生成,说明氧化生成了,则氧化性:,能得出相应结论,A项不符合题意;
B.向装有FeS固体的装置中滴加稀盐酸,有气体产生,可证明酸性:,能得出相应结论,B不符合题意;
C.只有与苯环直接相连的碳原子上有氢原子时,才能被酸性高锰酸钾溶液氧化,当该碳原子上没有氢原子时,就不能与酸性高锰酸钾溶液反应,不能得出相应结论,C符合题意;
D.和组成相似,越小越容易产生沉淀,则根据选项的实验事实可得出溶度积常数:,能得出相应结论,D不符合题意;
故选C。
13. 如图,b为标准氢电极,可发生还原反应()或氧化反应(),a、c分别为AgCl/Ag、AgI/Ag电极。实验发现:1与2相连a电极质量减小,2与3相连c电极质量增大。下列说法错误的是
A. 图中1与2相连,盐桥1中阴离子向b电极移动
B. 图中2与3相连,b极电极反应式为
C. 图中1与3相连,电池反应
D. 图中1与2、2与3相连,两个原电池装置中,电势较低的一极均为b电极
【答案】D
【解析】
【分析】1与2相连a电极质量减小,则图中1与2相连,左侧两池构成原电池,a电极质量减小,AgCl转化为Ag,说明a为正极,b为负极;2与3相连c电极质量增大,说明右侧两池构成原电池,c电极质量增大,Ag转化为AgI,说明c为负极,b为正极;
【详解】A.1与2相连a电极质量减小,则图中1与2相连,左侧两池构成原电池,a电极质量减小,AgCl转化为Ag,说明a为正极,b为负极,盐桥1中阴离子向b电极移动,A项正确;
B.图中2与3相连,右侧两池构成原电池,c电极质量增大,Ag转化为AgI,说明c为负极,b为正极,b极电极反应式为,B项正确;
C.图中1与3相连时,a为正极,c为负极,电极反应式分别为a极:,c极:,电池反应为,C项正确;
D.图中1与2相连,b为负极,b电极电势较低,2与3相连,c为负极,c电极电势较低,D项错误;
选D。
14. 科研人员利用高压气流将水微滴喷射到涂覆催化剂的石墨网上,研究常温制氨,其反应历程中微粒转化关系如图1所示,相对能量变化关系如图2所示,吸附在催化剂表面的物质用“*”标注。下列说法错误的是
A. 反应过程中存在极性键的断裂与形成及非极性键的断裂
B. 由图1反应历程可以看出,生成1ml需要消耗6ml
C. Ⅱ表示的微粒符号是
D. 反应历程中化学反应速率最慢的反应是
【答案】B
【解析】
【详解】A.反应过程中发生氮氮非极性键断裂、氢氧极性键的断裂、氮氢极性键的形成,A正确;
B.根据元素守恒,生成1ml消耗3ml,B错误;
C.生成Ⅱ的方程式为,Ⅱ为,C正确;
D.反应历程中化学反应速率最慢的反应是和、生成Ⅰ的反应,方程式为,D正确;
故选B。
15. 常温下,向25mL溶液中逐滴加入一定浓度的氨水,该过程中加入氨水的体积V与溶液中的关系如图所示。已知d点对应的溶液迅速由浑浊变得澄清且此时溶液中的与均约为。下列叙述错误的是
A. a点溶液中由水电离出的浓度为
B. b点对应溶液中:
C. 做银镜反应实验时,最好选择d点对应的银氨溶液
D. 常温下,反应的平衡常数的数量级为
【答案】D
【解析】
【详解】A.a点溶液中,,则,a点溶质为,发生水解,可以促进水的电离,故由水电离出的,故A项正确;
B.根据电荷守恒有,b点对应的溶液中存在,因此有,故B项正确;
C.d点时,生成的AgOH恰好完全溶解,故C项正确;
D.由d点可知,d点,据Ag元素守恒得:,故的平衡常数,故D项错误;
故本题选D。
二、非选择题(本题共4小题,共55分)
16. 高铁酸盐是一种优良的净水剂。实验室合成高铁酸钾()的过程如图所示:
已知:相同温度下,KClO的溶解度小于KOH的。
回答下列问题:
(1)Fe位于元素周期表第___________周期第___________族,中Fe的化合价为___________。
(2)“反应1”中氧化剂与还原剂的物质的量之比为___________。
(3)“洗气”操作可选用的装置为___________(填字母)。
(4)沉淀b的主要成分为___________(填化学式)。从饱和KOH溶液中得到白色沉淀b需要使用的玻璃仪器为___________。
(5)“反应2”发生主要反应的化学方程式为___________。
(6)高铁酸盐还可用电解法制备。利用纯铁作电极插入浓的NaOH溶液电解制得的工作原理如图所示。
①阳极生成的电极反应式为___________。
②对装置进行改进,在阴、阳电极间设置阳离子交换膜,能有效提高产率,离子交换膜的作用是___________。
【答案】(1) ①. 四 ②. Ⅷ ③. +6
(2)1∶5 (3)AD
(4) ①. KClO ②. 烧杯、玻璃棒、漏斗
(5)
(6) ①. ②. 避免在阴极上被还原
【解析】
【分析】反应1中高锰酸钾溶液与浓盐酸制取氯气,浓盐酸易挥发,氯气中含有HCl,HCl会消耗KOH,故洗气的目的是除去氯气中的HCl,应用饱和食盐水除去HCl,氯气与KOH溶液在冷水中反应生成KCl和KClO,因为相同温度下,KClO的溶解度小于KOH的,故沉淀b的主要成分为KClO。“反应2”发生主要反应为KClO氧化Fe(NO3)3制备K2FeO4,据此分析解答。
【小问1详解】
Fe为26号元素,位于元素周期表第四周期第Ⅷ族,K2FeO4中K为+1价,O为-2价,则Fe为0-(-2)×4 - (+1)×2=+6。
【小问2详解】
“反应1”中发生反应,氧化剂为KMnO4,还原剂为HCl,则氧化剂与还原剂的物质的量之比为2:10=1:5。
【小问3详解】
高锰酸钾溶液与浓盐酸制取氯气,浓盐酸易挥发,氯气中含有HCl,HCl会消耗KOH,故洗气的目的是除去氯气中的HCl,应用饱和食盐水除去HCl,导气管应长进短出,可选用的装置为AD,且D中长颈漏斗可平衡压强。
【小问4详解】
氯气与KOH溶液在冷水中反应生成KCl和KClO,因为相同温度下,KClO的溶解度小于KOH的,故沉淀b的主要成分为KClO。从饱和KOH溶液中得到白色沉淀b需要过滤操作,需要使用的玻璃仪器为烧杯、玻璃棒、漏斗。
【小问5详解】
“反应2”发生主要反应为KClO氧化Fe(NO3)3制备K2FeO4,根据得失电子守恒、元素守恒配平化学方程式为。
【小问6详解】
①阳极铁失去电子发生氧化反应生成,反应为;②中铁处于高价态,具有氧化性,阳离子交换膜的作用是避免在阴极上被还原。
17. 无水三氯化铬()是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧化。实验室利用反应制取的(俗称光气)有毒,遇水发生水解,实验所需装置如图所示。
回答下列问题:
(1)上述装置的正确连接顺序为___________(填字母,按气流方向从左到右)。
(2)装置A中所盛放的试剂是___________,装置A中竖直长玻璃管的作用是___________。装置D中n瓶的作用是___________。实验过程中为了避免装置A中长玻璃管中液面上升,可以采用的方法为___________(填序号)。
①对m处导管进行加热 ②将m处导管加粗 ③持续通入氮气
(3)装置E中发生反应的离子方程式为___________。无水的作用是___________。
(4)已知分子中各原子均满足最外层8电子稳定结构,则1ml含有键的个数为___________(为阿伏加德罗常数的值)。
(5)的结构有三种,且铬的配位数均为6,等物质的量的三种物质电离出的氯离子数目之比为3∶2∶1,对应的颜色分别为紫色、浅绿色和蓝绿色。其中浅绿色的结构中配离子的化学式为___________。哈勃-韦斯(Haber-Weiss)原理表明,某些金属离子可以催化双氧水分解的原因是其次外层未排满的d轨道可以存取电子,降低活化能,使分解反应容易发生。则___________(填“能”或“不能”)催化双氧水分解。
【答案】(1)ACBDFE
(2) ①. 浓硫酸 ②. 平衡压强,观察装置是否堵塞 ③. 冷凝、收集 ④. ①②
(3) ①. ②. 防止装置E中的水蒸气进入仪器n中,使潮解
(4)
(5) ①. ②. 能
【解析】
【分析】实验室制取CrCl3的反应为:,CrCl3易潮解高温下易被氧气氧化,所以要防止装置内在高温条件下不能存在空气,反应结束后继续通入一段时间氮气,让CrCl3在氮气氛围中冷却,防止空气进入使CrCl3氧化;A中装浓H2SO4,干燥N2并防止空气中水蒸气进入装置,与B装置相连,将CCl4蒸气吹入C中,发生反应:,D装置收集产物,无水CaCl2防止E中水蒸气进入D及B装置;反应结束后继续通入一段时间氮气,将 COCl2排入装置 E 中并被充分吸收,回收尾气,装置连接顺序为:A、C、B、D、F、E。
【小问1详解】
根据分析,装置连接顺序为:ACBDFE;
【小问2详解】
装置A中所盛放的试剂是浓硫酸,装置A中竖直长玻璃管的作用是平衡压强,观察装置是否堵塞。易升华,故装置D中n瓶的作用是冷凝、收集。实验过程中为了避免装置A中长玻璃管中液面上升,可以采用的方法为对m处导管进行加热、将m处导管加粗,故选①②;
【小问3详解】
装置E中发生反应的离子方程式为:;无水的作用是:防止装置E中的水蒸气进入仪器n中,使潮解;
【小问4详解】
根据题意,的结构式为:,1ml含有键的个数为3NA;
【小问5详解】
根据题意,浅绿色配合物中外界有2个氯离子,故化学式为:,故配离子的化学式为:;的核外价电子排布式为:3d7,存在未排满的3d轨道,故能催化双氧水分解。
18. 工业尾气脱硝是减少空气污染的重要举措。回答下列问题:
(1)活性炭脱硝:一定温度下,向2L恒温密闭容器中加入足量活性炭和2ml,发生反应:,部分物质的物质的量随反应时间t的变化曲线如图1所示。
①曲线Ⅰ表示___________(填化学式)的物质的量随反应时间t的变化,0~2min内,___________。3min时,再充入,该容器中气体的颜色___________(填“加深”“变浅”或“不变”)。
②为了提高该反应中的平衡转化率,理论上可采取的措施是___________(填字母)。
A.恒容时充入稀有气体 B.恒压时充入稀有气体
C.增加活性炭的质量 D.选择合适的催化剂
(2)脱硝:反应原理为。
已知 ;
,则反应的___________。若的逆反应的活化能为,则正反应的活化能为___________(用含a的代数式表示)。
(3)氨化脱硝:氨化脱硝过程发生反应 ,不同温度下,经过相同时间的脱硝效率随温度的变化关系如图2所示。分析420℃时的脱硝效率低于390℃时的脱硝效率的原因可能是___________。
(4)甲酸脱硝:25℃时,用甲酸吸收氨气可得到溶液。已知:25℃时,甲酸的,的。则反应的平衡常数___________。
(5)生物酶脱硝:某些生物酶体系可以促进和的转移(如a、b和c),能将海洋中的转化为进入大气层,反应过程如图3所示。过程Ⅰ到过程Ⅲ的总反应的离子方程式为___________。
【答案】(1) ①. ②. ③. 加深 ④. B
(2) ①. ―985.2 ②.
(3)420℃催化剂活性差,催化效率低,反应速率较慢,脱硝效率较低
(4)
(5)
【解析】
【小问1详解】
①向容器中加入的是活性炭和NO2,随着反应进行,NO2物质的量减少,生成物CO2和N2的物质的量增加,根据反应方程式,NO2减少的物质的量和CO2增加的物质的量相等,根据图像可知,曲线Ⅲ代表的是NO2,则曲线Ⅰ代表的是CO2;0~2min内,NO2的物质的量减少了1.5ml,则v(NO2)==0.375ml⋅L−1⋅min−1;3min时,再充入NO2,NO2浓度增大,则气体颜色加深。
②恒容时充入稀有气体,不改变任何一种物质的浓度,平衡不移动,故A不选;恒压时充入稀有气体,容器体积变大,平衡向正反应方向移动,可以提高NO2的平衡转化率,故B选;活性炭是固体,增加活性炭的用量,不能使平衡移动,故C不选;催化剂不影响平衡,故D不选,故选B。
【小问2详解】
设为反应①, 为反应②,①-②即得反应CH4(g)+2NO(g)+O2(g)⇌CO2(g)+N2(g)+2H2O(g),则该反应的ΔH=−802.6kJ⋅ml−1-182.6kJ⋅ml−1=-985.2kJ⋅ml−1;反应的ΔH=正反应的活化能-逆反应的活化能,所以正反应的活化能=(a−985.2)kJ⋅ml−1。
【小问3详解】
图示中是相同时间的脱硝效率随温度的变化,即速率随温度的变化,温度高的420℃时的脱硝效率反而低于温度低的390℃时的脱硝效率的原因可能是420℃催化剂活性差,催化效率低,反应速率较慢,脱硝效率较低。
【小问4详解】
反应的K===3.5×104。
【小问5详解】
从图3可知,反应物为和,生成物为水和氮气,则总反应的化学方程式为:。
19. “有机光伏”是既经济又具发展潜力的新一代太阳能电池技术。科学家设计了一种新型有机太阳能电池材料(H),其合成路线如下:
回答下列问题:
(1)化合物A的习惯命名为___________。化合物D中含氧官能团的名称为___________。
(2)D与E生成F的反应类型属于___________反应。1ml和发生反应时最多消耗___________ml。
(3)已知B与C经过3步反应得到D:
M的结构简式为___________。由生成的化学反应方程式为___________。该步反应中的作用可能是___________。
(4)B的芳香族同分异构体中,能够与银氨溶液反应生成单质Ag的结构共有___________种(立体异构及物质B除外),其中核磁共振氢谱有3组峰且峰面积之比为1∶2∶2的结构简式为___________。
(5)参照上述合成路线,设计以化合物G、E及D,依次在和的催化及作用下,通过两步反应制备化合物H的另外一种合成路线:___________。
【答案】(1) ①. 邻羟基苯甲醛 ②. 酯基
(2) ①. 取代 ②. 6
(3) ①. ②. ③. 消耗反应生成的,利于反应正向进行,提高的产率
(4) ①. 12 ②.
(5)
【解析】
【分析】A和Br2发生取代反应生成B,由B可知A为:,B和发生加成反应生成,发生消去反应生成,发生取代反应生成,D与E发生取代反应得到F,F与G发生取代反应得到H。
【小问1详解】
A()中含邻位醛基和羟基,A的习惯命名为,邻羟基苯甲醛;D()含有酯基;
【小问2详解】
D与E生成F的反应类型属于取代反应;1ml含1ml苯环,三个碳碳双键,和发生反应时最多消耗6ml;
【小问3详解】
B和发生加成反应生成,发生消去反应生成,发生取代反应生成 ,M的结构简式为;由生成的化学反应方程式为
;该步反应中的作用可能是:消耗反应生成的,利于反应正向进行,提高的产率
【小问4详解】
有机物B的同分异构体满足条件:①结构内含有苯环且能发生银镜反应,其中含有醛基或甲酸酯结构;苯环上的取代基为-Br、-OH、-CHO时,共有10种情况,苯环上的取代基为-Br、-OOCH时,共有3种情况,除去B本身,满足调节的B的同分异构体有12种,核磁共振氢谱检测到三组峰(峰面积比为1∶2∶2),其结构简式为:;
【小问5详解】
照上述合成路线,设计以化合物G、E及D,依次在和的催化及作用下,通过两步反应制备化合物H的合成路线为:。A.碱式滴定管排气泡
B.检查装置气密性
C.过滤
D.溶液的转移
选项
试剂
元素不同价态间的转化
a
b
c
A
70%硫酸
亚硫酸钠
酸性高锰酸钾溶液
B
浓硝酸
氯化亚铁
氯化铁溶液
C
浓硝酸
铜
水
D
浓盐酸
二氧化锰
硫化氢溶液
选项
实验事实或实验现象
结论
A
向溶液中同时通入和,有白色沉淀生成
氧化性:
B
向装有FeS固体的装置中滴加稀盐酸,有气体产生
酸性:
C
向酸性高锰酸钾溶液中加入甲苯,紫色褪去
甲苯同系物均有此性质
D
常温下,分别向浓度均为的和溶液中通入气体至饱和,仅后者生成沉淀
溶度积常数:
黑龙江省绥化市2024届高三下学期4月联考模拟化学试题: 这是一份黑龙江省绥化市2024届高三下学期4月联考模拟化学试题,文件包含高三化学试题pdf、高三化学答案pdf等2份试卷配套教学资源,其中试卷共12页, 欢迎下载使用。
2024届全国高三大联考(全国乙卷)4月大联考化学试题(原卷版+解析版): 这是一份2024届全国高三大联考(全国乙卷)4月大联考化学试题(原卷版+解析版),文件包含2024届全国大联考全国乙卷4月大联考化学试题原卷版docx、2024届全国大联考全国乙卷4月大联考化学试题解析版docx等2份试卷配套教学资源,其中试卷共28页, 欢迎下载使用。
2024届江西省多校联考高三下学期模拟预测化学试题(原卷版+解析版): 这是一份2024届江西省多校联考高三下学期模拟预测化学试题(原卷版+解析版),文件包含2024届江西省多校联考高三下学期模拟预测化学试题原卷版docx、2024届江西省多校联考高三下学期模拟预测化学试题解析版docx等2份试卷配套教学资源,其中试卷共33页, 欢迎下载使用。












