





中职化学高教版(2021)化学通用类第二节 弱电解质的解离平衡一等奖ppt课件
展开主题三 溶液与水溶液中的离子反应 3.2 弱电解质的解离平衡
1. 通过观察不同电解质溶液导电能力的差异,了解电解质的解离、弱电解质的解离平衡以及不同电解质的解离特点,理解强、弱电解质的差别及解离条件,发展宏观辨识与微观探析等化学学科核心素养。2.通过观察加入氯化铵固体前后,氨水中酚酞指示剂颜色的变化,体会外界条件变化对弱电解质解离平衡的影响,发展变化观念与平衡思想、实验探究与创新意识等化学学科核心素养。3.通过运用化学平衡移动原理解释弱电解质的解离平衡,加深对化学平衡影响因素的理解,认识强、弱电解质水溶液的组成,发展现象观察与规律认知等化学学科核心素养。
洁厕灵和食醋常被视为生活中的除垢利器,但两者的除垢能力有很大差别。想一想,其中的原因是什么?
洁厕灵和食用醋都能去除污垢,区别是洁厕灵的主要成分是盐酸,属于强酸,食用醋的主要成分是醋酸,是弱酸。
一.强电解质与弱电解质
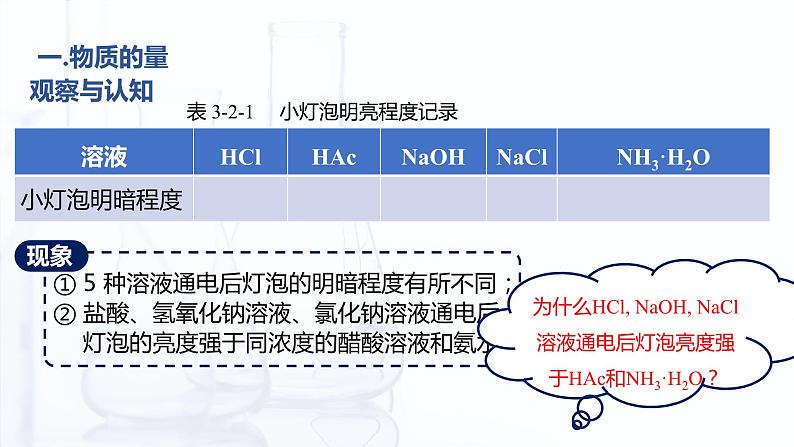
如图3-2-1所示,把等体积、浓度均为1 ml/L的盐酸、醋酸(HAc)、氢氧化钠溶液、氯化钠溶液和氨水分别倒入 5 个烧杯中。接通电源,将各小灯泡的明亮程度填入表3-2-1。
图 3-2-1 比较电解质溶液的导电能力
表 3-2-1 小灯泡明亮程度记录
为什么HCl, NaOH, NaCl溶液通电后灯泡亮度强于HAc和NH3·H2O?
① 5 种溶液都能导电,说明其中都存在自由移动的离子。② 灯泡明暗程度不同意味着不同溶液的导电能力不一样,而溶液的导电能力与溶液中自由移动的离子浓度有关。 ③ 盐酸、氢氧化钠、氯化钠三种溶液对应的灯泡更亮,说明其中自由移动的离子浓度更大。
凡是在水溶液里或熔融状态下能够导电的化合物称为电解质。酸、碱、盐都是电解质。电解质在水溶液中能够导电的原因是它们在溶液中发生了解离(图3-2-3),产生了能够自由移动的离子。例如,氯化钠在溶液中解离成为自由移动的钠离子和氯离子,因此氯化钠溶液能够导电。
图 3-2-3 电解质解离示意图
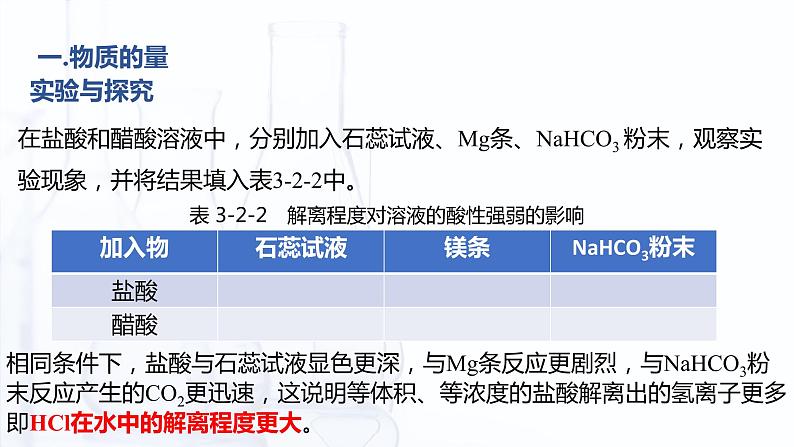
在盐酸和醋酸溶液中,分别加入石蕊试液、Mg条、NaHCO3 粉末,观察实验现象,并将结果填入表3-2-2中。
表 3-2-2 解离程度对溶液的酸性强弱的影响
相同条件下,盐酸与石蕊试液显色更深,与Mg条反应更剧烈,与NaHCO3粉末反应产生的CO2更迅速,这说明等体积、等浓度的盐酸解离出的氢离子更多,即HCl在水中的解离程度更大。
2.强电解质与弱电解质
在水溶液中能够完全解离的电解质称为强电解质,只能部分解离的电解质称为弱电解质。
强酸、强碱和大多数盐类是强电解质,它们在水溶液中的解离是完全而且不可逆的,通常用“ ”表示完全解离。弱酸、弱碱和极少数盐是弱电解质,它们在水溶液中的解离是部分而且可逆的,通常用“ ”表示部分解离。
通常用解离方程式表示电解质的解离,例如,NaCl 、 NaOH、HCl、HAc和NH3·H2O 的解离方程式分别为:
HAc H+ +Ac-NH3 · H2O NH4+ +OH-
NaOH==Na+ + OH-
NaCl==Na+ + Cl-
HCl==H+ + Cl-
二.弱电解质的解离平衡
在 3 支盛有氨水的试管中各加入几滴酚酞试液,分别向 3支试管中加入H2SO4、NaOH溶液以及NH4Cl颗粒,将溶液颜色变化填入表3-2-3中,并分析颜色变化的原因。
表 3-2-3 外界条件对弱电解质解离的影响
酚酞滴入氨水中呈红色,滴入硫酸溶液后颜色变浅至无色;加入氢氧化钠溶液后,红色加深,加入氯化铵颗粒后颜色变浅。
氨水的解离发生了什么变化?
NH3·H2O是弱电解质,在水溶液中存在如下解离过程和解离平衡,而加入H2SO4、NaOH和NH4Cl后会分别增加溶液中H+、OH-和NH4+,进而导致该平衡的移动。NH3·H2O NH4+ +OH-
与化学平衡类似,解离平衡也是一种动态平衡。当温度、浓度等条件发生变化时,解离平衡会发生移动。即解离平衡同样遵循勒夏特列原理。
解离平衡的平衡常数,称为解离常数,弱酸的解离常数用Ka表示,弱碱的解离常数用Kb表示。不同的电解质有不同的解离常数。其数值越大,表示平衡时溶液中弱电解质解离的离子的浓度越大,而弱电解质分子的浓度越小。
向 2 支分别盛有2 mL 0.1 ml/L醋酸溶液和2 mL 饱和硼酸溶液的试管中,逐滴加入等浓度的Na2CO3溶液,观察现象并讨论下面问题: 醋酸、碳酸、硼酸三种弱酸的相对强弱? 据此,能否认为解离常数是电解质强弱的反映?
醋酸能与Na2CO3溶液反应产生气泡,而硼酸与Na2CO3溶液相遇无现象。可见:酸性从强到弱依次为:醋酸>碳酸>硼酸溶液中解离出的H+浓度大小为:醋酸>碳酸>硼酸
表 3-2-4 常见的几种弱电解质的解离常数(25 ℃)
(1) 解离常数的数值越大,弱电解质相对越强。(2)解离常数的数值和溶液的温度有关,而与溶液的浓度无关。当溶液温度变化不大时,可以不考虑温度对解离常数的影响。(3)多元弱酸在水溶液中的解离是分步进行的。其酸性主要由第一步解离决定。
1.下列物质属于强电解质的是A.硫酸钡固体 B.FeC.30%硫酸溶液D.氨气【答案】A
2.下列有关电解质的说法正确的是A.碳酸氢钡是强电解质B.乙醇是弱电解质C.石墨能导电,所以石墨是电解质D.食盐水能导电,所以食盐水是电解质【答案】A
3.下列电离方程式正确的是【答案】D
4.关于强、弱电解质的叙述,不正确的是A.强电解质在水中完全电离,不存在强电解质本身的电离平衡B.在溶液里,强电解质的导电能力比弱电解质的导电能力强C.弱电解质在溶液中部分电离,溶液中存在弱电解质分子D.同一弱电解质的溶液,当温度、浓度不同时,其导电能力也不相同【答案】B
5.在25 ℃时,0.1 ml·L-1的HNO2、HCOOH、HCN、H2CO3的溶液,电离平衡常数分别为 5.6×10-4、 1.8×10-4、6.2×10-10、 K1(H2CO3)=4.5×10-7和K2 (H2CO3)=4.7×10-11,其中氢离子浓度最小的是A.HCNB.HCOOHC.HNO2D.H2CO3【答案】A
业精一分汗禾滴,爱心一颗花万朵。
P77,1.2.3
第二节弱电解质的解离平衡
化学化学通用类第三节 化学平衡完美版ppt课件: 这是一份化学化学通用类<a href="/hx/tb_c4034919_t3/?tag_id=26" target="_blank">第三节 化学平衡完美版ppt课件</a>,共40页。PPT课件主要包含了观察与认知,实验与探究,化学反应,二化学平衡,可逆反应,化学平衡,化学平衡的移动,跟踪检测,作业布置等内容,欢迎下载使用。
高教版(2021)化学通用类第三节 化学键完美版课件ppt: 这是一份高教版(2021)化学通用类<a href="/hx/tb_c4034914_t3/?tag_id=26" target="_blank">第三节 化学键完美版课件ppt</a>,共35页。PPT课件主要包含了学习目标,情境与问题,一离子键,观察与认知,达到8电子稳定结构,离子键的形成,离子化合物,活泼的金属元素,活泼的非金属元素,概念要点等内容,欢迎下载使用。
化学加工制造类第二节 弱电解质的解离平衡完美版课件ppt: 这是一份化学加工制造类<a href="/hx/tb_c4035006_t3/?tag_id=26" target="_blank">第二节 弱电解质的解离平衡完美版课件ppt</a>,文件包含主题三第二节弱电解质的解离平衡课件中职专用高中化学高教版2021加工制造类pptx、主题三第二节弱电解质的解离平衡习题中职专用高中化学高教版2021加工制造类原卷版docx、主题三第二节弱电解质的解离平衡习题中职专用高中化学高教版2021加工制造类解析版docx等3份课件配套教学资源,其中PPT共22页, 欢迎下载使用。












