












大单元一 第二章 第六讲 物质的量浓度-备战2025年高考化学大一轮复习课件(人教版)
展开1.了解物质的量浓度及其相关物理量的含义和应用,体会定量研究对化学科学的重要作用。2.了解溶液物质的量浓度的表示方法,理解溶解度、质量分数等概念,并能进行有关计算。3.掌握一定物质的量浓度溶液的配制方法并能进行误差分析。
考点一 物质的量浓度
考点二 一定物质的量浓度溶液的配制
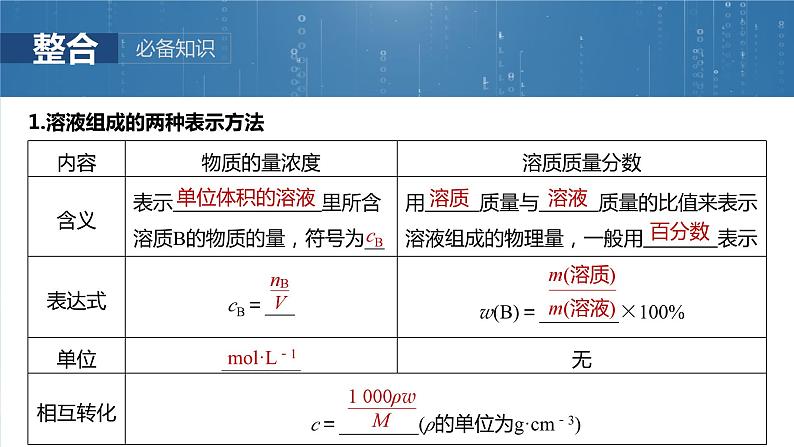
1.溶液组成的两种表示方法
2.物质的量浓度计算的两要素(1)正确判断溶质①与水发生反应生成新物质:Na、Na2O、Na2O2 ;CO2、SO2、SO3 、 、 。②特殊物质:NH3 (溶质按NH3进行计算)。③含结晶水的物质:CuSO4·5H2O、Na2CO3·10H2O 、 。(2)确定溶液体积:溶液体积不是溶剂体积,也不是溶剂体积与溶质体积的简单加和,可以根据V= 求算。
3.溶液的稀释与混合(1)溶液的稀释①溶质的质量在稀释前后保持不变,即m浓w浓=m稀w稀,溶液的质量m稀=m浓+m水;②溶质的物质的量在稀释前后保持不变,即c稀V稀=c浓V浓,但溶液的体积V稀≠V浓+V水。(2)溶液(溶质相同)的混合①物质的量浓度不同(分别为c1、c2)的两溶液:混合前后溶质的物质的量保持不变,即c1V1+c2V2=c混V混。
②质量分数不同(分别为a%、b%)的两溶液
1.在100 mL的烧杯中,加入10 g食盐,然后注入90 mL的水,充分溶解后,所得溶质的质量分数为10%( )2.10.6 g Na2CO3与28.6 g Na2CO3·10H2O分别投入1 L水中完全溶解所得溶液浓度均为0.1 ml·L-1 ( )3.将62 g Na2O溶于水中,配成1 L溶液,所得溶质的物质的量浓度为1 ml·L-1( )4.将40 g SO3溶于60 g水中所得溶质的质量分数为40%( )5.将标准状况下44.8 L HCl溶于100 mL水中,所得溶液的密度为1.384 g·mL-1,则其物质的量浓度为1.5 ml·L-1( )
6.25 ℃,pH=1的H2SO4溶液的物质的量浓度为0.1 ml·L-1( )7.同浓度的三种溶液:Na2SO4、MgSO4、Al2(SO4)3,其体积比为3∶2∶1,则 浓度之比为3∶2∶3( )
一、物质的量浓度与质量分数的计算1.标准状况下,V L氨气溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为c ml·L-1,则下列关系中不正确的是
气体溶于水,计算物质的量浓度的一般思路
2.已知某饱和NaCl溶液的体积为V mL,密度为ρ g·cm-3,质量分数为w,物质的量浓度为c ml·L-1,溶液中含NaCl的质量为m g。(1)用m、V表示溶液的物质的量浓度: 。
(2)用w、ρ表示溶液的物质的量浓度: 。
(3)用c、ρ表示溶质的质量分数: 。
(4)用w表示该温度下NaCl的溶解度: 。
4.200 mL 0.3 ml·L-1 K2SO4溶液和100 mL 0.2 ml·L-1 Fe2(SO4)3溶液混合后不考虑混合后溶液体积的变化,溶液中 的物质的量浓度为 。
一定物质的量浓度溶液的配制
1.容量瓶的构造及使用(1)构造及用途
质量百分比浓度、体积比浓度溶液的配制
(1)配制100 g 10%的NaCl溶液:用托盘天平称取10.0 g NaCl固体,放入200 mL烧杯中,再用100 mL量筒量取90.0 mL的蒸馏水注入烧杯中,然后用玻璃棒搅拌使之溶解。(2)用浓硫酸配制1∶4的稀硫酸50 mL:用50 mL的量筒量取40.0 mL的蒸馏水注入100 mL的烧杯中,再用10 mL的量筒量取10.0 mL浓硫酸,然后沿烧杯内壁缓缓注入烧杯中,并用玻璃棒不停地搅拌。
1.配制0.100 0 ml·L-1氯化钠溶液时,两次用玻璃棒的作用相同( )2.配制950 mL 2 ml·L-1 Na2CO3溶液时,应选1 000 mL容量瓶,称取Na2CO3·10H2O 572.0 g( )3.把0.585 g NaCl固体放入100 mL容量瓶中,加水到刻度线处,配成0.1 ml·L-1的NaCl溶液( )4.用量筒量取20.0 mL 0.500 0 ml·L-1 H2SO4溶液于烧杯中,加80.0 mL水,配制成0.100 0 ml·L-1 H2SO4溶液( )5.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小( )
一、一定物质的量浓度溶液的配制规范操作1.配制480 mL 0.5 ml·L-1的NaOH溶液,试回答下列问题。(1)选择仪器:完成本实验所必需的仪器有托盘天平、药匙、烧杯、玻璃棒、 、 等。(2)计算:需要NaOH固体的质量为 。
m(NaOH)=0.5 ml·L-1×0.5 L×40 g·ml-1=10.0 g。
(3)称量:①称量过程中NaOH固体应放在小烧杯中并放在天平的 (填“左盘”或“右盘”)。②某同学先用托盘天平称量一个小烧杯的质量,称量前把游码放在标尺的零刻度处,天平静止时发现指针在分度盘的偏右位置,说明此时左边质量 (填“大于”或“小于”)右边质量。假定最终称得小烧杯的质量为 (填“32.6 g”或“32.61 g”),请在下图标尺上画出游码的位置(画“△”表示)。标尺:
用托盘天平称量时,物品放在左盘,托盘天平可精确到0.1 g。
(4)溶解、冷却。该步实验中需要使用玻璃棒,作用是 。(5)转移、洗涤。在转移时应使用 引流,洗涤烧杯2~3次是为了_________ ___________________。(6)定容、摇匀。定容的操作是_____________________________________________________________________________________________。
向容量瓶中加入蒸馏水至距刻度线1~2 cm时,改用胶头滴管滴加蒸馏水至溶液的凹液面与刻度线相切
二、一定物质的量浓度溶液配制的误差分析
2.从溶质改变角度分析产生的误差(用“偏大”“偏小”或“无影响”填空)。(1)配制450 mL 0.1 ml·L-1的NaOH溶液,用托盘天平称取NaOH固体1.8 g: 。(2)配制500 mL 0.1 ml·L-1的硫酸铜溶液,用托盘天平称取胆矾8.0 g: 。
胆矾的摩尔质量为250 g·ml-1,所需质量为0.5 L×0.1 ml·L-1×250 g·ml-1=12.5 g。
(3)配制一定物质的量浓度的NaOH溶液,需称量溶质4.4 g,称量时物码放置颠倒: 。
实际称量溶质的质量为4.0 g-0.4 g=3.6 g。
(4)用量筒量取浓硫酸时,仰视读数: 。(5)定容时,加水超过刻度线,用胶头滴管吸取多余的液体至刻度线: 。(6)未洗涤烧杯及玻璃棒: 。
3.从溶液改变角度分析产生的误差(用“偏大”“偏小”或“无影响”填空)。(1)配制NaOH溶液时,将称量好的NaOH固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容: 。
NaOH溶于水放热,溶液的体积比室温时大,应恢复至室温后再移液、定容。
(2)定容摇匀后,发现液面下降,继续加水至刻度线: 。
(3)定容时仰视刻度线: 。(4)定容摇匀后少量溶液外流: 。(5)容量瓶中原有少量蒸馏水: 。
视线引起误差的分析方法
(1)仰视容量瓶刻度线[图(a)],导致溶液体积偏大,结果偏低。(2)俯视容量瓶刻度线[图(b)],导致溶液体积偏小,结果偏高。
1.(2023·全国甲卷,9)实验室将粗盐提纯并配制0.100 0 ml·L-1的NaCl溶液。下列仪器中,本实验必须用到的有①天平 ②温度计 ③坩埚 ④分液漏斗 ⑤容量瓶 ⑥烧杯 ⑦滴定管 ⑧酒精灯A.①②④⑥ B.①④⑤⑥C.②③⑦⑧ D.①⑤⑥⑧
粗盐提纯涉及的操作及使用的仪器有溶解(⑥烧杯和玻璃棒)、除杂、过滤(漏斗、玻璃棒、⑥烧杯)、蒸发结晶(蒸发皿、⑧酒精灯、玻璃棒)。配制0.100 0 ml·L-1的NaCl溶液的操作步骤及使用的仪器是称量(①天平)→溶解(⑥烧杯和玻璃棒)→移液(⑥烧杯、玻璃棒、⑤容量瓶)→定容(胶头滴管),故本题选D。
2.[2022·全国乙卷,27(1)]由CuSO4·5H2O配制CuSO4溶液,下列仪器中不需要的是 (填仪器名称)。
3.[2022·广东,17(2)]下列关于250 mL容量瓶的操作,正确的是 (填字母)。
振荡时应用瓶塞塞住容量瓶口,不可用手指压住容量瓶口,故A错误;定容时,视线、溶液凹液面和刻度线应“三线相切”,不能仰视或俯视,且胶头滴管不能插入到容量瓶中,故B错误;定容完成后,盖上瓶塞,左手食指抵住瓶塞,右手扶住容量瓶底部,将容量瓶反复上下颠倒,摇匀,故D错误。
4.[2022·海南,17(2)]现有浓H3PO4质量分数为85%,密度为1.7 g·mL-1。若实验需100 mL 1.7 ml·L-1的H3PO4溶液,则需浓H3PO4 mL(保留一位小数)。
1.实验中需用1.0 ml·L-1的CuSO4溶液950 mL,配制时选用容量瓶的规格和称取药品的质量分别为
配制1 000 mL溶液时,需要溶质CuSO4的质量为1 L×1.0 ml·L-1×160 g·ml-1=160.0 g,C项正确。
2.下列所得溶液的物质的量浓度为0.1 ml·L-1的是A.将0.1 ml氨充分溶解在1 L水中B.将10 g质量分数为98%的硫酸与990 g水混合C.将25.0 g胆矾溶于水配成1 L溶液D.将10 mL 1 ml·L-1的盐酸与90 mL水充分混合
将0.1 ml氨充分溶解在1 L水中,所得溶液的体积不是1 L,故不能得到0.1 ml·L-1的溶液,A错误;将10 g质量分数为98%的硫酸与990 g水混合,不知所配溶液的密度,无法求算其物质的量浓度,B错误;25.0 g胆矾的物质的量为0.1 ml,将其溶于水配成1 L溶液,所得溶液的物质的量浓度为0.1 ml·L-1,C正确;将10 mL 1 ml·L-1的盐酸与90 mL水充分混合,不同液体混合后的体积不等于两液体体积在数值上的简单加和,D错误。
3.取100 mL 0.3 ml·L-1和300 mL 0.25 ml·L-1的硫酸混合并稀释配成500 mL溶液,该混合溶液中H+的物质的量浓度是 ml·L-1 ml·L- ml·L-1 ml·L-1
4.用98%的浓H2SO4(密度为1.84 g·mL-1)配制100 mL1 ml·L-1的稀H2SO4,配制过程中可能用到下列仪器:①100 mL量筒;②10 mL量筒;③50 mL 烧杯;④托盘天平;⑤100 mL容量瓶;⑥胶头滴管;⑦玻璃棒。按使用的先后顺序排列正确的是A.②⑥③⑦⑤⑥ B.④③⑤⑦⑥C.①③⑦⑤⑥ D.②⑤⑦⑥
5.配制500 mL 0.100 ml·L-1的NaCl溶液,部分实验操作示意图如下:下列说法正确的是A.实验中需用的仪器有托盘天平、 250 mL容量瓶、烧杯、玻璃棒、 胶头滴管等B.上述实验操作步骤的正确顺序为 ①②④③C.容量瓶需要用自来水、蒸馏水洗涤,干燥后才可用D.定容时,仰视容量瓶的刻度线,使配得的NaCl溶液浓度偏低
配制500 mL 0.100 ml·L-1 NaCl溶液用到的仪器有托盘天平、药匙、烧杯、玻璃棒、500 mL容量瓶、胶头滴管等,A错误;配制一定物质的量浓度的溶液的步骤有计算、称量、溶解、转移、洗涤、定容、摇匀等,操作步骤正确的顺序为②①④③,B错误;容量瓶用蒸馏水洗净后,不必干燥,C错误;定容时仰视容量瓶的刻度线,则所加蒸馏水偏多,溶液的体积V偏大,溶液的浓度偏低,D正确。
7.将物质的量均为a ml的Na和Al一同投入m g足量水中,所得溶液的密度为ρ g·cm-3,则此溶液的物质的量浓度为
Na和Al一同投入m g足量水中时,发生反应的化学方程式为2Na+2H2O===2NaOH+H2↑、2Al+2NaOH+2H2O===2NaAlO2+3H2↑。由于Na、Al的物质的量均为a ml,结合化学方程式可知共生成2a ml H2,所得溶液中只有NaAlO2一种溶质,其物质的量为a ml。所得溶液的质量为m(Na)+m(Al)+m(H2O)-m(H2)=
8.(2023·湖南益阳模拟)下列说法正确的是A.0.1 ml·L-1的FeCl3溶液中,Cl-的物质的量为0.3 mlB.NA个HCl分子溶于水中配成1 L溶液,所得盐酸的浓度为1 ml·L-1C.将10 mL 2 ml·L-1 H2SO4与100 mL水混合,得到0.2 ml·L-1 H2SO4溶液D.将100 mL饱和NaCl溶液浓缩至80 mL,恢复到原温度,溶液的浓度升高
未指出溶液体积,无法计算溶质物质的量,A项错误;溶质HCl的物质的量为1 ml,溶液体积为1 L,则盐酸浓度为1 ml·L-1,B项正确;混合后溶液总体积并不是混合前的10倍,所以所得H2SO4溶液浓度不是0.2 ml·L-1,C项错误;温度不变物质溶解度不变,恢复到原温度,饱和溶液浓度不变,D项错误。
9.室温时,甲、乙两同学配制氯化钠溶液。甲同学配制10%的NaCl溶液100 g,乙同学配制1.0 ml·L-1的NaCl溶液100 mL(20 ℃时,氯化钠的溶解度为36.0 g)。下列说法正确的是A.两同学所需溶质的质量相同B.两同学所配溶液的质量相同C.两同学所需实验仪器种类相同D.甲同学所配的溶液浓度比乙同学的大
配制100 g 10%的NaCl溶液需要氯化钠的质量为100 g×10%=10 g,配制100 mL 1.0 ml·L-1的NaCl溶液需要氯化钠的质量为0.1 L×1.0 ml·L-1×58.5 g·ml-1=5.85 g,A错误;氯化钠溶液的密度大于1 g·mL-1,100 mL氯化钠溶液的质量大于100 g,B错误;配制一定质量分数的氯化钠溶液,所需仪器有托盘天平、量筒、烧杯、玻璃棒、药匙等;配制100 mL 1.0 ml·L-1的氯化钠溶液,需要的仪器有托盘天平、烧杯、玻璃棒、药匙、100 mL容量瓶、胶头滴管等,C错误;
10.4 ℃下,把摩尔质量为M g·ml-1的可溶性盐RCln A g溶解在V mL水中,恰好形成该温度下的饱和溶液,密度为ρ g·cm-3,下列关系式错误的是
11.(2023·天津模拟)现有V mL硫酸钠溶液,它的密度是ρ g·mL-1,其中钠离子的质量分数是a%,下列有关该溶液的说法错误的是
12.(2023·湖南邵阳模拟)实验室备有质量分数为63%、密度为1.40 g·cm-3的浓硝酸。下列说法错误的是A.该硝酸的物质的量浓度为14.0 ml·L-1B.某同学用该浓硝酸配制稀硝酸,定容时俯视读数,会造成最终配制的稀硝酸浓度 偏高C.50 mL该硝酸与足量的铜反应可得到标准状况下0.35 ml NO2D.等体积的水与该硝酸混合所得溶液的物质的量浓度大于7.0 ml·L-1
某同学用该浓硝酸配制稀硝酸,定容时俯视读数,溶液体积偏小,会造成最终配制的稀硝酸浓度偏高,B项正确;Cu与浓HNO3发生反应:Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O,硝酸浓度降低到某一浓度后,开始生成NO,不再生成NO2,50 mL该浓硝酸中,硝酸的物质的量n=0.05 L×14 ml·L-1=0.7 ml,由4HNO3~2NO2可知,生成NO2的物质的量小于0.35 ml,C项错误;等体积的水与该硝酸混合所得溶液的体积小于原硝酸体积的2倍,因此所得溶液的物质的量浓度大于7.0 ml·L-1,D项正确。
13.Ⅰ.绿矾(FeSO4·7H2O)在化学合成中用作还原剂及催化剂。工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾。(1)98% 1.84 g·cm-3的浓硫酸在稀释过程中,密度下降,当稀释至50%时,密度为1.4 g·cm-3,50%的硫酸物质的量浓度为 (结果保留两位小数),50%的硫酸与30%的硫酸等体积混合,混合酸的质量分数 (填“>”“<”或“=”)40%。
7.14 ml·L-1
假如50%的硫酸与30%的硫酸密度相同,则混合后硫酸的质量分数为40%,由于50%的硫酸的密度大于30%的硫酸的密度,所以等体积混合后溶液中硫酸的质量偏大,硫酸的质量分数大于40%。
(2)将111.2 g绿矾(FeSO4·7H2O,式量为278)在高温下加热,充分反应后生成Fe2O3固体和SO2、SO3、水的混合气体,则生成Fe2O3的质量为 g;SO2为 ml。
Ⅱ.实验室可用以下方法制备莫尔盐晶体[(NH4)2SO4·FeSO4·6H2O,式量为392]。(3)将4.88 g铁屑(含Fe2O3)与25 mL 3 ml·L-1 H2SO4充分反应后,得到FeSO4和H2SO4的混合溶液,稀释溶液至100 mL,测得其pH=1。铁屑中Fe2O3的质量分数是______(结果保留两位小数)。
根据题意知,溶液中剩余酸的物质的量n(H2SO4)=0.1 ml·L-1× ×0.1 L=0.005 ml,则参加反应的n(H2SO4)=0.025 L×3 ml·L-1-0.005 ml=0.07 ml;设铁的物质的量是m ml,氧化铁的物质的量是n ml,发生反应的化学方程式为Fe+Fe2O3+3H2SO4===3FeSO4+3H2O、Fe+H2SO4===FeSO4+H2↑,则根据固体的质量和硫酸的物质的量可知,56m+160n=4.88,m-n+3n=0.07,解得n=0.02,m=0.03,所以铁屑中Fe2O3的质量分数是 ×100%≈65.57%。
(4)向上述100 mL溶液中加入与该溶液中FeSO4等物质的量的(NH4)2SO4晶体,待晶体完全溶解后蒸发掉部分水,冷却至t ℃,析出莫尔盐晶体12.360 g,剩余溶液的质量为82.560 g。t ℃时,计算(NH4)2SO4·FeSO4·6H2O的溶解度为__________(结果保留两位小数)。
根据以上分析结合原子守恒知,n(FeSO4)=n(Fe)+2n(Fe2O3)=(0.03+0.04) ml=0.07 ml,根据莫尔盐的化学式知,n[(NH4)2SO4·FeSO4·6H2O]=n(FeSO4)=0.07 ml,溶液中莫尔盐的质量为0.07 ml×392 g·ml-1-12.360 g=15.08 g,设莫尔盐的溶解度为x,
14.人体血液里Ca2+的浓度一般采用mg·cm-3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用酸性KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。Ⅰ.配制酸性KMnO4标准溶液:如图是配制50 mL 0.020 ml·L-1酸性KMnO4标准溶液的过程示意图。
(1)请你观察图示并判断其中不正确的操作有____(填序号)。(2)其中确定50 mL溶液体积的容器是____________ (填名称)。
(3)在其他操作均正确的情况下,如果按照图示的操作配制溶液,配制溶液的浓度将_____(填“偏大”或“偏小”)。
用图示的操作配制溶液,定容时仰视刻度线,会使溶液体积偏大,配制的溶液浓度将偏小。
Ⅱ.测定血液样品中Ca2+的浓度:取血液样品20.00 mL,经过上述处理后得到草酸,再用0.020 ml·L-1酸性KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00 mL酸性KMnO4溶液。(4)已知草酸与酸性KMnO4溶液反应的离子方程式为5H2C2O4+ +6H+===2Mnx++10CO2↑+8H2O,则式中的x= 。(5)滴定时,根据现象:_____________________________________________________________________,即可确定反应达到终点。
当滴入最后半滴酸性KMnO4溶液,溶液由无色变为浅紫色,且半分钟内不褪色
(6)经过计算,血液样品中Ca2+的浓度为 mg·cm-3。
大单元一 第二章 第五讲 物质的量 气体摩尔体积-备战2025年高考化学大一轮复习课件(人教版): 这是一份大单元一 第二章 第五讲 物质的量 气体摩尔体积-备战2025年高考化学大一轮复习课件(人教版),文件包含大单元一第二章第5讲物质的量气体摩尔体积pptx、大单元一第二章第5讲物质的量气体摩尔体积教师版docx、大单元一第二章第5讲物质的量气体摩尔体积学生版docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
2025版高考化学一轮复习真题精练第二章物质的量第5练物质的量浓度课件: 这是一份2025版高考化学一轮复习真题精练第二章物质的量第5练物质的量浓度课件,共5页。
2024年高考化学一轮复习第二章第二节物质的量浓度课件: 这是一份2024年高考化学一轮复习第二章第二节物质的量浓度课件,共45页。PPT课件主要包含了分数为25%,答案1×,答案D,A①②③④,B③④②①,C③②④①,D③④①②,答案1B,②容量瓶的构造及使用,使用容量瓶的“五不”等内容,欢迎下载使用。












