


江西省宜春市丰城中学2023-2024学年高二下学期4月期中考试化学试题(原卷版+解析版)
展开本试卷总分值为100分 考试时长为75分钟
考试范围:选择性必修2、选择性必修3第一章至第三章第二节
可能用到的相对原子质量:H:1 C:12 O:16 Na:23 P:31 Fe:56 Br:80
一、单选题(每小题3分,共42分)
1. 中国传统文化博大精深,蕴含着丰富的化学知识。下列说法错误的是
A. “烟花卷陌,依约丹青屏障”中烟花绽放出的绚丽色彩跟原子核外电子跃迁有关
B. 和均属于离子晶体
C. 苏轼的《格物粗谈》中记载:“红柿摘下未熟,每篮用木瓜三枚放入,得气即发,并无涩味”,推测文中的“气”在水中能形成分子间氢键
D. 《淮南万毕术》中记载:“曾青得铁则化为铜”,铁位于元素周期表的第四周期Ⅷ族
【答案】C
【解析】
【详解】A.烟花绽放出绚丽色彩是金属元素核外电子从较高能级跃迁到较低能级时,以光的形式释放能量产生的,跟原子核外电子跃迁有关,故A正确;
B.硝酸钾和硫酸钠都是由阴、阳离子形成的离子晶体,故B正确;
C.由题意可知,文中的“气”为不溶于水的乙烯,不能与水分子形成分子间氢键,故C错误;
D.铁元素的原子序数为26,位于元素周期表的第四周期Ⅷ族,故D正确;
故选C。
2. NA是阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,11.2L氯仿含有氯原子1.5NAB. 31g白磷中共价键数目为3NA
C. 1 ml重水比1 ml水多NA个质子D. 12 g金刚石中含有2NA个C-C
【答案】D
【解析】
【详解】A.氯仿,CHCl3,在标准状况下是液体,不能利用22.4L·ml-1来计算其物质的量,A错误;
B.白磷,P4,其空间结构如图所示:,1ml白磷含有6ml共价键。31g白磷,其物质的量为,则含有共价键的物质的量为0.25ml×6=1.5ml,则含有共价键的数目为1.5NA,B错误;
C.重水,D2O,1个D2O分子含有10个质子;水,H2O,1个水分子中含有10个质子;则1ml重水和1ml水的质子一样多,C错误;
D.在金刚石中,1个C原子形成4根C-C,1个C—C键周围有2个C原子,可知C原子和C-C的个数比例为1:2,因此12g金刚石,即1ml金刚石中含有2mlC-C,其数目为2NA,D正确;
答案选D。
3. 下列化学用语或表述正确的是
A. 的电子式:
B. 的VSEPR模型:
C. 的名称:2-甲基丙醇
D. 激发态的硼原子轨道表示式:
【答案】B
【解析】
【详解】A.是离子化合物,电子式为:[H:]-Mg2+[:H]-,A错误;
B.中心原子价层电子对数为3+=4,VSEPR模型为四面体形:,B正确;
C.的名称:2-丁醇,C错误;
D.基态B原子电子排布式为1s22s22p1,电子跃迁到更高的能级形成激发态的硼原子,属于基态B原子,D错误;
故选B。
4. 下列物质性质与用途具有对应关系的是
A. 乙醇具有特殊香味,医用酒精常用作消毒剂
B. CH4具有还原性,可以做燃料电池的负极气体
C. C2H4具有可燃性,可用作催熟剂
D. 乙炔是一种无色气体,可聚合为聚乙炔
【答案】B
【解析】
【详解】A.乙醇具有特殊香味,和用作消毒剂无对应关系,A错误;
B.CH4具有还原性,可做燃料电池的负极气体有对应关系,B正确;
C.C2H4具有可燃性可用作燃料,与用作催熟剂无对应关系,C错误;
D.乙炔是一种无色气体,与可聚合为聚乙炔无对应关系,D错误;
故选B。
5. 下列有机物的转化或方程式的书写正确的是
A. 逐步被氧气氧化:
B. 实验室制备溴苯:+Br2+HBr
C. 溴乙烷水解:
D. 向苯酚钠溶液中通入:2+CO2+H2O→2+Na2CO3
【答案】B
【解析】
【详解】A.,得不到丙醛与丙酸,A错误;
B.实验室制备溴苯:+Br2+HBr,B正确;
C.溴乙烷水解:,C错误;
D.向苯酚钠溶液中通入:+CO2+H2O→+NaHCO3,D错误;
故选B。
6. 用价层电子对互斥模型可以判断许多分子或离子的空间结构,有时也能用来推测键角大小,下列判断正确的是
A. 中心原子的价层电子对数为3,是平面三角形结构
B. 键角大小顺序为
C. 是三角锥形分子
D. 、都是三角锥形的分子
【答案】B
【解析】
【详解】A.中心原子S价层电子对数:,含1对孤电子对,是三角锥形结构,A错误;
B.和中心原子均价层电子对数均为3,中心原子含1对孤电子对,键角:,和中心原子价层电子对数均为4,中心原子含1对孤电子对,中心原子含2对孤电子对,键角:,即键角:,B正确;
C.中心原子C价层电子对数:,无孤电子对,是平面三角形结构,C错误;
D.中心原子P价层电子对数:,含1对孤电子对,是三角锥形结构,中心原子S价层电子对数:,无孤电子对,是平面三角形结构,D错误;
答案选B。
7. NH4NO3、Pb(N3)2、N5AsF6、2,4,6-三硝基甲苯均可用作炸药。下列关于它们的说法正确的是
A. NH4NO3是一种常见的炸药,其分解反应为2NH4NO32N2↑+O2↑+4H2O↑,上述反应中,每生成0.15mlO2转移电子数为0.6NA
B. 的中心原子N的杂化方式为sp杂化
C. 基态As原子的价层电子中成对电子数与未成对电子数的比值为12∶3
D. NH4NO3、Pb(N3)2、N5AsF6、2,4,6-三硝基甲苯形成的晶体均为离子晶体
【答案】B
【解析】
【详解】A.由方程式可知,反应中铵根离子中氮元素和硝酸根离子中的氧元素化合价升高被氧化,硝酸根离子中氮元素化合价降低被还原,反应生成1ml氧气时,转移电子的物质的量为10ml,则生成0.15ml氧气时,转移电子数目为1.5NA,故A错误;
B.与CO2的原子个数都为3、价电子数都为16,互为等电子体,等电子体的中心原子的杂化方式相同,CO2中碳原子的价层电子对数为2,原子的杂化方式为sp杂化,则中氮原子的杂化方式为sp杂化,故B正确;
C.砷元素的原子序数为33,价层电子排布式为4s24p3,成对电子数与未成对电子数的比值为2∶3,故C错误;
D.2,4,6-三硝基甲苯为分子晶体,故D错误;
故选B。
8. 已知、、、、是原子序数依次增大的五种短周期元素,和组成的一种化合物具有强氧化性,可用于自来水消毒,五种元素形成的某种化合物结构如图,下列说法正确的是
A. 原子半径:
B. 简单氢化物的沸点:
C. 单质均为非极性分子
D. 和组成的化合物可能含有非极性键
【答案】D
【解析】
【分析】X、Y、Z、W、R是原子序数依次增大的五种短周期元素,由结构可知,化合物中X、Y、Z、W、R形成共价键的数目分别为1、4、3、2、1,W和R组成的一种化合物具有强氧化性,可用于自来水消毒,则X为H元素、Y为C元素、Z为N元素、W为O元素、R为Cl元素。
【详解】A.同周期元素,从左到右原子半径依次减小,则氧原子、氮原子、碳原子的原子半径依次增大,故A错误;
B.水分子能形成分子间氢键,氯化氢不能形成分子间氢键,所以水的分子间作用力大于氯化氢,沸点高于氯化氢,故B错误;
C.二氧化氯是分子结构不对称的V形,属于极性分子,故C错误;
D.肼分子的分子式为N2H4,N2H4是含有极性键和非极性键的极性分子,故D正确;
故选D。
9. 下列有机物分子中,所有的原子不可能都处于同一平面的是
A. CH2=CH2B. CH2=CH—CH=CH2
C. D.
【答案】D
【解析】
【详解】A.CH2=CH2是乙烯分子,乙烯是平面结构,所以该分子中所有原子可能在同一平面上,故A不选;
B.CH2=CH—CH=CH2相当于乙烯分子中的一个氢原子被乙烯基取代,不改变原来的平面结构,乙烯基的所有原子在同一个面上,这两个平面可以是一个平面,所有原子可能都处在同一平面上,故B不选;
C.乙烯和苯都是平面型分子,所有原子可能都在同一平面内,故C不选;
D.该分子中存在甲基,甲基中所有原子不可能在同一平面上,故D选;
故选D。
10. 下列说法不正确的是
A. C7H16含三个甲基的同分异构体有3种
B. 以表示的有机物共有20种(不含立体异构)
C. 分子式为C4H8BrCl的有机化合物共有14种(不含立体异构)
D. 分子式为C5H12O属于醇的同分异构体有8种
【答案】C
【解析】
【详解】A.C7H16含三个甲基的同分异构体有3种,若碳链为6,甲基存在 2种,若碳链为5,则乙基只能在3号碳1种,共3种,A正确;
B.丁基存4种情况,-C3H6Cl中氯存在5种情况,共4×5=20种情况,B正确;
C.,分子式为C4H8BrCl的有机化合物共有12种,C错误;
D.戊基存在8种情况,分子式为C5H12O属于醇,则其同分异构体有8种,D正确;
故选C。
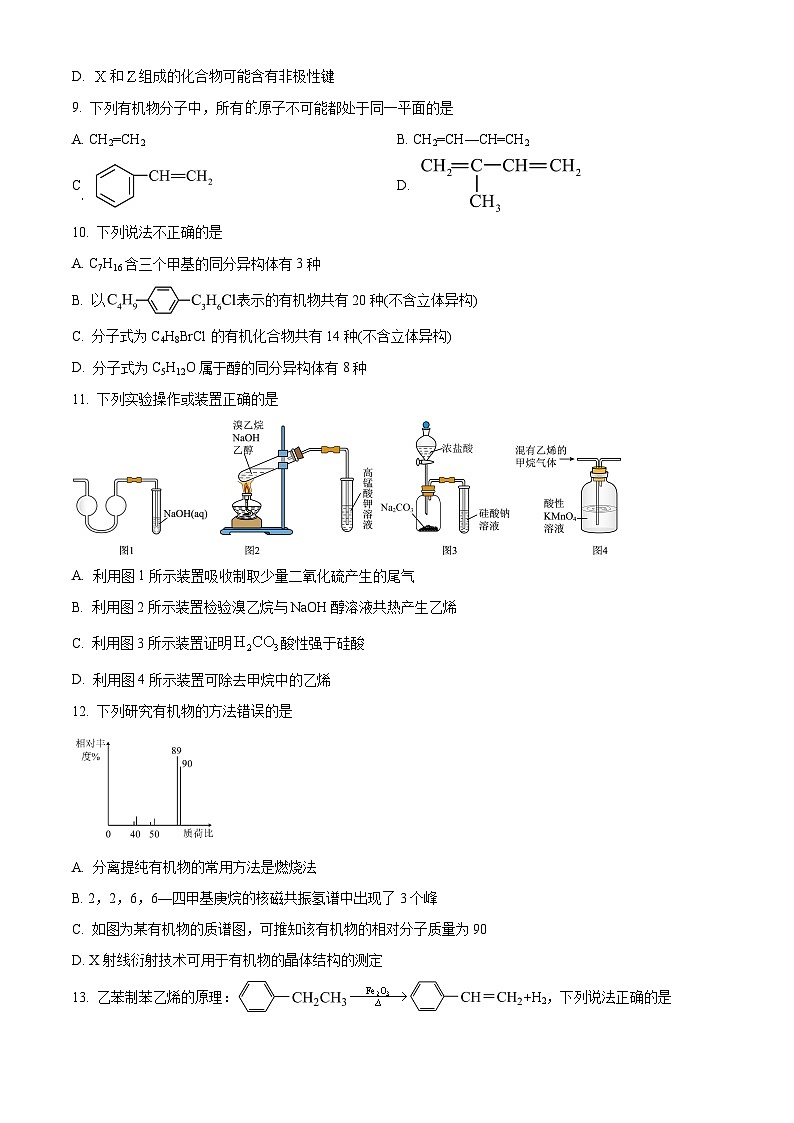
11. 下列实验操作或装置正确的是
A. 利用图1所示装置吸收制取少量二氧化硫产生的尾气
B. 利用图2所示装置检验溴乙烷与NaOH醇溶液共热产生乙烯
C. 利用图3所示装置证明酸性强于硅酸
D. 利用图4所示装置可除去甲烷中的乙烯
【答案】A
【解析】
【详解】A.二氧化硫有毒,易溶于水,二氧化硫与氢氧化钠溶液反应生成亚硫酸钠和水,可用图1所示装置吸收少量二氧化硫尾气并防止倒吸,A正确;
B.乙醇有挥发性,且可以使酸性高锰酸钾溶液褪色,则不能用该装置检验溴乙烷与NaOH醇溶液共热产生乙烯,B错误;
C.盐酸易挥发,盐酸与碳酸钠反应生成的二氧化碳中混有氯化氢气体,硅酸钠溶液变浑浊不能说明H2CO3酸性强于硅酸,C错误;
D.乙烯和高锰酸钾反应生成二氧化碳,会使甲烷中混入二氧化碳,D错误;
故选A。
12. 下列研究有机物的方法错误的是
A. 分离提纯有机物的常用方法是燃烧法
B. 2,2,6,6—四甲基庚烷核磁共振氢谱中出现了3个峰
C. 如图为某有机物的质谱图,可推知该有机物的相对分子质量为90
D. X射线衍射技术可用于有机物的晶体结构的测定
【答案】A
【解析】
【详解】A.燃烧法是研究确定有机物成分的常用方法,但不是分离提纯有机物的方法,A错误;
B.2,2,6,6—四甲基庚烷分子中氢原子的类型为3,则核磁共振碳谱中会出现了3个峰,B正确;
C.由图可知,有机物的质荷比最大值为90 ,则有机物的相对分子质量为90,C正确;
D.X射线衍射技术可用于有机物的晶体结构的测定,D正确;
答案选A。
13. 乙苯制苯乙烯的原理:+H2,下列说法正确的是
A. 该反应是加成反应B. 乙苯的同分异构体有3种
C. 可用KMnO4(H+)鉴别乙苯和苯乙烯D. 苯乙烯分子中最多有8个碳原子共平面
【答案】D
【解析】
【详解】A.该反应消去小分子H2,形成不饱和键(碳碳双键),属于消去反应,A错误;
B.乙苯的不饱和度为4,含苯环的同分异构体有邻二甲苯、间二甲苯、对二甲苯共3种,还有不含苯环的同分异构体,故乙苯的同分异构体多于3种,B错误;
C.乙苯和苯乙烯均能使KMnO4(H+)溶液褪色,故不可用KMnO4(H+)鉴别乙苯和苯乙烯,C错误;
D.苯环和乙烯均是平面型分析,单键可旋转,则苯乙烯中所有C原子均可能共面,即苯乙烯分子中最多有8个碳原子共平面,D正确;
选D。
14. 锂硒电池是一种能量密度很高的新型可充电电池,其正极材料的晶胞结构如图。已知晶胞参数为a pm,下列说法不正确的是
A. Se位于元素周期表中的p区B. 基态最外层电子的电子云轮廓图为哑铃型
C. 每个周围距离相等且最近的有4个D. 与之间最近的距离为pm
【答案】B
【解析】
【详解】A.Se位于第4周期第Ⅵ族,位于周期表P区,A正确;
B.锂离子电子排布式1S2,最外层电子位于S轨道,球形,B错误;
C.根据晶胞结构以及均摊法计算出:Se2-位于顶点及面心,Li+位于体心,则距Li+最近的Se2-位于顶点及3个面心,共4个,C正确;
D. Li+位于体对角线处,且与顶点处Se2-距离最近,二者距离为,D正确;
故答案选B。
二、非选择题(每空2分,共58分)
15. 请按要求回答下列问题:
(1)系统命名为________。
(2)三元乙丙橡胶的一种单体的键线式为,它的分子式为_______。
(3)A的化学式为,已知A只有一种类型的氢原子:则A的结构简式为_______。
(4)某烃的分子式为,其能使酸性高锰酸钾溶液褪色,写出该物质生成高分子化合物的反应方程式______ ,此反应类型为______。
(5)请写出环己烷()与在光照条件下生成一氯环己烷的化学方程式_______。
(6)烯烃与酸性高锰酸钾溶液反应的氧化产物有如下的反应关系:
+R3COOH
已知某烯烃的化学式为,它与酸性高锰酸钾溶液反应后得到的产物若为乙酸和丙酸,则此烯烃的结构简式是______。
【答案】(1)3,3,6−二甲基辛烷
(2)C9H12 (3)
(4) ①. nCH3CH=CH2 ②. 加聚反应
(5)+Cl2+HCl
(6)CH3CH=CHCH2CH3
【解析】
【小问1详解】
最长碳链有8个碳,从右边编碳号,则其名称为3,3,6−二甲基辛烷。
【小问2详解】
根据题键线式可知,每个拐点、交点、端点、起点都是一个碳原子,碳原子应该是连接四根共价键,因此其分子式为C9H12,;
【小问3详解】
若A只有一种类型的氢原子,则A的结构简式为;
【小问4详解】
能使酸性高锰酸钾溶液褪色,说明其中含有碳碳双键,则为丙烯,丙烯加聚的方程式为nCH3CH=CH2;反应类型为加聚反应。
【小问5详解】
环己烷与在光照条件下生成一氯环己烷和氯化氢,其化学方程式为:+Cl2+HCl。
【小问6详解】
由所给信息知,双键碳原子被KMnO4氧化可能生成-COOH、CO2、等结构,即-COOH、CO2、三种结构中碳原子为原本烯烃中形成碳碳双键的碳原子,故产物CH3COOH与CH3CH2COOH对应烯烃为CH3CH=CHCH2CH3。
16. 元素及其化合物因其结构差异导致性质各异。请回答:
(1)某激发态磷原子的电子排布式为,该磷原子中有____种空间运动状态不同的电子。
(2)NCl3的空间结构为_____,和BCl3相比二者中沸点更高的物质是_____,第一电离能介于B、N之间的第二周期元素有_____种。
(3)M是氮杂氟硼二吡咯类物质,常用作光敏剂,其结构如图。
已知虚线框内五元环结构类似苯,存在五中心六电子离域大键,则虚线框中氮元素采用杂化方式为____,M中存在的微粒间作用力有____ (填标号)。
A.共价键 B.离子键 C.氢键 D.配位键
(4)FeS2晶体的晶胞形状为立方体,边长为anm,结构如图。
①距离Fe2+最近的阴离子有____个。
②FeS2的摩尔质量为120g∙ml-1,阿伏加德罗常数为NA.该晶体的密度为____ g∙cm-3。
【答案】(1)10 (2) ①. 三角锥形 ②. NCl3 ③. 3
(3) ①. sp2 ②. AD
(4) ①. 6 ②.
【解析】
【小问1详解】
某激发态磷原子的电子排布式为,则该磷原子的核外电子所占据轨道为1+1+3+1+3+1=10,故有10种空间运动状态不同的电子,故答案为:10。
【小问2详解】
NCl3分子中,N原子的价层电子对数为4,发生sp3杂化,则空间结构为三角锥形;NCl3和BCl3都是分子晶体,分子间都不能形成氢键,NCl3为极性分子且相对分子质量大于BCl3,故NCl3分子间范德华力更强,熔沸点更高,所以和BCl3相比二者中沸点更高的物质是NCl3;Be的2p轨道全空,其第一电离能高于B,N的2p轨道半充满,其第一电离能高于O,则第一电离能介于B、N之间的第二周期元素有Be、C、O共3种,故答案为:三角锥形;NCl3;3。
【小问3详解】
环上N原子价层电子对数为3,采取sp2杂化,该环N原子价层孤对电子填充在2sp轨道;原子之间存在共价键,环上N原子与B原子之间形成配位键,故答案为:sp2;AD。
【小问4详解】
FeS2晶体中,含Fe2+的数目为=4,含数目为=4,晶胞形状为立方体,边长为anm。
①选取1个顶点Fe2+为研究对象,距离Fe2+最近的位于棱的中点,共有6个。
②FeS2的摩尔质量为120g∙ml-1,阿伏加德罗常数为NA。该晶体的密度为:= g∙cm-3,故答案为:6;。
17. 1-溴丁烷可用于合成抗胆碱药物、制备压敏色素、热敏色素等功能性色素,是一种重要的化工原料。可通过如图方法制备: CH3CH2CH2CH2OH+HBrCH3CH2CH2CH2Br+H2O,NaBr+H2SO4HBr↑+NaHSO4.
实验装置如图所示(夹持、加热装置已略去),步骤如下:
Ⅰ.在圆底烧瓶中加入15mL水,滴入20mL浓硫酸,混合冷却至室温后,加入7.5mL正丁醇,混合均匀。
Ⅱ.加入15g研细的NaBr,充分摇动,加入沸石,加热回流40min。
Ⅲ冷却,改用蒸馏装置,蒸出1-溴丁烷粗品。
Ⅳ.粗品倒入分液漏斗中,经水洗、浓硫酸洗、水洗、Na2CO3溶液洗、水洗后,分液,加入无水CaCl2干燥。
Ⅴ.蒸馏,得到8.0g产品。
已知相关物质信息:
回答下列问题:
(1)仪器A的名称是_______,B的作用是_______,其中导管不能伸入液面以下的原因是______。
(2)实验装置中应选用的圆底烧瓶规格为_______。
A. 25mLB. 50mLC. 100mLD. 250mL
(3)步骤Ⅰ~Ⅱ中,所用硫酸浓度不宜过高,混合后需冷却至室温,加入NaBr后充分摇动。这些操作是为了避免生成_____(任填一种物质的化学式)。
(4)写出一个本实验可能发生的有机副反应化学方程式______。
(5)步骤Ⅳ中,用Na2CO3溶液洗去________。
【答案】(1) ①. 球形冷凝管 ②. 吸收尾气,防止污染空气 ③. 防止液体倒吸 (2)C
(3)Br2或C4H8或C8H18O或SO2
(4)CH3CH2CH2CH2OH CH3CH2CH=CH2+H2O或2CH3CH2CH2CH2OH CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
(5)洗去残留的硫酸、溴单质
【解析】
【分析】1-丁醇与HBr发生取代反应得到1-溴丁烷,可能发生的副反应有NaBr与浓硫酸发生氧化还原反应得到Br2、SO2等、1-丁醇发生消去反应得到1-丁烯、1-丁醇发生取代反应得到丁醚等,制得1-溴丁烷粗品,粗品的主要成分为1-溴丁烷,还含有正丁醇、NaHSO4、Br2、HBr、(CH3CH2CH2CH2)2O、H2O等;1-溴丁烷粗品先用15mL水洗去溶于水的物质,接着用浓硫酸除去正丁醇,再用水除去硫酸,用饱和碳酸钠除去少量硫酸和Br2,接着水洗除去溶于水的钠盐,分液后有机相用无水氯化钙除去H2O,最后蒸馏收得到纯1-溴丁烷。
【小问1详解】
仪器A的名称是球形冷凝管,反应中浓硫酸具有强氧化性,可能生成副产物溴单质,B的作用是吸收挥发的正丁醇、HBr、溴单质,防止造成空气污染,其中导管不能伸入液面以下的原因是防止液体倒吸;
【小问2详解】
在圆底烧瓶中加入15mL水,滴入20mL浓硫酸,混合冷却至室温后,加入7.5mL正丁醇,混合均匀,液体总体积为42.5mL,烧瓶中所盛放液体不能超过其容积的三分之二,也不能少于其容积的三分之一,则应选用的圆底烧瓶规格为C. 100mL;
【小问3详解】
浓硫酸具有强氧化性,会将溴离子氧化为溴单质,降低产品产率,故步骤Ⅰ~Ⅱ中,所用硫酸浓度不宜过高,混合后需冷却至室温,加入NaBr后充分摇动。这些操作是为了避免生成Br2或C4H8或C8H18O或SO2;
【小问4详解】
正丁醇在浓硫酸催化作用下会发生消去反应生成1-丁烯:CH3CH2CH=CH2,反应为CH3CH2CH2CH2OHCH3CH2CH=CH2+H2O;或发生取代反应生成醚,反应为2CH3CH2CH2CH2OHCH3CH2CH2CH2OCH2CH2CH2CH3+H2O;
【小问5详解】
碳酸钠溶液显碱性能和副产物溴单质反应,也能和酸反应,故步骤Ⅳ中,用Na2CO3溶液洗去残留的硫酸、溴单质。
18. 丙炔可以发生下列物质转化,结合已知信息,回答下列问题:
已知:①3HC≡CH
②(R、R′ 为烃基或氢原子)
(1)丙炔可由下列哪种金属碳化物与水反应制得________。
A. Li2C2B. ZnC2C. Al4C3D. Mg2C3
(2)写出W的官能团名称:________。①的反应类型:_________,写出反应②的化学方程式:________。
(3)物质 M是丙炔的同系物且同时满足以下三个条件,写出M的系统命名________。
①质谱图中最大质荷比为82;②主链4个碳;③分子中存在三个甲基。
(4)物质Y在光照条件下的一氯代物有_______种,物质Y完全氢化后的产物核磁共振氢谱的峰面积比为________。
【答案】(1)D (2) ①. 碳碳双键、碳溴键(溴原子) ②. 加成反应 ③. nBrCH=CHCH3
(3)3,3-二甲基-1-丁炔
(4) ①. 1 ②. 3:2:1
【解析】
【分析】丙炔和溴发生加成反应生成W为CH3CBr=CHBr,发生加聚反应后生成高分子化合物X,结合Z可知,Y为,以此解题。
【小问1详解】
A.2个锂离子消耗2个氢氧根离子,含碳基团与氢离子结合得到C2H2乙炔,故A错误;
B.1个锌离子消耗2个氢氧根离子,含碳基团与氢离子结合得到C2H2乙炔,故B错误;
C.4个铝离子消耗12个氢氧根离子,含碳基团与氢离子结合得到C3H12,实际得到CH4,故C错误;
D.2个镁离子消耗4个氢氧根离子,含碳基团与氢离子结合得到C3H4丙炔,故D正确;
故选D;
【小问2详解】
由分析可知,W为CH3CBr=CHBr,其中存在官能团为:碳碳双键、碳溴键(溴原子);其中的顺式结构为:;①的反应类型为丙炔和溴的加成反应;反应②为CH3CBr=CHBr的加聚反应,方程式为:;
【小问3详解】
物质M是丙炔的同系物,质谱图中最大质荷比为82,则其分子式为:C6H10,主链4个碳;分子中存在三个甲基,则M为,名称为3,3-二甲基-1-丁炔;
【小问4详解】
由分析可知,Y为,光照时甲基上的氢被取代,其一氯代物有1种;其完全氢化后为,其核磁共振氢谱的峰面积比为3:2:1。物质
性状
密度/(g•cm3)
沸点/℃
溶解性
1-溴丁烷
无色液体
1.28
101.6
不溶于水,易溶于醇、醚
正丁醇
无色液体
0.80
117.6
微溶于水,溶于醇、醚
※醇、醚易溶于浓硫酸。
江西省宜春市丰城中学2023-2024学年高一下学期4月期中考试化学试题(原卷版+解析版): 这是一份江西省宜春市丰城中学2023-2024学年高一下学期4月期中考试化学试题(原卷版+解析版),文件包含江西省宜春市丰城中学2023-2024学年高一下学期4月期中考试化学试题原卷版docx、江西省宜春市丰城中学2023-2024学年高一下学期4月期中考试化学试题解析版docx等2份试卷配套教学资源,其中试卷共27页, 欢迎下载使用。
江西省宜春市丰城中学2023-2024学年高二下学期4月期中考试化学试题(含答案): 这是一份江西省宜春市丰城中学2023-2024学年高二下学期4月期中考试化学试题(含答案),文件包含丰城中学2023-2024学年下学期高二期中考试化学试卷docx、高二化学参考答案docx等2份试卷配套教学资源,其中试卷共9页, 欢迎下载使用。
江西省宜春市丰城市第九中学2023-2024学年高二下学期4月月考化学试题(原卷版+解析版): 这是一份江西省宜春市丰城市第九中学2023-2024学年高二下学期4月月考化学试题(原卷版+解析版),文件包含江西省宜春市丰城市第九中学2023-2024学年高二下学期4月月考化学试题原卷版docx、江西省宜春市丰城市第九中学2023-2024学年高二下学期4月月考化学试题解析版docx等2份试卷配套教学资源,其中试卷共27页, 欢迎下载使用。