

- 2.7 氯离子的检验(精讲)-2024-2025学年高一化学上学期常考题型精讲与精练高分突破(人教版) 试卷 0 次下载
- 2.8 气体摩尔体积与阿伏加德罗定律(精练)-2024-2025学年高一化学上学期常考题型精讲与精练高分突破(人教版) 试卷 1 次下载
- 2.9 有关阿伏加德罗常数的正误判断(精练)-2024-2025学年高一化学上学期常考题型精讲与精练高分突破(人教版) 试卷 1 次下载
- 2.9 有关阿伏加德罗常数的正误判断(精讲)-2024-2025学年高一化学上学期常考题型精讲与精练高分突破(人教版) 试卷 1 次下载
- 2.10 有关物质的量浓度的计算(精练)-2024-2025学年高一化学上学期常考题型精讲与精练高分突破(人教版) 试卷 1 次下载
高中第三节 物质的量精练
展开核心要点
1.了解气体摩尔体积的概念,并进行相关计算。
2.了解阿伏伽德罗定律,并能得出推论。能够应用阿伏伽德罗定律及其推论解决有关物质的量的计算问题。
能力构建
一、气体摩尔体积
1.
2.影响因素
气体摩尔体积的数值取决于气体所处的温度和压强。温度越高,体积越大;压强越大,体积越小。
3.标准状况下气体摩尔体积的涵义
(1)状态:气体(单一气体或混合气体)。
(2)条件:标准状况(0 ℃、1.01×105 Pa)。
(3)定量:1 ml。
(4)数值:约22.4,非精确值。
(5)表示:Vm≈22.4 L/ml。
(6)气体摩尔体积为22.4 L/ml时也可能是非标况。
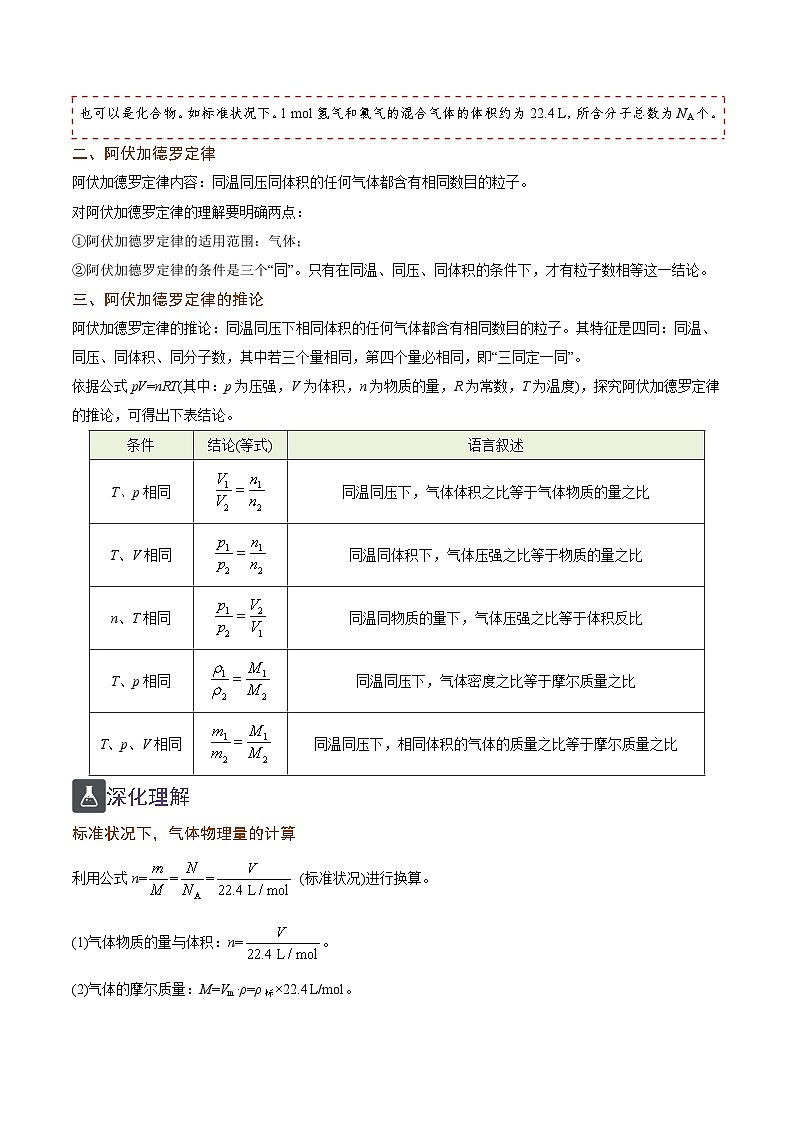
二、阿伏加德罗定律
阿伏加德罗定律内容:同温同压同体积的任何气体都含有相同数目的粒子。
对阿伏加德罗定律的理解要明确两点:
①阿伏加德罗定律的适用范围:气体;
②阿伏加德罗定律的条件是三个“同”。只有在同温、同压、同体积的条件下,才有粒子数相等这一结论。
三、阿伏加德罗定律的推论
阿伏加德罗定律的推论:同温同压下相同体积的任何气体都含有相同数目的粒子。其特征是四同:同温、同压、同体积、同分子数,其中若三个量相同,第四个量必相同,即“三同定一同”。
依据公式pV=nRT(其中:p为压强,V为体积,n为物质的量,R为常数,T为温度),探究阿伏加德罗定律的推论,可得出下表结论。
深化理解
标准状况下,气体物理量的计算
利用公式n=== (标准状况)进行换算。
(1)气体物质的量与体积:n=。
(2)气体的摩尔质量:M=Vm·ρ=ρ标×22.4 L/ml。
(3)气体的分子数与体积:N=n·NA=·NA。
(4)气体质量与体积:m=n·M=·M=ρ标·V。
典型例题
例1 设NA为阿伏加德罗常数的值,判断正误,正确的画“√”,错误的画“×”。
(1)22.4L(标准状况)氩气含有的质子数为18NA(____)
(2)标准状况下,11.2L甲烷(CH4)和乙烯(C2H4)混合物中含氢原子数目为2NA(____)
(3)同等质量的氧气和臭氧中,电子数相同(____)
(4)标准状况下,2.24LN2和O2的混合气体中分子数为0.2NA(____)
(5)1mlCO和N2的混合气体中质子数为14NA(____)
(6)14g乙烯(C2H4)和丙烯(C3H6)混合气体中的氢原子数为2NA(____)
(7)常温常压下,22.4LCl2中含有的分子数为6.02×1023个(____)
(8)标准状况下,5.6LCO2气体中含有的氧原子数为0.5NA(____)
(9)标准状况下,22.4LN2和H2混合气中含NA个原子(____)
【答案】对 对 对 错 对 对 错 对 错
【解析】
(1)Ar为单原子分子,含有的质子数为18,标准状况下22.4 L氩气的物质的量是1ml,含有的质子数为18NA,故答案为:对;
(2) 甲烷和乙烯都含有4个氢原子,标准状况下,11.2 L甲烷和乙烯混合物的物质的量为0.5ml,含有氢原子数目为2NA,故答案为:对;
(3) O2和O3的最简式相同,等质量的O2和O3中含有等物质的量的氧原子,含有的电子数相同,故答案为:对;
(4)标准状况下,2.24L L N2和O2的混合气体的物质的量为0.1ml,所含分子数为0.1NA,故答案为:错;
(5)1个CO分子和1个N2分子中均含14个质子,则1ml CO和N2的混合物中含有的质子数为14NA,故答案为:对;
(6) 乙烯和丙烯的最简式相同,14g乙烯和14 g丙烯中氢原子的物质的量均为2ml,则14 g混合气体中含氢原子数目为2 NA,故答案为:错;
(7)常温常压下,22.4 L Cl2的物质的量不是1ml,含有的分子数不是6.02×1023个,故答案为:错;
(8)标准状况下 ,5.6 L CO2的物质的量为0.25ml,含有的氧原子的物质的量为0.5ml,则含有氧原子数为0.5 NA,故答案为:对;
(9) 标准状况下,22.4 L N2和H2混合气的物质的量是1ml,所含原子的个数为2 NA,故答案为:错。
例2 (1)在标准状况下,CO和CO2的混合气体共8.96 L,质量为12.8 g,则两种气体的物质的量之和为_______ml,其中CO2为_______ml,CO占总体积的_______,混合气体的摩尔质量为_______。
(2)同温同压下,同体积的甲烷(CH4)和二氧化碳分子数之比为________,物质的量之比为________,原子总数之比为________,质量之比为________,密度之比为________。
(3)在标准状况下,4 g H2、11.2 L O2、1 ml H2O中,所含分子数最多的是________,含原子数最多的是________,质量最大的是________,体积最小的是________。
【答案】(1)0.4 0.1 eq \f(3,4) 32 g·ml−1 (2)1∶1 1∶1 5∶3 4∶11 4∶11 (3)H2 H2 H2O H2O
【解析】(1)混合气体物质的量==0.4 ml;则混合气体的摩尔质量M==32 g·ml−1;设混合气体中CO、CO2的物质的量分别为x ml、y ml,则有 解之得x=0.3,y=0.1,V(CO)=0.3 ml×22.4 L/ml=6.72 L,故占=。
(2)同温同压下,同体积的CH4和CO2具有相同数目的分子,两者物质的量也相等,故原子个数之比为5∶3,质量比为16∶44=4∶11,密度之比等于摩尔质量之比=16∶44=4∶11。
(3)三种物质的物质的量分别为2 ml、0.5 ml、1 ml,物质的量最大的,分子数最多,是H2;三种物质所含原子的物质的量分别为4 ml、1 ml、3 ml,故原子数最多的是H2;三种物质的质量分别为4 g、16 g、18 g,故质量最大的是H2O;因在标准状况下只有水不是气体,故体积最小的是H2O。
学会了吗
1.(2021·黔西南州同源中学高一期中)某气体分子由三原子构成,其摩尔质量为M g/ml,该气体质量为m g,阿伏加德罗常数为NA,则:
(1)该气体的物质的量为___________ml;
(2)该气体在标准状况下的体积为___________L;
(3)该气体在标准状况下的密度为___________g/L;
(4)该气体所含原子总数为___________个;
(5)该气体的一个分子的质量为___________g。
【答案】
【分析】
根据物质的量与质量、气体的体积、微粒数目,结合物质的分子构成等关系式进行计算。
【解析】
(1)该气体的物质的量n=ml;
(2)该气体在标准状况下的体积V=n·Vm=ml×22.4 L/ml=L;
(3)该气体在标准状况下的密度ρ= g/L;
(4)该气体的物质的量n=ml,由于物质一个分子中含有3个原子,则其中所含的原子总数为N(原子)=ml×NA/ml×3=;
(5)该气体质量为m g,其物质的量n=ml,所含分子数目为,则一个分子的质量m(分子)= g。
2.(2020·安徽省太湖中学高一期末)关于O2与O3气体,下列比值一定为2:3的是
A.若两种气体所占体积相同,两种气体的质量之比
B.若温度及压强相同,两种气体的密度之比
C.若两种气体原子数相同,两种气体的质子数之比
D.若两种气体的质量相同,两种气体的分子数之比
【答案】B
【解析】A.如不在相同条件下,相同体积的两种气体的物质的量不一定相同,则质量比不一定等于2:3,错误;
B.温度和压强相同,Vm相同,由ρ=可知,两种气体的密度之比等于摩尔质量之比,等于2:3,正确;
C.两种气体都由O原子组成,则两种气体原子数相同,两种气体的质子数相同,错误;
D.两种气体的质量相同,由n=可知,两种气体的分子数之比等于摩尔质量的反比,为3:2,错误。
3.三个密闭容器中分别充入N2、H2、SO2三种气体,以下各种情况下排序正确的是
A.当它们的压强和体积、温度均相同时,三种气体的质量:m(H2)>m(N2)>m(SO2)
B.当它们的温度和压强均相同时,三种气体的密度:ρ(H2)>ρ(N2)>ρ(SO2)
C.当它们的质量和温度、压强均相同时,三种气体的体积:V(SO2)>V(N2)>V(H2)
D.当它们的温度和密度都相同时,三种气体的压强:p(H2)>p(N2)>p(SO2)
【答案】D
【解析】
A.当它们的压强和体积、温度均相同时,三者的气体物质的量相同,m=nM,气体质量与摩尔质量成正比,所以三种气体的质量大小顺序是m(H2)<m(N2)<m(SO2),故A错误
B.当温度和压强相同时,气体摩尔体积相同,根据ρ=M÷Vm知,气体密度与摩尔质量成正比,根据摩尔质量知,三种气体的密度大小顺序是ρ(H2)<ρ(N2)<ρ(SO2),故B错误;
C.当它们的质量和温度、压强均相同时,根据n=m÷M,V=nVm,气体体积与摩尔质量成反比,所以这三种气体体积大小顺序是:V(SO2)<V(N2)<V(H2),故C错误;
D.体积和质量相同,则密度相同,而当温度和密度相同时,气体压强与摩尔质量成反比,所以三种气体的压强大小顺序是p(H2)>p(N2)>p(SO2),故D正确;
故选D。
4.(1)同温同压下,同体积的氨气(NH3)和硫化氢(H2S)气体的质量比为________。
(2)同温同压下,氨气和硫化氢气体的密度比为________。
(3)在标准状况下,0.01 ml某气体的质量为0.44 g,则该气体的密度为________g·L−1(保留小数点后两位),该气体的相对分子质量为________。
(4)在标准状况下,14 g CO与2 g H2的混合气体体积为________L。
【答案】(1)1∶2 (2)1∶2 (3)1.96 44 (4)33.6
【解析】(1)同温同压下,同体积气体物质的量相同,质量与摩尔质量成正比,即17∶34=1∶2。
(2)同温同压下,ρ1∶ρ2=M1∶M2,即17∶34=1∶2。
(3)V=0.01×22.4 L=0.224 L,ρ=≈1.96 g·L−1,M==44 g·ml−1。
(4)n(混)=+=1.5 ml,V=1.5 ml×22.4 L·ml−1=33.6 L。
1.气体摩尔体积和标准状况下气体摩尔体积是两个不同的概念。前者是指单位物质的量气体所占的体积。后者是指标准状况下,1 ml气体所占的体积,这个体积数值约为22.4 L。
2.标准状况,即0 ℃和101.25 kPa,符合这些条件的1 ml气体的体积一定约是22.4 L。
3.若1 ml某气体的体积为22.4 L,它所处的状况不一定就是杯准状况。根据温度、压强对气体分子间平均距离的影响规律知,温度升高或压强降低,分子间距将增大;温度降低或压强增大,分子间距将减小。
4.气体摩尔体积中的气体指任意气体,该气体可以是纯净物,也可以是混合物;纯净物中,可以是单质,也可以是化合物。如标准状况下。1 ml氢气和氯气的混合气体的体积约为22.4 L,所含分子总数为NA个。
条件
结论(等式)
语言叙述
T、p相同
同温同压下,气体体积之比等于气体物质的量之比
T、V相同
同温同体积下,气体压强之比等于物质的量之比
n、T相同
同温同物质的量下,气体压强之比等于体积反比
T、p相同
同温同压下,气体密度之比等于摩尔质量之比
T、p、V相同
同温同压下,相同体积的气体的质量之比等于摩尔质量之比
高中化学人教版 (2019)必修 第一册第三节 物质的量同步练习题: 这是一份高中化学人教版 (2019)必修 第一册<a href="/hx/tb_c161983_t7/?tag_id=28" target="_blank">第三节 物质的量同步练习题</a>,共5页。
高中化学人教版 (2019)必修 第一册第三节 物质的量测试题: 这是一份高中化学人教版 (2019)必修 第一册<a href="/hx/tb_c161983_t7/?tag_id=28" target="_blank">第三节 物质的量测试题</a>,文件包含29有关阿伏加德罗常数的正误判断精练-高一化学上学期《考点•题型•技巧》精讲与精练高分突破人教版原卷版doc、29有关阿伏加德罗常数的正误判断精练-高一化学上学期《考点•题型•技巧》精讲与精练高分突破人教版解析版doc等2份试卷配套教学资源,其中试卷共13页, 欢迎下载使用。
高中化学人教版 (2019)必修 第一册第三节 物质的量课后作业题: 这是一份高中化学人教版 (2019)必修 第一册<a href="/hx/tb_c161983_t7/?tag_id=28" target="_blank">第三节 物质的量课后作业题</a>,文件包含28气体摩尔体积与阿伏加德罗定律精练-高一化学上学期《考点•题型•技巧》精讲与精练高分突破人教版原卷版doc、28气体摩尔体积与阿伏加德罗定律精练-高一化学上学期《考点•题型•技巧》精讲与精练高分突破人教版解析版doc等2份试卷配套教学资源,其中试卷共11页, 欢迎下载使用。













