

海南省华侨中学2023-2024学年高一上学期期末考试化学试卷(含答案)
展开
这是一份海南省华侨中学2023-2024学年高一上学期期末考试化学试卷(含答案),共15页。试卷主要包含了单选题,多选题,填空题,实验题等内容,欢迎下载使用。
一、单选题
1.化学与生产生活、社会发展息息相关,下列说法正确的是( )
A.自来水杀菌消毒净化时,使用活性炭效果较好
B.实验室出现钠着火时,使用干冰灭火器效果较好
C.缺铁性贫血病人喝补铁剂时,加维生素C效果较好
D.胃溃疡病人胃酸多时,服用小苏打制的胃药效果较好
2.下列与实验有关的图标对应不正确的是( )
A.AB.BC.CD.D
3.下列物质的分类不正确的是( )
A.刚玉——氧化物B.重晶石——正盐C.氨水——碱D.玻璃——混合物
4.下列分散系中的分散质粒子直径最大的是( )
A.溶液B.胶体C.淀粉溶液D.石灰乳
5.下列有关化学用语表示正确的是( )
A.硫离子的结构示意图:B.次氯酸的结构式:
C.电子式:D.分子的空间填充模型:
6.在酸性条件下,可发生如下反应:,中M的化合价是( )
A.+4B.+5C.+6D.+7
7.物质的结构和性质决定物质的用途,下列物质用途表述中不正确的是( )
A.钠钾合金可做核反应堆的传热介质B.在考古时可以测定一些文物的年代
C.氧化铝可用于制备耐高温坩埚D.纯碱可用于制备制作糕点的发酵粉
8.在腐蚀铜电路板后的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是( )
A.溶液中一定不含B.溶液中一定含
C.加入KSCN溶液一定不变红色D.剩余固体中一定含Cu
9.如图能正确表示置换反应(X)、氧化还原反应(Y)和离子反应(Z)三者之间的关系的是( )
A.B.
C.D.
10.钚(Pu)是一种放射性元素,是原子能工业的一种重要原料,可作为核燃料和核武器的裂变剂。下列关于Pu-239的说法不正确的是( )
A.是元素周期表中第七周期的元素
B.与互为同位素,且为两种不同的核素
C.与具有相同的化学性质
D.原子核中有145个中子
11.镁铝合金质优体轻,又不易锈蚀,大量用于航空工业、造船工业、日用化工等领域。下列关于镁铝合金性质的叙述中正确的是( )
A.此合金的熔点、硬度比镁和铝的熔点、硬度都高
B.此合金能全部溶解于稀盐酸中
C.此合金能全部溶解于氢氧化钠溶液中
D.此合金不能全部溶解于过量溶液中
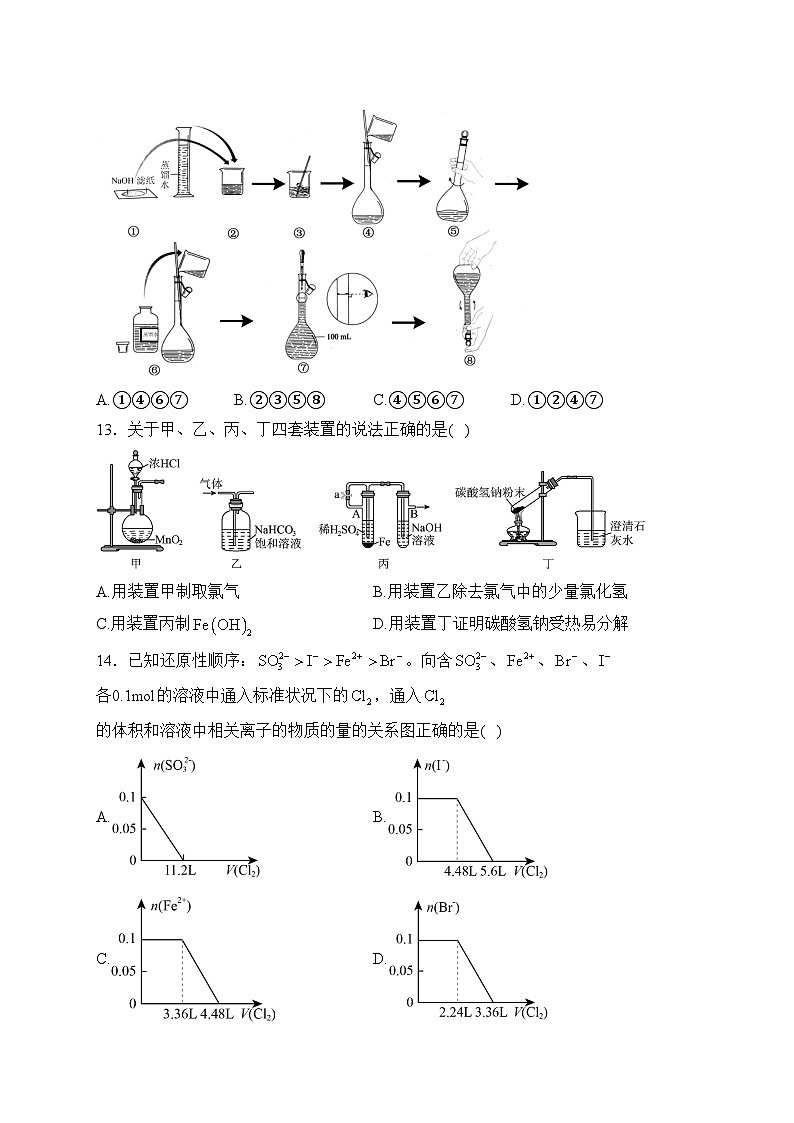
12.下图是某同学在实验室配制NaOH溶液的过程示意图,其中有错误的是( )
A.①④⑥⑦B.②③⑤⑧C.④⑤⑥⑦D.①②④⑦
13.关于甲、乙、丙、丁四套装置的说法正确的是( )
A.用装置甲制取氯气B.用装置乙除去氯气中的少量氯化氢
C.用装置丙制D.用装置丁证明碳酸氢钠受热易分解
14.已知还原性顺序:。向含、、、各0.1ml的溶液中通入标准状况下的,通入的体积和溶液中相关离子的物质的量的关系图正确的是( )
A.B.
C.D.
二、多选题
15.铁盐与亚铁盐在工业生产和生活中具有重要应用。硫酸亚铁溶液可用于脱除烟气中的二氧化硫等有害气体。溶液催化脱除烟气中的反应原理如图所示。下列说法正确的是( )
A.“反应Ⅰ”中氧化剂和还原剂的物质的量之比为4:1
B.“反应Ⅱ”的离子方程式为
C.反应一段时间后,溶液中增大
D.反应每脱除转移电子的物质的量为1ml
16.运用元素周期律分析下面的推断,其中错误的是( )
A.已知Ra是第7周期ⅡA族的元素,故的碱性比的碱性弱
B.已知As是第4周期ⅤA族的元素,故的稳定性比的稳定性弱
C.已知Cs的原子半径比Na的原子半径大,故Cs与水反应比Na与水反应更剧烈
D.已知Cl的原子半径比S的原子半径小,故的酸性比的强
17.高铁酸钠()是一种新型、高效、多功能的水处理剂。高铁酸钠()制备方法有:
湿法制备:
干法制备:。
有关分析错误的是( )
A.干法制备中每生成转移3ml电子
B.湿法制备中,次氯酸钠的氧化性大于高铁酸钠
C.在净水能力上,氧化能力不如NaClO
D.高铁酸钠做水处理剂的优点之一是比较环保
18.下列描述的结论能正确解释实验操作所对应的现象的是( )
A.AB.BC.CD.D
三、填空题
19.了解物质分类,电解质和非电解质的组成与性质等是研究反应本质的前提。
有以下几种物质:
①铝箔②稀硝酸③氯化氢④氨气⑤熟石灰⑥二氧化碳⑦碳酸钡⑧硫酸铝。
请按要求回答下列问题。
(1)以上物质中能导电的是___________(填序号,下同)。
(2)以上物质中属于电解质,但熔融状态下不能导电的是___________。
(3)将气体⑥通入⑤的水溶液中直至过量,可观察到___________现象。
(4)水溶液中⑧的电离方程式为:___________。
(5)溶液②和⑦反应的离子方程式:___________。
20.某工业废水中存在大量的和,欲除去废水中的和,设计工艺流程如图所示:
(1)操作1中不需要的仪器是___________。
a.烧杯b.托盘天平c.漏斗d.玻璃棒e.量筒
(2)a溶液和b溶液分别是___________,___________(填溶质化学式)。
(3)溶液A→混合物B过程中可观察到有白色沉淀___________生成(填化学式)。
(4)混合物B→溶液C过程中所涉及的离子方程式是___________。
(5)加入适量盐酸的作用是___________。
21.下表为元素周期表中主族元素的相关信息,其中W、T、X、Y、Z、M为短周期元素
请依据上述信息回答下列问题:
(1)R在元素周期表的位置是___________。
(2)Z离子的原子结构示意图:___________。
(3)X、M分别与W形成的化合物中较稳定的是___________(写化学式)。
(4)T和W形成的化合物TW可在野外用作供氢剂。请写出TW跟水反应化学方程式:___________。
(5)写出与水反应的离子方程式:___________。向的水溶液中滴加几滴紫色石蕊溶液,现象为___________。
22.亚氯酸钠()是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。马蒂逊(Mathiesn)法制备亚氯酸钠的流程如图:
(1)反应①的化学方程式为:,该反应的还原产物是___________(写化学式)。
(2)在□补充反应②另一种产物,并配平此离子方程式,然后用单线桥法分析此化学反应。
_______________________________________________□
(3)中Cl的化合价为___________,在反应②中___________(填字母)。
A.只能作氧化剂B.只能作还原剂C.既能作氧化剂也能作还原剂
(4)实验室采用马蒂逊(Mathiesn)法制备的实验装置如图甲所示:
已知:①的熔点为-59℃,沸点为11℃,的沸点为150℃。
②当温度低于38℃时,饱和溶液中析出的晶体是;当温度在38~60℃时,析出;温度高于60℃时,分解。C中将装置浸入冰水浴中的目的是___________。
四、实验题
23.碱金属广泛应用于电池、陶瓷、玻璃、润滑剂、制冷液、核工业以及光电等领域,它们的化学性质显示出十分明显的同系列行为,根据所学知识回答下列问题:
(1)如图所示,先用弹簧夹夹住橡胶管,点燃钠(足量),迅速伸入瓶中并塞上瓶塞,发生反应的化学方程式为___________,产物的颜色是___________,待反应完全并冷却至原温度后,打开弹簧夹,则观察到的现象是___________(假设装置的气密性良好)。
(2)按照实验研究和元素周期律推理,元素锂和水反应与钠和水反应比较,反应更剧烈的元素是___________(填元素符号),锂与水反应的离子方程式是___________,锂还是一种重要的储氢材料,其吸氢原理如下:,则该反应中还原剂是___________,每消耗28g锂相当于可以储存氢气体积为___________L(密度0.089g/L,保留到小数点后一位)。
参考答案
1.答案:C
解析:A.活性炭具有吸附作用,能吸附水中的有色物质或有毒物质,但没有杀菌能力,不能用于自来水的杀菌消毒,A不正确;
B.钠能与水、二氧化碳等发生反应,则实验室出现钠着火时,不能使用干冰灭火器灭火,B不正确;
C.维生素C具有还原性,能将还原,缺铁性贫血病人需要补充,缺铁性贫血病人喝补铁剂时,加维生素C可防止被氧化,治疗效果较好,C正确;
D.小苏打能与盐酸反应生成二氧化碳气体,胃溃疡病人胃酸多时,若服用小苏打制的胃药,会反应产生二氧化碳,可能导致胃穿孔,D不正确;
故选C。
2.答案:D
解析:A.图示表示化学实验需要佩戴护目镜,以保护眼睛,A正确;
B.图示表示实验结束后,离开实验室前需用肥皂等清洗双手,B正确;
C.图示表示实验中用到明火,要正确使用火源,并束好长发、系紧宽松衣物,C正确;
D.图示表示实验中会用到或产生有害气体,或产生烟、雾,应开启排风管道或排风扇,D错误;
综上所述答案为D。
3.答案:C
解析:A.刚玉的主要成分是氧化铝,属于氧化物,A正确;
B.重晶石的主要成分是硫酸钡,属于正盐,B正确;
C.氨水虽然显碱性,但属于混合物,不属于碱,C不正确;
D.玻璃是硅酸钠、硅酸钙、二氧化硅的混合物,D正确;
故选C。
4.答案:D
解析:A.溶液属于溶液,分散质粒子直径小于1nm;
B.胶体,淀粉溶液属于胶体,分散质粒子直径在1~100nm之间;
C.淀粉溶液属于胶体,分散质粒子直径在1~100nm之间;
D.石灰乳属于悬浊液,分散质粒子直径大于100nm;
故选D。
5.答案:B
解析:
6.答案:C
解析:方法1:根据得失电子守恒计算。设M的化合价为x,由得失电子守恒可得,解得。
方法2:根据电荷守恒计算。由电荷守恒可得,解得,中氧元素化合价为-2价,所以M元素的化合价为+6价。
7.答案:D
解析:A.钠钾合金的熔点低,常温下呈液态,具有很强的导热能力,可做核反应堆的传热介质,A正确;
B.具有放射性,在考古时可以利用其半衰期,通过测定一些文物中的含量确定文物的年代,B正确;
C.氧化铝的熔点高,稳定性强,可用于制备耐高温坩埚,C正确;
D.纯碱的热稳定性强,受热不分解,而小苏打受热易分解并产生二氧化碳气体,可用于制备制作糕点的发酵粉,D不正确;
故选D。
8.答案:A
解析:A.若固体中不含有Fe,则溶液中可能含有,A不正确;
B.由分析可知,溶液中一定含有,B正确;
C.溶液中一定含有,加入KSCN溶液一定不变红色,C正确;
D.因为与Fe不共存,所以剩余固体中一定含Cu,D正确;
故选A。
9.答案:C
解析:氧化还原反应包含置换反应、部分化合反应和部分分解反应,所以氧化还原反应包含置换反应,离子反应可能是氧化还原反应,可能是置换反应,也可能不是氧化还原反应、不是置换反应,故选C。
10.答案:C
解析:第六周期最后一个元素氡的原子序数为86,则是元素周期表中第七周期的元素,A正确;
与质子数相同而中子数不同,则它们互为同位素,且为两种不同的核素,B正确;
与质量数相同,但质子数不同、核外电子数不同、电子排布不同,则化学性质不同,C不正确;
原子核中有个中子,D正确。
11.答案:B
解析:A.合金的熔点比各组分都低,所以镁铝合金的熔点比镁和铝的熔点都低,故A错误;
B.镁和铝都是活泼金属,都能与盐酸反应,所以镁铝合金能全部溶解于稀盐酸中,故B正确;
C.镁不能与氢氧化钠溶液反应,所以镁铝合金不能全部溶解于氢氧化钠溶液中,故C错误;
D.镁和铝都具有强还原性,都能与氯化铁溶液反应,所以镁铝合金能全部溶解于过量氯化铁溶液中,故D错误;
故选B。
12.答案:A
解析:氢氧化钠具有腐蚀性,称量具有腐蚀性的药品应放在小烧杯或称量瓶中,①错误;
将固体转移至烧杯中,加适量蒸馏水溶解,②正确;
用玻璃棒搅拌加速固体溶解,③正确;
用玻璃棒引流时,玻璃棒下端应靠在容量瓶刻度线下方,④错误;
轻轻摇动容量瓶,使溶液混合均匀,⑤正确;
试剂瓶塞应倒放,防止药品污染,⑥错误;
加水到接近刻度线1~2m处,改用胶头滴管滴加蒸馏水至溶液的凹液面与刻度线相切,但胶头滴管不能伸入容量瓶中,⑦错误;
定容后盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶颠倒摇匀多次,⑧正确;
故选A。
13.答案:C
解析:A.浓盐酸与二氧化锰反应需要加热,图中缺少酒精灯,故A错误;
B氯气与水反应生成盐酸,盐酸与碳酸氢钠反应,不能除杂,应选饱和食盐水,故B错误;
C.Fe与稀硫酸反应生成氢气可将装置内空气排出,关闭a,氢气可使硫酸亚铁与NaOH混合生成氢氧化亚铁,则图中装置可制备,故C正确;
D加热时试管口应略向下倾斜,防止生成的水倒流使试管炸裂,故D错误;
故选:C。
14.答案:C
解析:
15.答案:BC
解析:
16.答案:AD
解析:A.同主族元素从上到下,金属性依次增强,Ra和Mg是同主族元素,且Ra在Mg的下方,则的碱性比的碱性强,A错误;
B.同主族元素从上到下,非金属性依次减弱,As和N是同主族元素,且As位于N的下方,故的稳定性比的稳定性弱,B正确;
C.同主族元素从上到下,金属性依次增强,Cs的原子半径比Na的原子半径大,则Cs在Na的下方,故Cs与水反应比Na与水反应更剧烈,C正确;
D.非金属性越强,最高价氧化物的水化物的酸性越强,Cl的原子半径比S的原子半径小,则Cl的非金属性比S强,但和都不是最高价含氧酸,所以不能确定二者的酸性强弱,D错误;
故选AD。
17.答案:AC
解析:
18.答案:AB
解析:A.向溶液中滴加饱和溶液,有白色沉淀生成,表明发生反应,从而得出结合的能力大于的结论,A正确;
B.用光束分别照射氢氧化铁胶体和三氯化铁溶液,氢氧化铁胶体中有一条光亮的通路,表明氢氧化铁胶粒对光有散射作用,从而说明胶体的分散质粒子使光散射,B正确;
C.将分别加入氨水和盐酸中,仅盐酸中固体溶解,表明不溶于弱碱溶液,但不能说明不溶于强碱溶液,也就是不能说明是碱性氧化物,C不正确;
D.、KI混合溶液中滴加KSCN溶液,溶液呈红色,表明溶液中含有,可能是、KI不反应,也可能是过量,D不正确;
故选AB。
19.答案:(1)①②
(2)③
(3)先有白色沉淀生成,后沉淀逐渐溶解
(4)
(5)
解析:(1)①铝箔能发生电子导电,②稀硝酸能发生离子导电,则以上物质中能导电的是①②;
(2)以上物质中,③氯化氢、⑤熟石灰、⑦碳酸钡、⑧硫酸铝属于电解质,⑤熟石灰、⑦碳酸钡、⑧硫酸铝在熔融状态下能导电,③氯化氢在熔融状态下不能导电,故选③;
(3)将气体⑥二氧化碳通入⑤熟石灰的水溶液中直至过量,先发生反应生成沉淀,继续反应转化为,则可观察到先有白色沉淀生成,后沉淀逐渐溶解现象;
(4)水溶液中⑧硫酸铝发生完全电离,生成铝离子和硫酸根离子,电离方程式为:;
(5)溶液②稀硝酸和⑦碳酸钡发生复分解反应,生成、气体等,离子方程式:。
20.答案:(1)be
(2);
(3)
(4)
(5)除去多余的和
解析:(1)操作1为过滤,所用仪器为烧杯、漏斗、玻璃棒,则不需要的仪器是托盘天平、量筒,故选be;
(2)由分析可知,a溶液和b溶液分别是、;
(3)溶液A中含有等,混合物B中含有、NaCl等,过程中与发生反应,可观察到有白色沉淀生成;
(4)混合物B(含等)→溶液C(含等)过程中,所涉及的离子方程式是;
(5)加入适量盐酸,去除过量和NaOH,则其作用是:除去多余的和。
21.答案:(1)第四周期ⅥA族
(2)
(3)
(4)
(5);溶液先变红,后褪色
解析:
22.答案:(1)
(2)
(3)+3;C
(4)增大的溶解度使其充分反应,防止温度过高使、分解
解析:
23.答案:(1);淡黄色;烧杯中的水倒流入广口瓶内
(2)Na;;Li(或锂);44.9
解析:(1)先用弹簧夹夹住橡胶管,点燃钠(足量),迅速伸入瓶中并塞上瓶塞,燃烧的钠在瓶内继续燃烧,生成过氧化钠,并消耗瓶内的氧气,发生反应的化学方程式为,产物的颜色是淡黄色,待反应完全并冷却至原温度后,打开弹簧夹,由于瓶内氧气被消耗,压强小于大气压强,则观察到的现象是:烧杯中的水倒流入广口瓶内;
(2)锂和钠是同主族元素,锂在钠的上方,锂的金属性比钠弱,元素锂和水反应与钠和水反应比较,反应更剧烈的元素是Na,采用类推法可得出,锂与水反应的离子方程式是,锂还是一种重要的储氢材料,其吸氢原理如下:,该反应中,Li由0价升高到+1价,则还原剂是Li(或锂)。
A
B
C
D
护目镜
洗手
明火
用电
选项
实验
现象
结论
A
向溶液中滴加饱和溶液
有白色沉淀生成
结合的能力大于
B
用光束分别照射氢氧化铁胶体和三氯化铁溶液
氢氧化铁胶体中有一条光亮的通路
胶体的分散质粒子使光散射
C
将分别加入氨水和盐酸溶液中
仅盐酸中固体溶解
是碱性氧化物
D
、KI混合溶液中滴加KSCN溶液
溶液呈红色
不与KI反应
元素
相关信息
W
W在自然界中有三种核素,其中一核素没有中子
T
T为第三周期元素,其最高价氧化物的水化物A是一种强碱
X
X的原子最外层电子数是其内层电子数的三倍
Y
Y是自然界中含量最高的金属
Z
T、X、Z组成的36电子的化合物B是家用消毒剂的主要成分
M
元素原子最外层比次外层少2个电子
R
R在元素周期表中的位置如图所示
相关试卷
这是一份海南省2023-2024学年高一上学期期末考试化学试卷(含答案),共13页。试卷主要包含了单选题,多选题,填空题,实验题等内容,欢迎下载使用。
这是一份31,海南华侨中学2023-2024学年高一上学期期末考试化学试题,共18页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
这是一份海南华侨中学2023-2024学年高一上学期期末考试化学试题,共12页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。








