




备战2025届新高考化学一轮总复习第3章金属及其化合物热点专攻8无机化学工艺流程题解题策略课件
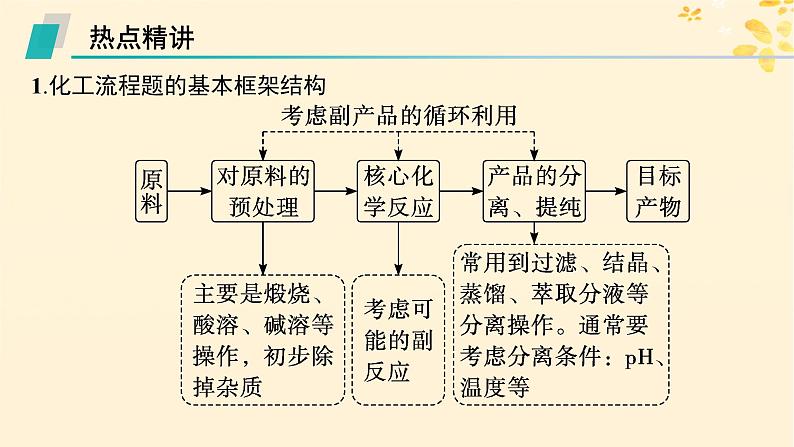
展开1.化工流程题的基本框架结构
2.化工流程图中的主要环节及分析(1)原料的预处理①溶解:通常用酸溶,如用稀硫酸等进行溶解。
②灼烧、焙烧、煅烧:改变结构,使一些物质能溶解,并使一些杂质在高温下氧化、分解。
(2)核心化学反应——陌生化学(或离子)方程式的书写关注箭头的指向:箭头指入→反应物,箭头指出→生成物。①氧化还原反应:熟练应用氧化还原规律,判断产物类型,根据得失电子守恒等配平。②非氧化还原反应:结合物质性质和反应实际,以及元素守恒规律等判断产物。
(3)常用的控制反应条件的方法①调节溶液的pH:常用于使某些金属离子形成氢氧化物沉淀并过滤除去。选择调节pH所需的物质一般要考虑两点,一是能与H+反应,使溶液pH增大;二是不引入新杂质。例如要除去MgCl2溶液中混有的Fe3+,可加入MgO、MgCO3、Mg(OH)2等物质来调节溶液的pH,不可加入NaOH溶液、氨水等。②控制温度:根据需要升温或降温,改变反应速率或使平衡向需要的方向移动。③趁热过滤:防止某些物质降温时会析出,混入杂质或降低产物的产率。④冰水洗涤:洗去晶体表面的杂质离子,并减少晶体在洗涤过程中的溶解损耗。
3.解答化工流程题的基本步骤(1)从题干中获取有用信息,阅读题干时要随手圈出目的及相关信息,了解反应物是什么,产品是什么,主要分析出产品中各种元素的来源,即分析“元素流向”。(2)了解流程中一些操作的目的,通常都是为了净化原料或者提纯产品。(3)对反应条件的分析可从以下几个方面着手:①对反应速率有何影响;②对平衡转化率有何影响;③对综合生产效益有何影响(从原料来源、能源成本、环境保护、循环利用等方面考虑)。
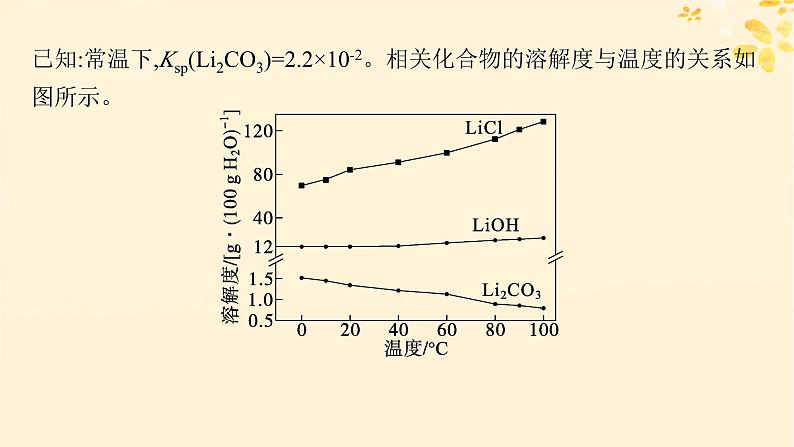
已知:常温下,Ksp(Li2CO3)=2.2×10-2。相关化合物的溶解度与温度的关系如图所示。
Mg(OH)2、CaSO4
Na2CO3、CaO
浓缩时有Li2CO3沉淀析出,最终所得Li2CO3的产率减小
归纳总结解答工艺流程题的常用分析方法 1.主线法 (1)流程图三部分:原料预处理、转化与分离阶段、获 取最终产物阶段。 (2)分析每一流程前后物质的变化。 (3)一般默认使用的试剂需过量。 2.双线法 (1)反应线———物质之间的转化关系。 (2)操作线———物质在转化时的实验操作。
3.四线法 (1)试剂线:为达到最终目的加入的物质,起到氧化还 原、非氧化还原的作用; (2)转化线:元素守恒———焙烧、溶浸、沉淀、煅烧、电 解、结晶等; (3)除杂线:复分解沉淀、置换沉淀、氧化还原沉淀、加 热产生气体等; (4)分离 线:蒸 发、结 晶、过 滤 (趁 热 过 滤)、洗 涤、干 燥等。
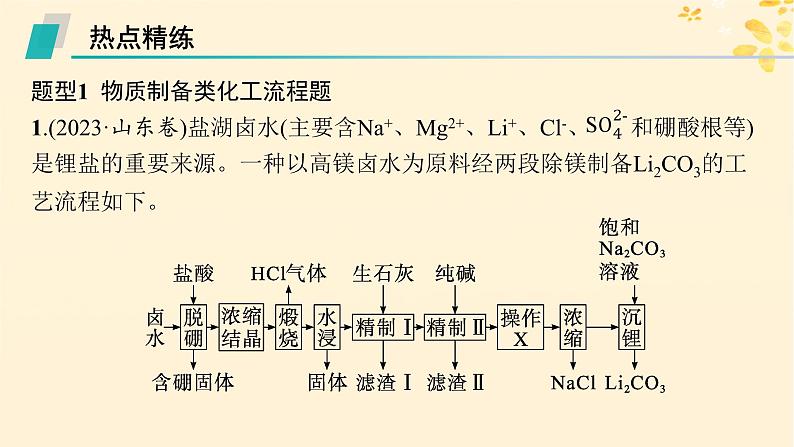
2.(2024·广西北海模拟)硫酸铈铵[(NH4)2Ce(SO4)3]微溶于水,不溶于乙醇,溶于无机酸,可用作分析试剂、氧化剂。某工厂用碳酸铈[Ce2(CO3)3]矿石制备硫酸铈铵的工艺流程如图:
已知:①Ksp[Ce(OH)4]=2×10-48。②硫酸铈铵的熔点为130 ℃,沸点为330 ℃。回答下列问题:
(1)(NH4)2Ce(SO4)3中铈元素的化合价为________。 (2)步骤一中,先将Ce2(CO3)3矿石粉碎,目的是_______________________。 (3)步骤二中,反应温度需要控制在0~30 ℃,原因是____________________。反应完全后,要将混合物升温至90 ℃,目的是_______________________。 (4)步骤二中,Ce2(SO4)3与H2O2、NH3·H2O反应生成Ce(OH)4的化学方程式为___________________________________________________。 (5)步骤三反应完全后的溶液经________、________、过滤,得到晶体。最后用________洗涤2~3次后,得到高纯硫酸铈铵晶体。 (6)若最初称取一定量的碳酸铈矿石,其中含Ce2(CO3)3 4.60 kg,经该工艺流程最终获得5.62 kg (NH4)2Ce(SO4)3晶体,则(NH4)2Ce(SO4)3的产率为________(保留三位有效数字)。
增大溶解过程中固体与稀硫酸的接触面积,加快溶解速率
温度过高会导致过氧化氢分解、氨水挥发
Ce2(SO4)3+H2O2+6NH3·H2O══ 2Ce(OH)4↓+3(NH4)2SO4
解析 碳酸铈[Ce2(CO3)3]矿石用硫酸浸取,Ce3+进入溶液,加入过氧化氢将三价铈氧化为四价铈,加入氨水升温至90 ℃得到Ce(OH)4悬浊液,加入硫酸、硫酸铵得到硫酸铈铵晶体。(1)(NH4)2Ce(SO4)3中铵根、硫酸根化合价分别为+1、-2价,根据化合价代数和为零,可知铈元素的化合价为+4价。(2)将Ce2(CO3)3矿石粉碎,目的是增大溶解过程中固体与稀硫酸的接触面积,加快溶解速率,提高浸取效率。(3)过氧化氢不稳定、氨水易挥发,反应温度需要控制在0~30 ℃,原因是温度过高会导致过氧化氢分解、氨水挥发;反应完全后,要将混合物升温至90 ℃,目的是使过氧化氢分解为水和氧气,除去过量的过氧化氢。
(4)Ce2(SO4)3与H2O2、NH3·H2O反应生成Ce(OH)4,反应中Ce化合价由+3价变为+4价、过氧化氢中氧化合价由-1价变为-2价,结合电子守恒、质量守恒可知,化学方程式为Ce2(SO4)3+H2O2+6NH3·H2O═2Ce(OH)4↓+3(NH4)2SO4。(5)步骤三反应完全后的溶液经蒸发浓缩、冷却结晶、过滤,得到晶体。硫酸铈铵微溶于水,不溶于乙醇,故最后用乙醇洗涤2~3次后,得到高纯硫酸铈铵晶体。(6)由Ce守恒可知,Ce2(CO3)3~2(NH4)2Ce(SO4)3,
3.(2024·陕西渭南模拟)工业废水任意排放,会造成环境污染。“协同去污,变废为宝”为处理工业废水提供了新思路。电镀厂产生大量含FeSO4、CuSO4的电镀废液,皮革厂产生大量含K2Cr2O7的废液。两厂联合处理废水,回收Cu并生产铁红和媒染剂Cr2(SO4)3·6H2O,工艺流程如图:
(1)K2Cr2O7中Cr元素的化合价为________。 (2)该工艺中多次用到过滤,过滤时需要的玻璃仪器除烧杯外还有_______。(3)滤液可以通入或加入X经一步转化为溶液A,X可以是下列选项中的_______。证明滤液中只含有Fe2+而不含Fe3+的实验方法是____________。A.CO2 B.O2 C.Cl2 D.SO2 E.H2O2
先滴加KSCN溶液,不显红色,再滴加氯水后显红色(答案合理即可)
(4)滤液与含K2Cr2O7的废液反应的离子方程式为_____________________。(5)从Cr2(SO4)3溶液制取Cr2(SO4)3·6H2O晶体的实验操作方法为________、________、过滤、洗涤、干燥。 (6)已知Cr(OH)3化学性质与Al(OH)3类似,选择合适的化学试剂,将流程中的Cr2(SO4)3溶液转化为可用于陶瓷和搪瓷的着色剂Cr2O3,转化过程中发生反应的主要化学方程式为__________________________________。
解析 由题给流程可知,向电镀废液中加入过量铁粉,将溶液中铜离子转化为铜,过滤得到含有铜、铁的滤渣和含有硫酸亚铁的滤液;向滤渣中加入过量稀硫酸,将滤渣中的铁转化为硫酸亚铁,过滤得到铜和含有硫酸亚铁的滤液;向混合后的滤液中通入氧气或氯气或加入过氧化氢,将溶液中的亚铁离子氧化得到含有铁离子的溶液A;向滤液中加入重铬酸钾废液,将溶液中的亚铁离子氧化得到含有铁离子和铬离子的溶液B;向溶液B中加入萃取剂萃取、分液得到含有铁离子的有机相和硫酸铬溶液;硫酸铬溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到六水硫酸铬;向有机相中加入稀硫酸反萃取、分液得到可循环使用的萃取剂和含有铁离子的溶液A;向溶液A中加入氢氧化钠溶液,将铁离子转化为氢氧化铁沉淀,过滤得到的氢氧化铁受热分解得到铁红。
(1)由化合价的代数和为0可知,重铬酸钾中铬元素的化合价为+6价。(2)过滤所需的玻璃仪器有烧杯、漏斗、玻璃棒。(3)由分析可知,溶液A为含有铁离子的溶液,证明滤液中只含有Fe2+而不含Fe3+的实验方法是先滴加KSCN溶液,不显红色,再滴加氯水后显红色;通入氧气、氯气或过氧化氢,将溶液中的亚铁离子氧化得到含有铁离子的溶液A。(4)由分析可知,滤液与废液发生的反应为酸性条件下,溶液中亚铁离子与重铬酸根离子反应生成铁离子、铬离子和水,反应的离子方程式为
(5)由分析可知,制得六水硫酸铬的实验操作方法为硫酸铬溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到六水硫酸铬。
题型2 物质分离及提纯类化工流程题4.(2022·湖北卷)全球对锂资源的需求不断增长,“盐湖提锂”越来越受到重视。某兴趣小组取盐湖水进行浓缩和初步除杂后,得到浓缩卤水(含有Na+、Li+、Cl-和少量Mg2+、Ca2+),并设计了以下流程通过制备碳酸锂来提取锂。
25 ℃时相关物质的参数如下,LiOH的溶解度:12.4 g/100 g H2O。
回答下列问题:(1)“沉淀1”为________________。 (2)向“滤液1”中加入适量固体Li2CO3的目的是_______________________。(3)为提高Li2CO3的析出量和纯度,“操作A”依次为________________、________________、洗涤。 (4)有同学建议用“侯氏制碱法”的原理制备Li2CO3。查阅资料后,发现文献对常温下的Li2CO3有不同的描述:①是白色固体;②尚未从溶液中分离出来。为探究LiHCO3的性质,将饱和LiCl溶液与饱和NaHCO3溶液等体积混合,起初无明显变化,随后溶液变浑浊并伴有气泡冒出,最终生成白色沉淀。上述现象说明,在该实验条件下LiHCO3________(填“稳定”或“不稳定”),有关反应的离子方程式为________________________________。
将Ca2+转化成CaCO3沉淀除去,同时不引入新杂质
(5)他们结合(4)的探究结果,拟将原流程中向“滤液2”加入Na2CO3改为通入CO2。这一改动能否达到相同的效果,作出你的判断并给出理由。
能达到相同效果;改为通入过量的CO2,则LiOH转化为LiHCO3,结合(4)的探究结果,LiHCO3也会很快分解产生Li2CO3,能达到相同的效果
解析 (2)滤液1中含有Na+、Li+、Cl-和Ca2+,结合LiOH的溶解度和化合物的溶度积常数可推测,加入Li2CO3的目的是将Ca2+转化成CaCO3沉淀除去,同时不引入新杂质。(3)由Li2CO3的溶解度曲线可知,温度升高,Li2CO3的溶解度降低,即在温度较高时,其溶解度减小,有利于析出,为提高Li2CO3的析出量和纯度,需要在较高温度下析出并过滤得到沉淀,即依次蒸发浓缩、趁热过滤、洗涤。(5)“滤液2”中含有LiOH,加入Na2CO3的目的是将LiOH转化为Li2CO3。若改为通入过量的CO2,则LiOH转化为LiHCO3,结合(4)的探究结果,LiHCO3会很快分解产生Li2CO3,故这一改动能达到相同的效果。
归纳总结1.明确常用的提纯方法 (1)水溶法:除去可溶性杂质。 (2)酸溶法:除去与酸反应的杂质。 (3)碱溶法:除去与碱反应的杂质。 (4)氧化剂或还原剂法:除去还原性或氧化性杂质。 (5)加热灼烧法:除去受热易分解或易挥发的杂质。 (6)调节溶液pH 法:如除去酸性溶液中的Fe3+等。
2.明确常用的分离方法 (1)过滤:分离难溶物和易溶物,根据特殊需要采用趁 热过滤或者抽滤等方法。 (2)萃取和分液:利用溶质在互不相溶的溶剂里的溶 解度不同分离物质,如用 CCl4 或苯萃取溴水中的溴。 (3)蒸发结晶:提取溶解度随温度变化不大的溶质,如 NaCl。 (4)冷却结晶:提取溶解度随温度变化较大的溶质、易 水解的溶质或结晶水合物,如 KNO3、FeCl3、CuCl2、 CuSO4·5H2O、FeSO4·7H2O 等。 (5)蒸馏或分馏:分离沸点不同且互溶的液体混合物, 如分离乙醇或甘油。 (6)冷却法:利用气体液化的特点分离气体,如合成氨 工业采用冷却法分离平衡混合气体中的氨气。
5.(2022·广东卷)稀土(RE)包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如下:
已知:月桂酸(C11H23COOH)熔点为44 ℃;月桂酸和(C11H23COO)3RE均难溶于水。该工艺条件下,稀土离子保持+3价不变;(C11H23COO)2Mg的Ksp=1.8×10-8;Al(OH)3开始溶解时的pH为8.8;有关金属离子沉淀的相关pH见下表。
(1)“氧化调pH”中,化合价有变化的金属离子是________。 (2)“过滤1”前,用NaOH溶液调pH至________的范围内,该过程中Al3+发生反应的离子方程式为________________________________。
Al3++3OH-══ Al(OH)3↓
(3)“过滤2”后,滤饼中检测不到Mg元素,滤液2中Mg2+浓度为2.7 g·L-1。为尽可能多地提取RE3+,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中c(C11H23COO-)低于________ ml·L-1(保留两位有效数字)。 (4)①“加热搅拌”有利于加快RE3+溶出、提高产率,其原因是___________。②“操作X”的过程为:先________,再固液分离。
加热可以提高分子运动扩散速度,搅拌增加溶剂与溶质的接触面积,使溶出更彻底,提高溶出速度,提高产率
(5)该工艺中,可再生循环利用的物质有________(写化学式)。 (6)稀土元素钇(Y)可用于制备高活性的合金类催化剂Pt3Y。①还原YCl3和PtCl4熔融盐制备Pt3Y时,生成1 ml Pt3Y转移________ ml电子。 ②Pt3Y/C用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化O2的还原,发生的电极反应为________________________。
O2+4e-+2H2O══ 4OH-
解析 本题涉及氧化还原、去除杂质、溶度积常数的应用等,题目难度中等,注意根据题意写出有关反应的方程式,做题时注意根据物质的性质正确判断反应物和生成物,用守恒的方法去书写离子方程式。(1)由题干信息可知,原料矿物中含铁、铝及稀土元素。浸取液中稀土离子保持+3价不变,镁离子、铝离子无还原性。故“氧化调pH”中,二价铁离子被氧化为三价铁离子。(2)“过滤1”的目的是除掉溶液中的铝离子和铁离子。故在过滤前,应使铝离子和铁离子完全沉淀,又不能使稀土离子沉淀。由表格可知,pH为4.7~6.2时,铁离子和铝离子沉淀完全,稀土离子尚未沉淀。铝离子沉淀的离子方程式为Al3++3OH-═Al(OH)3↓。
(3)“过滤2”后,滤饼中检测不到镁元素,说明加入月桂酸钠后,月桂酸根离子未与镁离子结合生成沉淀,而是与稀土离子结合生成沉淀。故为保证镁离子恰好不沉淀,根据月桂酸镁的Ksp公式,有c(C11H23COO-)=4.0×10-4ml·L-1。(4)根据题干信息可知,月桂酸的熔点为44 ℃,而加热搅拌阶段的温度为55 ℃。故为了分离月桂酸与RECl3溶液,需要冷却至44 ℃以下,待月桂酸完全结晶再进行固液分离。(5)根据(3)题干信息,“过滤2”操作后,滤饼中不存在镁离子,故镁离子仍以MgSO4的形式存在于滤液2中,可再次酸化循环利用。
备战2025届新高考化学一轮总复习第4章非金属及其化合物热点专攻10重要含硫化合物及制备课件: 这是一份备战2025届新高考化学一轮总复习第4章非金属及其化合物热点专攻10重要含硫化合物及制备课件,共13页。PPT课件主要包含了热点精讲,热点精练等内容,欢迎下载使用。
备战2025届新高考化学一轮总复习第4章非金属及其化合物热点专攻12肼的性质及应用课件: 这是一份备战2025届新高考化学一轮总复习第4章非金属及其化合物热点专攻12肼的性质及应用课件,共13页。PPT课件主要包含了热点精讲,热点精练,碱性NaClO溶液,淀粉溶液,67%等内容,欢迎下载使用。
备战2025届新高考化学一轮总复习第4章非金属及其化合物热点专攻11过氧化氢的性质及应用课件: 这是一份备战2025届新高考化学一轮总复习第4章非金属及其化合物热点专攻11过氧化氢的性质及应用课件,共10页。PPT课件主要包含了热点精讲,热点精练,HOOH等内容,欢迎下载使用。












