




备战2025届新高考化学一轮总复习第3章金属及其化合物第12讲铝镁及其化合物课件
展开1.结合真实情境中的应用实例或通过实验探究,了解铝、镁及其化合物的主要性质。2.了解铝、镁及其化合物在生产、生活中的应用。
考点一 铝及其重要化合物
考点二 镁及其化合物的性质 海水提取镁
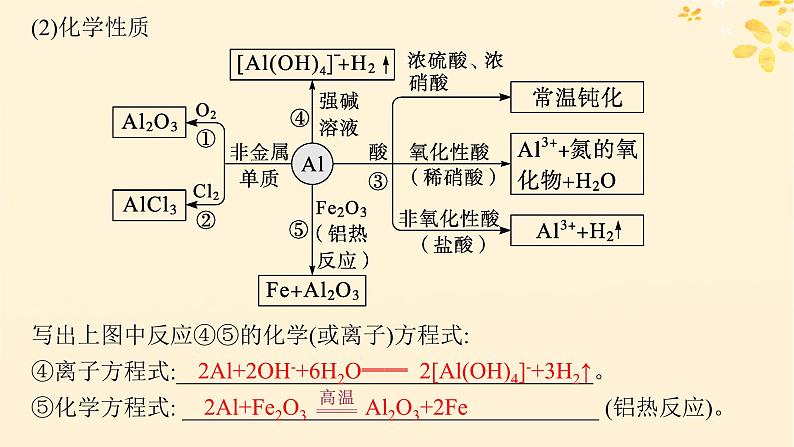
1.铝的性质与应用(1)结构及存在
写出上图中反应④⑤的化学(或离子)方程式:④离子方程式:____________________________________。 ⑤化学方程式: ____________________________________ (铝热反应)。
2Al+2OH-+6H2O══ 2[Al(OH)4]-+3H2↑
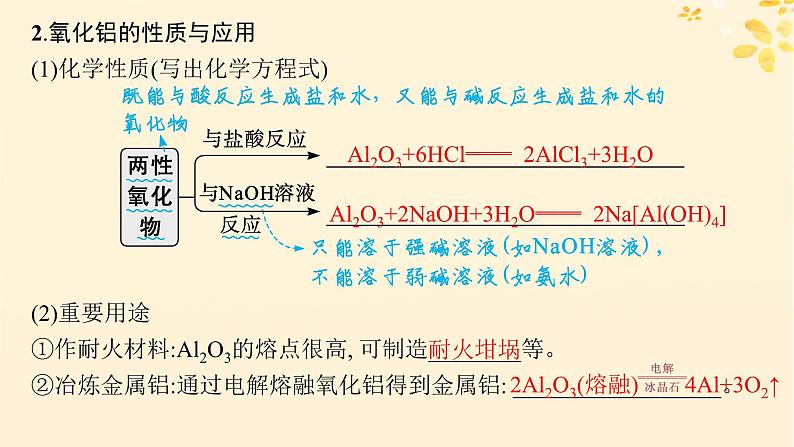
2.氧化铝的性质与应用(1)化学性质(写出化学方程式)
(2)重要用途①作耐火材料:Al2O3的熔点很高, 可制造________等。 ②冶炼金属铝:通过电解熔融氧化铝得到金属铝: __________________。
Al2O3+6HCl══ 2AlCl3+3H2O
Al2O3+2NaOH+3H2O══ 2Na[Al(OH)4]
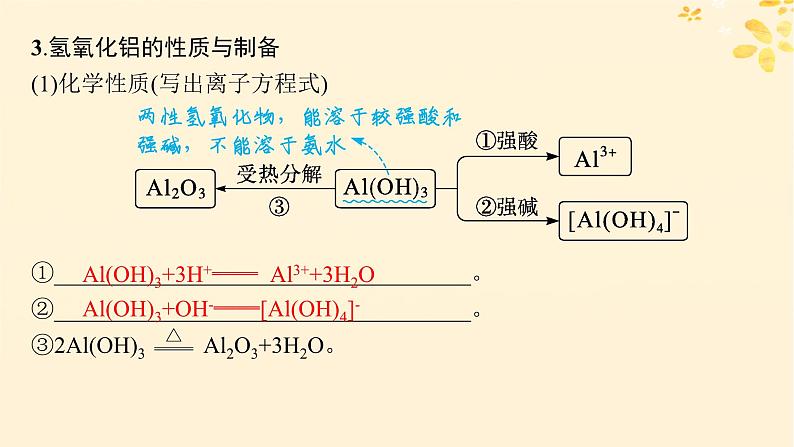
3.氢氧化铝的性质与制备(1)化学性质(写出离子方程式)
Al(OH)3+3H+══ Al3++3H2O
Al(OH)3+OH-══[Al(OH)4]-
(2)制备方法(写出离子方程式)①向可溶性铝盐溶液中加入足量氨水: ____________________________________。 ②向Na[Al(OH)4]溶液中通入足量CO2: ____________________________________。
4.工业冶炼铝的工艺流程(1)碱溶法
考向1 铝及其化合物的性质与应用例1下列关于金属铝及其化合物的叙述正确的是( )A.铝耐腐蚀是因为常温下金属铝不能与氧气反应B.铝合金密度小,硬度大,耐腐蚀,是制造飞机的理想材料C.相同质量的铝分别与足量盐酸和烧碱溶液反应产生氢气的质量比为3∶1D.铝表面有氧化膜保护,铝质器皿可以长时间盛放酸性或碱性溶液
解析 铝耐腐蚀是因为常温下金属铝与氧气反应生成一层致密的氧化铝薄膜,A错误;铝合金密度小,硬度大,耐腐蚀,是制造飞机的理想材料,B正确;铝与盐酸反应生成氯化铝和H2,铝和烧碱溶液反应生成Na[Al(OH)4]和H2,相同质量的铝分别与足量盐酸和烧碱溶液反应产生氢气的质量比为1∶1,C错误;氧化铝是两性氧化物,氧化铝可以在酸性溶液或碱性溶液中反应,故铝质器皿不可以长时间盛放酸性或碱性溶液,D错误。
[对点训练1] 下列关于金属铝及其化合物的叙述不正确的是( )A.铝的化学性质很活泼,但不能与氨水发生反应B.氧化铝能与氢氧化钠溶液反应,故氧化铝为酸性氧化物C.等物质的量的铝分别与足量的HCl溶液、NaOH溶液反应,消耗HCl和NaOH的物质的量之比为3∶1D.铝在冷的浓硝酸中发生钝化,因此可用铝槽车运输浓硝酸
解析 铝的化学性质很活泼,但不能与弱碱溶液反应,A正确;氧化铝既能与强酸反应又能与强碱反应,故氧化铝为两性氧化物,B错误;根据反应方程式2Al+6HCl═2AlCl3+3H2↑和2Al+2NaOH+6H2O═2Na[Al(OH)4]+3H2↑可知,当Al的物质的量相等时,反应消耗HCl和NaOH的物质的量之比为3∶1,C正确;铝在冷的浓硝酸中发生钝化,因此可用铝槽车运输浓硝酸,D正确。
考向2 铝及其化合物的制备“微流程”例2某种粉煤灰含有50.19%的Al2O3、37.29%的SiO2,其余为Fe2O3、CaO等。利用该粉煤灰“一步酸溶法”生产氧化铝的工艺流程如图所示。下列叙述不正确的是( )
A.“滤渣”的主要成分是二氧化硅B.“树脂净化”的目的是将Al3+与Fe3+、Ca2+分离C.“蒸发结晶”前应向氯化铝溶液中加入盐酸D.循环使用X既能降低成本,又能防止污染环境
解析 由流程可知,加盐酸反应后,过滤分离出的“滤渣”主要为SiO2,酸浸液中含Al3+、Fe3+、Ca2+,“树脂净化”除去了Fe3+、Ca2+,AlCl3的酸性溶液可抑制Al3+水解,蒸发结晶分离出X为HCl,焙烧结晶之后所得物质生成Al2O3和X(HCl)。“滤渣”的主要成分是SiO2,A正确;由制备最终产物Al2O3及流程可知,“树脂净化”的目的是将Al3+与Fe3+、Ca2+分离,B正确;“酸浸”时盐酸过量,“蒸发结晶”前溶液显酸性,因此不需要加盐酸,C错误;X为HCl,可在“酸浸”时循环使用,循环使用X既能降低成本,又能防止污染环境,D正确。
流程解读结合粉煤灰的主要成分、各步骤加入的试剂及反应过程等分析如下:
[对点训练2] 铝土矿中主要含有Al2O3,还有少量Fe2O3、SiO2杂质,从铝土矿中冶炼金属铝的方法如图所示(步骤①、②、③中每步反应结束后经过过滤才进行下一步反应)。下列有关说法不正确的是( )
考点二镁及其化合物的性质 海水提取镁
1.镁的存在及性质(1)镁的存在在自然界中,镁以________的形式存在于地壳和海水中。 (2)化学性质
Mg+2H+═Mg2++H2↑
2.从海水中提取镁(1)工艺流程
(2)主要步骤及反应(写出化学方程式)①制石灰乳: _______________________、_______________________; ②生成Mg(OH)2: _________________________________; ③制备MgCl2: _____________________________________; ④冶炼金属镁: _____________________________________。
CaO+H2O══ Ca(OH)2
MgCl2+Ca(OH)2══ Mg(OH)2↓+CaCl2
Mg(OH)2+2HCl══ MgCl2+2H2O
3.镁的两种重要化合物(1)氧化镁:白色粉末状固体,难溶于水,属于________氧化物;与稀硫酸、盐酸等酸反应的离子方程式为_______________________。 (2)氢氧化镁:白色固体,难溶于水,属于中强碱;与稀硫酸、盐酸等酸反应的离子方程式为____________________________。
MgO+2H+══ Mg2++H2O
Mg(OH)2+2H+ ══ Mg2++2H2O
考向1 镁及其化合物的性质与应用例1室温下,用质量和表面积相同的镁条各一片(已用砂纸打磨),分别探究不同条件下与水反应的实验(装置图如下),实验2的镁条放在尖嘴玻璃导管内并浸于蒸馏水中,实验3产生的浑浊物主要为碱式碳酸镁[mMg(OH)2·nMgCO3]。
实验解读分析不同条件下镁与水反应的实验操作如下:
[对点训练1] (2023·广东汕头期中)氮化镁(Mg3N2)是由氮和镁组成的无机化合物。室温下,纯净的氮化镁为黄绿色的粉末,能与水反应,但含有氧化镁杂质的氮化镁是灰白色的,能溶于酸,微溶于乙醇和乙醚。下列说法错误的是( )A.12 g镁在空气中完全燃烧所得产物的质量大于20 gB.要制备氮化镁,可将镁带在氮气中燃烧制成C.氮化镁需要真空密封保存,防水、防潮D.未经政府许可不能将Mg3N2排入周围环境
故12 g镁在空气中完全燃烧所得产物的质量介于16.7~20 g之间,A错误;因为镁还与空气中的氧气等物质反应,要制备氮化镁,可将镁带在氮气中燃烧制成,B正确;Mg3N2与水发生反应: Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑,故需真空密封保存,防水、防潮,C正确;氮化镁与水反应生成的NH3极易溶于水,使溶液呈弱碱性,造成水污染,故不能随意排入环境中,D正确。
考向2 镁及其化合物的制备“微流程”例2如图为海水制镁的工艺流程示意图。下列叙述不正确的是( )
[对点训练2] 以菱镁矿(主要成分为MgCO3,含少量SiO2、Fe2O3和Al2O3)为原料制备高纯镁砂的工艺流程如下:
已知“浸出”时产生的废渣中有SiO2、Fe(OH)3和Al(OH)3。下列说法错误的是( )A.浸出镁的反应为MgO+2NH4Cl═MgCl2+2NH3↑+H2OB.“沉镁”的操作能在较高温度下进行C.分离Mg2+与Al3+、Fe3+是利用了它们氢氧化物Ksp的不同,调节溶液的pH来实现D.流程中可循环使用的物质有NH3、NH4Cl
解析 分析流程可知,“浸出”时杂质不需要考虑,则浸出镁的化学方程式为MgO+2NH4Cl═MgCl2+2NH3↑+H2O,A正确;加入氨水就可将Mg2+转化为沉淀,不需要加热,加热反而会使氨水分解,B错误;Mg2+与Al3+、Fe3+的氢氧化物都是难溶物沉淀,不同的沉淀其Ksp不同,可利用该原理选择沉淀的顺序,可通过调节pH来完成,C正确;“浸出”产生的氨气可溶于水成为氨水,可用于后续的沉镁,“沉镁”时所得的滤液中的氯化铵可用来“浸出”,D正确。
进阶1 练易错·避陷阱1.(2023·广东汕头二模)类推的思维方式在化学研究中发挥着重要作用。下列有关类推的结论正确的是( )A.Al能与NaOH溶液反应,则Mg也可以B.工业上用电解熔融MgCl2的方法冶炼Mg,故也可用电解熔融CaCl2的方法冶炼CaC.S与Fe反应生成FeS,故S与Cu反应也生成CuSD.CO2和SiO2化学式相似,故CO2与SiO2的物理性质也相似
解析 Mg不能与NaOH发生反应,A错误;Mg、Ca均为活泼金属,均采用电解熔融氯化物的方法冶炼,B正确;S与Cu反应生成Cu2S,C错误;SiO2为共价晶体、CO2为分子晶体,两者物理性质差异较大,D错误。
2.(2024·湖南娄底模拟)镓(Ga)与铝同主族,曾被称为“类铝”,其氧化物和氢氧化物均为两性化合物。工业制备镓的流程如图所示。下列推断不合理的是( )
A.Al和Ga的最外层电子数相同B.向GaCl3溶液中逐滴加入足量稀氨水,先生成沉淀,后沉淀溶解C.金属镓(Ga)可以与NaOH溶液反应生成Na[Ga(OH)4]和H2D.Na[Al(OH)4]和少量CO2反应的化学方程式为2Na[Al(OH)4]+CO2═2Al(OH)3↓+Na2CO3+H2O
解析 Al和Ga均为ⅢA族元素,最外层电子数相同,A正确;镓(Ga)与铝同主族,曾被称为“类铝”,其氧化物和氢氧化物均为两性化合物,则氢氧化镓不能溶于氨水,故沉淀不会溶解,B错误;镓(Ga)与铝同主族,曾被称为“类铝”,则镓也会和强碱氢氧化钠反应生成盐Na[Ga(OH)4]和H2,C正确;Na[Al(OH)4]和少量CO2反应生成氢氧化铝沉淀和碳酸钠,化学方程式为2Na[Al(OH)4]+CO2═2Al(OH)3↓+Na2CO3+H2O,故D正确。
进阶2 练热点·提素能3.镁及其合金是用途很广的金属材料。大量的镁是从海水中提取的,主要步骤如下:
下列说法不正确的是( )A.为了使Mg2+转化为Mg(OH)2,试剂①可选用石灰乳B.上述步骤中涉及的反应类型:分解反应、复分解反应C.试剂②可以选用盐酸D.也可以通过电解MgCl2溶液的方法制备Mg
4.工业上用铝土矿(主要成分为Al2O3,还含有杂质SiO2和Fe2O3)提取氧化铝并冶炼Al的操作过程如图,下列说法错误的是( )
进阶3 研真题·明考向5.正误判断:正确的打“√”,错误的打“×”。(1)(2023·浙江6月选考卷,4A)铝有强还原性,故可用于制作门窗框架。( )(2)(2023·湖北卷,5B)用离子方程式表示Al(OH)3溶于烧碱溶液: Al(OH)3+OH-═[Al(OH)4]-。( )(3)(2022·湖北卷,10C)Be(OH)2和Al(OH)3均可表现出弱酸性。( )(4)(2022·浙江6月选考卷,9A)工业上通过电解六水合氯化镁制取金属镁。( )(5)(2022·海南卷,6A)MgCl2溶液中滴加NaOH溶液至过量,产生白色沉淀后沉淀消失。( )(6)(2022·广东卷,6D)铝能形成致密氧化膜,故技术人员用于开发高端耐腐蚀镀铝钢板。( )
6.(2021·湖南卷)一种工业制备无水氯化镁的工艺流程如下:
第17讲 铝、镁及其化合物-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材): 这是一份第17讲 铝、镁及其化合物-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材),共60页。PPT课件主要包含了专项突破,归纳整合等内容,欢迎下载使用。
新高考化学一轮复习精品课件 第4章 第17讲 铝、镁及其化合物 (含解析): 这是一份新高考化学一轮复习精品课件 第4章 第17讲 铝、镁及其化合物 (含解析),共60页。PPT课件主要包含了内容索引,铝及其化合物,铝单质,必备知识,Al2O3+,AlOH3,方案二酸溶法,关键能力,FeOH3,镁海水提镁等内容,欢迎下载使用。
第14讲 铝、镁及其化合物-2024年高考化学一轮复习高频考点精讲(新教材新高考)课件PPT: 这是一份第14讲 铝、镁及其化合物-2024年高考化学一轮复习高频考点精讲(新教材新高考)课件PPT,共35页。PPT课件主要包含了复习目标,铝及其化合物,考点一,必备知识,易错辨析,专项突破,归纳提升,镁海水提镁,考点二,特别提醒等内容,欢迎下载使用。












