

最新高考化学一轮复习【讲通练透】 第30讲 盐类水解(讲通)
展开考纲和考试说明是备考的指南针,认真研究考纲和考试说明,可增强日常复习的针对性和方向性,避免盲目备考,按方抓药,弄清楚高考检测什么,检测的价值取向,高考的命题依据。
2.精练高考真题,明确方向
经过对近几年高考题的横、纵向分析,可以得出以下三点:一是主干知识考查“集中化”,二是基础知识新视角,推陈出新,三是能力考查“综合化”。
3.摸清问题所在,对症下药
要提高后期的备考质量,还要真正了解学生存在的问题,只有如此,复习备考才能更加科学有效。所以,必须加大信息反馈,深入总结学情,明确备考方向,对症开方下药,才能使学生的知识结构更加符合高考立体网络化要求,才能实现基础→能力→分数的转化。
4.切实回归基础,提高能力
复习训练的步骤包括强化基础,突破难点,规范作答,总结方法,通过这样的总结,学生印象深刻,应用更加灵活。
第30讲 盐类水解
目录
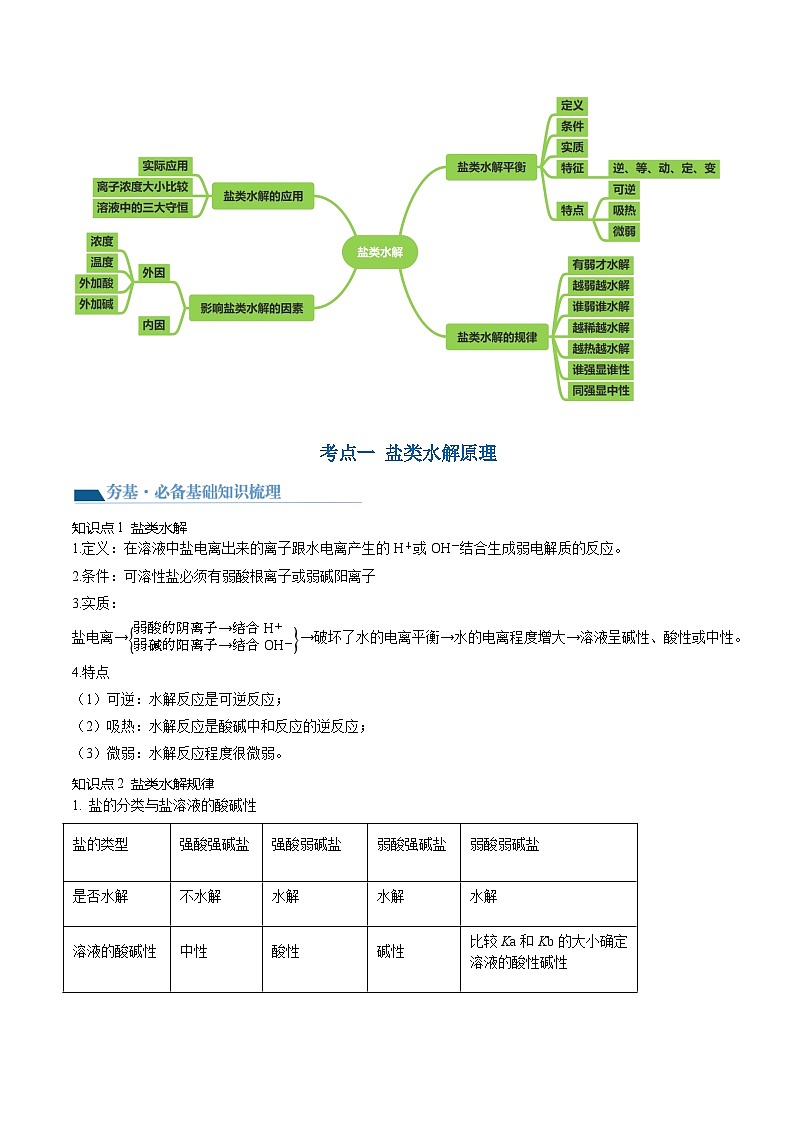
考情分析
网络构建
考点一 盐类水解原理
【夯基·必备基础知识梳理】
知识点1 盐类水解
知识点2 盐类水解规律
知识点3 盐类水解方程式的书写
【提升·必考题型归纳】
考向1 考查盐类的水解及溶液的酸碱性
考向2 考查盐类水解规律及应用
考点二 盐类水解的影响因素及应用
【夯基·必备基础知识梳理】
知识点1 影响盐类水解的因素
知识点2 盐类水解的应用
知识点3 水解常数及应用
【提升·必考题型归纳】
考向1 考查盐类水解的影响因素
考向2 考查盐类水解的应用
考向3 考查水解常数的应用与计算
考点三 水溶液中粒子的数量关系
【夯基·必备基础知识梳理】
知识点1 电解质溶液中的三大守恒
知识点2 电解质溶液中粒子浓度大小比较
知识点3 水溶液中函数图像分析
【提升·必考题型归纳】
考向1 考查单一溶液中粒子浓度大小比较
考向2 考查混合溶液中粒子浓度大小比较
真题感悟
考点一 盐类水解原理
知识点1 盐类水解
1.定义:在溶液中盐电离出来的离子跟水电离产生的H+或OH-结合生成弱电解质的反应。
2.条件:可溶性盐必须有弱酸根离子或弱碱阳离子
3.实质:
盐电离→eq \b\lc\{\rc\}(\a\vs4\al\c1(弱酸的阴离子→结合H+,弱碱的阳离子→结合OH-))→破坏了水的电离平衡→水的电离程度增大→溶液呈碱性、酸性或中性。
4.特点
(1)可逆:水解反应是可逆反应;
(2)吸热:水解反应是酸碱中和反应的逆反应;
(3)微弱:水解反应程度很微弱。
知识点2 盐类水解规律
1. 盐的分类与盐溶液的酸碱性
2.盐类水解规律:
“有弱才水解、无弱不水解、越弱越水解、都弱都水解、越热越水解、越稀越水解、谁强显谁性、同强是中性”。
知识点3 盐类水解方程式的书写
1.一般要求
水解记三点:①水写分子式,②中间用可逆(),③后无沉气出。即盐类水解一般不会产生沉淀和气体,所以不用符号“↓”和“↑”表示水解产物。如NH4Cl水解的离子方程式为NHeq \\al(+,4)+H2ONH3·H2O+H+。
2.三种类型的盐水解离子方程式的书写
①多元弱酸盐水解:分步进行,水解离子方程式要分步表示,以第一步为主,一般只写第一步水解方程式。如Na2CO3水解的离子方程式为COeq \\al(2-,3)+H2OHCOeq \\al(-,3)+OH-。
②多元弱碱盐水解:水解离子方程式一步写完。
如FeCl3水解的离子方程式为Fe3++3H2OFe(OH)3+3H+。
③阴、阳离子相互促进的水解:水解程度较大(即产生沉淀),书写时要用“===”、“↑”、“↓”等。如Na2S溶液与AlCl3溶液混合水解的离子方程式为2Al3++3S2-+6H2O===2Al(OH)3↓+3H2S↑。
注意:多元弱酸阴离子分步水解,分步书写;多元弱碱阳离子分步水解,一步书写。
考向1 考查盐类的水解及溶液的酸碱性
例1.(2023·河北衡水·衡水市第二中学校考三模)实验测得等物质的量浓度的和溶液的pH随温度变化如图所示。下列说法正确的是
A.曲线①是溶液变化曲线
B.C点之前,升高温度两条曲线pH均减小,说明水解程度减弱
C.D点时的溶质为
D.若将D点降温至25℃,其pH范围为8.62
A.B.C.D.
考向2 考查盐类水解规律及应用
例2.(2023·全国·模拟预测)实验测得浓度均为的溶液和溶液的pH随温度的变化情况如图所示。下列说法错误的是
A.时,的电离平衡常数约为
B.后,溶液的pH随温度的升高而增大的原因可能是的挥发
C.升高温度,溶液中减小,增大,pH减小
D.溶液中存在:
【变式训练】(2023·安徽滁州·安徽省定远县第三中学校考二模)如下图所示,只有未电离的HA分子可自由通过交换膜。常温下,往甲室和乙室中分别加入的溶液()和的HA溶液(),达到平衡后,下列说法正确的是
A.常温下,HA的电离度约为0.1%
B.平衡后,甲、乙两室的pH相等
C.平衡后,甲室中的物质的量浓度小于乙室中的物质的量浓度
D.若用等物质的量浓度的NaA溶液代替溶液,则通过交换膜的HA分子的量减少
考点二 盐类水解的影响因素及应用
知识点1 影响盐类水解的因素
1.内因:形成盐的酸或碱越弱,其盐就越易水解。如水解程度:Na2CO3>Na2SO3,Na2CO3>NaHCO3。
2.外因eq \b\lc\{\rc\ (\a\vs4\al\c1(溶液的浓度:浓度越小水解程度越大,温度:温度越高水解程度越大,外加酸碱\b\lc\{\rc\ (\a\vs4\al\c1(酸:弱酸根离子的水解程度增大,弱碱阳离子的水解程度减小,碱:弱酸根离子的水解程度减小,弱碱阳离子的水解程度增大))))
3.以FeCl3水解为例[Fe3++3H2OFe(OH)3+3H+],填写外界条件对水解平衡的影响。
知识点2 盐类水解的应用
1.盐类水解的重要应用
2.熟记下列因相互促进水解不能大量共存的离子组合
(1)Al3+与HCOeq \\al(-,3)、COeq \\al(2-,3)、AlOeq \\al(-,2)、SiOeq \\al(2-,3)、HS-、S2-、ClO-。
(2)Fe3+与HCOeq \\al(-,3)、COeq \\al(2-,3)、AlOeq \\al(-,2)、SiOeq \\al(2-,3)、ClO-。
(3)NHeq \\al(+,4)与SiOeq \\al(2-,3)、AlOeq \\al(-,2)。
3.盐溶液蒸干灼烧时所得产物的判断
❶盐溶液水解生成难挥发性酸时,蒸干后一般得原物质,如CuSO4(aq)eq \(――→,\s\up7(蒸干))CuSO4(s);
盐溶液水解生成易挥发性酸时,蒸干灼烧后一般得对应的氧化物,如AlCl3(aq)eq \(――→,\s\up7(蒸干))Al(OH)3eq \(――→,\s\up7(灼烧))Al2O3。
❷酸根离子易水解的强碱盐,如Na2CO3溶液等蒸干后可得到原物质。
❸考虑盐受热时是否分解。Ca(HCO3)2、NaHCO3、KMnO4、NH4Cl固体受热易分解,因此蒸干灼烧后分别为Ca(HCO3)2―→CaCO3(CaO);NaHCO3―→Na2CO3;KMnO4―→K2MnO4和MnO2;NH4Cl―→NH3↑+HCl↑。
❹还原性盐在蒸干时会被O2氧化。如Na2SO3(aq)蒸干得Na2SO4(s)。
❺弱酸的铵盐蒸干后无固体。如NH4HCO3、(NH4)2CO3。
4.缓冲溶液
(1)概念:能够抵御少量外来的酸、碱或稀释,而保持溶液的pH基本不变的溶液叫缓冲溶液。
(2)缓冲溶液的范围:pH=pKa±1 (浓度之比10倍或1/10)。
(3)缓冲溶液的类型
知识点3 水解常数及应用
1.数学表达式
用HA表示酸,用MOH表示碱,MA表示由它们生成的盐,在MA溶液中,若M+、A-均能水解,A-+H2OHA+OH-,则A-的水解常数为Kh=eq \f(c(HA)·c(OH-),c(A-));M++H2OMOH+H+,则M+的水解常数为Kh=eq \f(c(H+)·c(MOH),c(M+))。
2.水解常数与电离常数的关系
1)推导:若NaA为强碱弱酸盐,A-+H2OHA+OH-,Kh=eq \f(c(HA)·c(OH-),c(A-))=eq \f(c(HA)·c(OH-)·c(H+),c(A-)·c(H+))=eq \f(KW,Ka(HA));若MCl为强酸弱碱盐,同理可得Kh=eq \f(KW,Kb(MOH))。
2)Kh与Ka(或Kb)、KW的关系
(1)一元弱酸盐:Ka·Kh=KW
(2)一元弱碱盐:Kb·Kh=KW
(3)多元弱酸盐,如NamA溶液:Kh=eq \f(KW,Ka(m)) Nam-1HA溶液Kh=eq \f(KW,Ka(m-1)) 依次类推……
3.意义
水解常数可以表示盐的水解程度的大小,Kh越大,盐类水解程度越大。
4.外界影响因素
水解常数是只是温度的函数,Kh随温度的升高而增大。
5.水解常数的应用
(1)计算盐溶液中的c(H+)或c(OH-)
Kh=eq \f(c2(OH-),c-c(OH-))≈eq \f(c2(OH-),c),c(OH-)=eq \r(c·Kh);同理,对于M++H2OMOH+H+,c(H+)=eq \r(c·Kh)。
(2)判断水解程度大小、盐溶液的酸碱性
如,对于CH3COONH4溶液,由Ka(CH3COOH)≈Kb(NH3·H2O)可知,Kh(CH3COO-)≈Kh(NHeq \\al(+,4)),CH3COO-和NHeq \\al(+,4)水解程度相同,CH3COONH4溶液呈中性,c(H+)=c(OH-)。
(3)判断水解程度和电离程度大小,盐溶液的酸碱性。
①单一溶液。
如,对于NaHCO3溶液,Kh(HCOeq \\al(-,3))=eq \f(KW,Ka(H2CO3))=eq \f(1×10-14,4.4×10-7)=2.3×10-8,Ka(HCOeq \\al(-,3))=4.7×10-11<Kh(HCOeq \\al(-,3)),HCOeq \\al(-,3)电离程度小于其水解程度,溶液呈碱性,c(H+)<c(OH-)。
②混合溶液。
如,对于等物质的量浓度的CH3COOH、CH3COONa混合溶液,Ka(CH3COOH)=1.75×10-5,Kh(CH3COO-)=eq \f(KW,Ka(CH3COOH))=eq \f(1×10-14,1.75×10-5)=5.7×10-10<Ka(CH3COOH),CH3COO-的水解程度小于CH3COOH的电离程度,溶液显酸性,c(H+)>c(OH-)。
考向1 考查盐类水解的影响因素
例1.(2023·广东梅州·统考三模)25 °C时,Ka(HClO)=4.0×10-8。下 列说法正确的是
A.25°C时,往pH=3的HClO溶液中加少量NaClO固体,HClO的电离程度和水电离出的c(H+ )均减小
B.将浓度均为0.1ml·L-1的NaClO和NaOH溶液加热,两种溶液的pH均变大
C.相同温度下,等pH的HCOONa和NaClO溶液中存在:c(HCOO- )>c(ClO- )
D.25 °C时,pH=7的NaClO和HClO混合溶液中存在:c(HClO)
A.图中实线表示pH随加水量的变化,虚线表示pH随温度的变化
B.将NH4Cl溶液加水稀释至浓度ml•L-1,溶液pH变化值小于lgx
C.随温度升高,Kw增大,CH3COONa溶液中c(H+)增大,pH减小,c(OH-)减小
D.25℃时稀释相同倍数的NH4Cl溶液与CH3COONa溶液中:c(Na+)-c(CH3COO-)=c(Cl-)-c(NH)
考向2 考查盐类水解的应用
例2.(2023·广东惠州·统考一模)勤劳致富,越努力越幸福。下列劳动项目与所述的化学知识没有关联的是
【变式训练】(2023·河南·校联考模拟预测)氯化铁是实验室中经常使用的物质,根据下列实验目的设计的实验方案正确的是
考向3 考查水解常数的应用与计算
例3.(2023·陕西西安·统考一模)25℃时,将HCl气体缓慢通入0.1ml•L-1的氨水中,溶液的pH、体系中粒子浓度的对数值(lgc)与反应物的物质的量之比[t=]的关系如图所示。若忽略溶液体积变化,下列有关说法错误的是
A.t=0.5时,c(NH)>c(Cl-)
B.25℃时,NH的水解平衡常数Kh的数量级为10-10
C.P1所示溶液:2c(Cl-)=c(NH)+c(NH3•H2O)
D.P2所示溶液:c(Cl-)>100c(NH3•H2O)
【变式训练】(2023·陕西咸阳·统考三模)某化学兴趣小组利用传感技术探究0.01ml•L-1的碳酸钠溶液滴定100mL0.01ml•L-1盐酸溶液的实验,得到反应过程中的c()、c()、c(H2CO3)的变化曲线(假定滴定过程中H2CO3不分解和忽略CO2的逸出)如图所示。下列说法正确的是
已知:25℃时,H2CO3的Ka1=4×10-7,Ka2=5×10-11;lg4=0.6。
A.曲线I为c(HCO)的变化曲线,V1=10
B.25℃时,碳酸钠的水解常数Kh1=2.5×10-8
C.水的电离程度:a>c>b
D.c点溶液pH=6.4
考点三 水溶液中粒子的数量关系
知识点1 电解质溶液中的三大守恒
1.电荷守恒规律
电解质溶液中,无论存在多少种离子,溶液都呈电中性,即阴离子所带负电荷总数一定等于阳离子所带正电荷总数。如NaHCO3溶液中存在着Na+、H+、HCOeq \\al(-,3)、COeq \\al(2-,3)、OH-,存在如下关系:c(Na+)+c(H+)=c(HCOeq \\al(-,3))+c(OH-)+2c(COeq \\al(2-,3))。
2.物料守恒规律
电解质溶液中,由于某些离子能够水解,离子种类增多,但元素的原子总是守恒的,或两种原子的数目比是固定的。如NaHCO3溶液中存在着Na+、H+、H2CO3、HCOeq \\al(-,3)、COeq \\al(2-,3)、OH-,Na与C比为1:1,故存在如下关系:c(Na+)=c(H2CO3)+c(HCOeq \\al(-,3))+c(COeq \\al(2-,3))。
3.质子守恒规律
①电解质溶液中,分子(或离子)得失质子(H+)的物质的量应相等。
如Na2S水溶液中的质子转移情况图示如下:
即给出H+后剩余微粒浓度之和等于得到H+后生成微粒浓度之和,故由图可得Na2S水溶液中质子守恒式:c(H3O+)+2c(H2S)+c(HS-)=c(OH-)或c(H+)+2c(H2S)+c(HS-)=c(OH-)。质子守恒的关系式也可以由电荷守恒式与物料守恒式推导得到。
②可以通过物料守恒和电荷守恒推出质子守恒表达式。如NaHCO3溶液中物料守恒:
c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-)①,
电荷守恒:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-)②,
将①代入②中,整理得质子守恒:c(H2CO3)+c(H+)=c(OH-)+c(CO32-)
【易错提醒】混合溶液的质子守恒只能采用第2种方法求得。
知识点2 电解质溶液中粒子浓度大小比较
1.单一溶液中粒子浓度的比较
(1)多元弱酸溶液:多元弱酸分步电离,电离程度逐级减弱。
如H3PO4溶液中:c(H+)>c(H2PO4-)>c(HPO42-)>c(PO43-)。
(2)多元弱酸的正盐溶液:多元弱酸的酸根离子分步水解,水解程度逐级减弱。
如在Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)。
(3)多元弱酸酸式盐:分析酸式酸根电离与水解大小。
如NaHCO3溶液中HCO3-水解大于电离,则;c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(H+)>c(CO32-)。
NaHSO3溶液中HSO3-电离大于水解,则c(Na+)>c(HSO3-)c(H+)>c(SO32-)>c(OH-)>c(H2SO3)。
2.混合溶液中各离子浓度的比较
混合溶液要综合分析电离、水解等因素。如在0.1 ml·L-1 NH4Cl溶液和0.1 ml·L-1的氨水混合溶液中,各离子浓度大小的顺序为c(NH4+)>c(Cl-)>c(OH-)>c(H+)。
3.不同溶液中同一离子浓度的比较
不同溶液要看溶液中其他离子对该离子的影响。如在相同物质的量浓度的下列溶液中:①NH4Cl②CH3COONH4③NH4HSO4,c(NH4+)由大到小的顺序为③>①>②。
4.电解质溶液中粒子浓度大小比较的思维模型
知识点3 水溶液中函数图像分析
1.稀释曲线
(1)同体积、同浓度的盐酸、醋酸加水稀释
(2)同体积、同pH的盐酸、醋酸加水稀释
(3)稀释倍数与pH的线性关系
2.滴定曲线
3.分布分数曲线
(1)分布曲线图是指以pH为横坐标,分布系数(即组分的平衡浓度占总浓度的分数)为纵坐标,分布系数与溶液pH之间的关系曲线。弱电解质分布系数图本质上就是酸碱中和滴定过程中粒子含量的变化曲线。分布曲线是指以pH为横坐标、分布系数(即组分的平衡浓度占总浓度的分数)为纵坐标的关系曲线
(2)分布系数图的应用:①能读出电离常数;②能比较在溶液在某一特定pH时离子浓度的大小;能快速判断等浓度的缓冲溶液的酸碱性,由此比较得出电离与水解的大小。
考向1 考查单一溶液中粒子浓度大小比较
例1.(2023·广东·统考模拟预测)测定溶液升温过程中的pH(不考虑水的蒸发、溶液体积的变化),数据如下。
下列说法错误的是
A.25℃时,的一级水解常数的数量级为
B.温度升高后溶液碱性减弱
C.溶液中
D.温度升高pH变小是Kw增大与水解平衡移动共同作用的结果
【变式训练】(2023·广东惠州·统考模拟预测)是一种弱碱,可与盐酸反应生成。下列叙述正确的是
A.常温时,0.1ml/L水溶液的
B.0.1ml/L水溶液加水稀释,升高
C.0.1ml/L水溶液中:
D.水溶液中:
考向2 考查混合溶液中粒子浓度大小比较
例2.(2023·河北沧州·校考三模)常温下,用0.1000 ml⋅L-1的NaOH溶液滴定0.1000 ml⋅L-1的溶液,获得的滴定曲线如图所示。横坐标为滴定分数(w),滴定分数是指滴定过程中标准溶液与待测溶液中溶质的物质的量之比。忽略溶液混合时的体积变化,下列说法正确的是
A.a点溶液中, ml⋅L-1
B.b点溶液中,
C.b点到c点反应的离子方程式为
D.若用甲基橙做指示剂,则时溶液显红色
【变式训练】(2021·广东广州·广州市培正中学校考三模)25℃时,有的一组醋酸、醋酸钠混合溶液,溶液中、与pH的关系如图所示。下列有关溶液中离子浓度关系的叙述错误的是
A.的溶液中:
B.W点的溶液中:
C.的溶液中:
D.向W点所表示的1.0L溶液中通入0.05mlHCl气体(溶液体积变化可忽略):
1.(2023·浙江·高考真题)硫酸铜应用广泛,下列说法不正确的是
A.元素位于周期表p区B.硫酸铜属于强电解质
C.硫酸铜溶液呈酸性D.硫酸铜能使蛋白质变性
2.(2022·浙江·统考高考真题)关于反应,达到平衡后,下列说法不正确的是
A.升高温度,氯水中的减小
B.氯水中加入少量醋酸钠固体,上述平衡正向移动,增大
C.取氯水稀释,增大
D.取两份氯水,分别滴加溶液和淀粉KI溶液,若前者有白色沉淀,后者溶液变蓝色,可以证明上述反应存在限度
3.(2022·北京·高考真题)2022年3月神舟十三号航天员在中国空间站进行了“天宫课堂”授课活动。其中太空“冰雪实验”演示了过饱和醋酸钠溶液的结晶现象。下列说法不正确的是
A.醋酸钠是强电解质
B.醋酸钠晶体与冰都是离子晶体
C.常温下,醋酸钠溶液的
D.该溶液中加入少量醋酸钠固体可以促进醋酸钠晶体析出
4.(2023·湖南·统考高考真题)常温下,用浓度为的标准溶液滴定浓度均为的和的混合溶液,滴定过程中溶液的随()的变化曲线如图所示。下列说法错误的是
A.约为
B.点a:
C.点b:
D.水的电离程度:
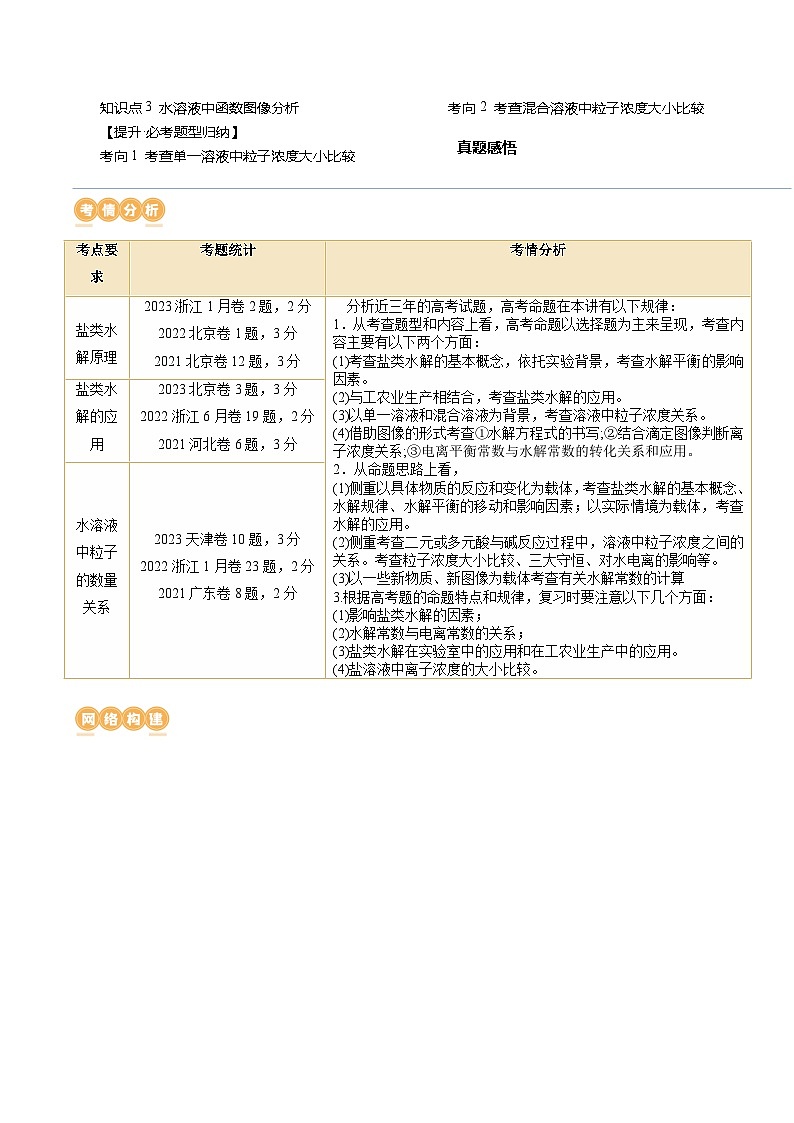
考点要求
考题统计
考情分析
盐类水解原理
2023浙江1月卷2题,2分
2022北京卷1题,3分
2021北京卷12题,3分
分析近三年的高考试题,高考命题在本讲有以下规律:
1.从考查题型和内容上看,高考命题以选择题为主来呈现,考查内容主要有以下两个方面:
(1)考查盐类水解的基本概念,依托实验背景,考查水解平衡的影响因素。
(2)与工农业生产相结合,考查盐类水解的应用。
(3)以单一溶液和混合溶液为背景,考查溶液中粒子浓度关系。
(4)借助图像的形式考查①水解方程式的书写;②结合滴定图像判断离子浓度关系;③电离平衡常数与水解常数的转化关系和应用。
2.从命题思路上看,
(1)侧重以具体物质的反应和变化为载体,考查盐类水解的基本概念、水解规律、水解平衡的移动和影响因素;以实际情境为载体,考查水解的应用。
(2)侧重考查二元或多元酸与碱反应过程中,溶液中粒子浓度之间的关系。考查粒子浓度大小比较、三大守恒、对水电离的影响等。
(3)以一些新物质、新图像为载体考查有关水解常数的计算
3.根据高考题的命题特点和规律,复习时要注意以下几个方面:
(1)影响盐类水解的因素;
(2)水解常数与电离常数的关系;
(3)盐类水解在实验室中的应用和在工农业生产中的应用。
(4)盐溶液中离子浓度的大小比较。
盐类水解的应用
2023北京卷3题,3分
2022浙江6月卷19题,2分
2021河北卷6题,3分
水溶液中粒子的数量关系
2023天津卷10题,3分
2022浙江1月卷23题,2分
2021广东卷8题,2分
盐的类型
强酸强碱盐
强酸弱碱盐
弱酸强碱盐
弱酸弱碱盐
是否水解
不水解
水解
水解
水解
溶液的酸碱性
中性
酸性
碱性
比较Ka和Kb的大小确定溶液的酸性碱性
代表物
NaCl、KNO3
NH4Cl、CuSO4
Na2S、Na2CO3
CH3COONH4(中性溶液)
注意
酸式盐不能通过简单分类来判断其溶液的酸碱性:
NaHSO4不水解,但是其溶液显酸性;
NaHSO3电离大于水解,其溶液显酸性;
NaHCO3水解大于电离,其溶液显酸性。
条件
移动方向
H+数
pH
现象
升温
向右
增多
减小
颜色变深
通HCl
向左
增多
减小
颜色变浅
加H2O
向右
增多
增大
颜色变浅
加NaHCO3
向右
减小
增大
生成红褐色沉淀,放出气体
应用
举例
判断溶液的
酸碱性
FeCl3溶液显酸性,原因是Fe3++3H2OFe(OH)3+3H+
判断酸性强弱
等物质的量浓度的NaX、NaY、NaZ三种盐溶液的pH分别为8、9、10,则酸性:HX>HY>HZ
配制或贮存易
水解的盐溶液
配制CuSO4溶液时,加入少量H2SO4,防止Cu2+水解;配制FeCl3溶液,加入少量盐酸;贮存Na2CO3溶液、Na2SiO3溶液不能用带磨口玻璃塞的试剂瓶
胶体的制取
制取Fe(OH)3胶体的离子方程式:Fe3++3H2Oeq \(=====,\s\up7(△))Fe(OH)3(胶体)+3H+
泡沫灭火器
原理
成分为NaHCO3与Al2(SO4)3,发生反应为Al3++3HCOeq \\al(-,3)===Al(OH)3↓+3CO2↑
作净水剂
明矾可作净水剂,原理为Al3++3H2OAl(OH)3(胶体)+3H+
化肥的使用
铵态氮肥与草木灰不得混用
除锈剂
NH4Cl与ZnCl2溶液可作焊接时的除锈剂
比较溶液中离子
浓度的大小
如:Na2CO3溶液中离子浓度由大到小的顺序为c(Na+)>c(COeq \\al(2-,3))>c(OH-)>c(HCOeq \\al(-,3))>c(H+)
判断盐溶液
蒸干时的产物
盐水解生成挥发性酸,蒸干灼烧后一般得氧化物。如AlCl3→Al2O3
盐水解生成难挥发性酸,蒸干后得原物质。如CuSO4→CuSO4
考虑盐受热时是否分解。如KMnO4→K2MnO4和MnO2
还原性盐溶液蒸干时会被O2氧化。如Na2SO3→Na2SO4
弱酸的铵盐溶液蒸干后无固体剩余。如NH4HCO3、(NH4)2CO3
类型
举例
等浓度的混合溶液的酸碱性
弱酸-弱酸盐
CH3COOH-CH3COONa
酸性;pH=4.76
弱碱-弱碱盐
NH3∙H2O-NH4Cl
碱性;pH=9.25
正盐-酸式盐
Na2CO3-NaHCO3
碱性;pH=10.30
酸式盐-酸
NaHC2O4-H2C2O4
酸性;pH=1.68
选项
劳动项目
化学知识
A
明矾净水
明矾具有氧化性
B
小苏打用作发泡剂烘焙面包
小苏打受热分解产生气体
C
用热的纯碱溶液洗去油污
热的纯碱溶液水解显碱性
D
用厨余垃圾制肥料
厨余垃圾含N、P等元素
选项
实验目的
实验方案
A
实验室配制FeCl3溶液
称量一定质量的氯化铁固体先溶于较浓的盐酸中,再加入蒸馏水稀释至所需浓度
B
检验配制的FeCl3溶液中是否含有Fe2+
向酸性高锰酸钾溶液中滴入少量氯化铁溶液,观察溶液颜色的变化
C
制备氢氧化铁胶体并鉴别氯化铁溶液与氢氧化铁胶体
煮沸少许饱和氯化铁溶液一段时间后,采用丁达尔现象鉴别所得物质和氯化铁溶液
D
验证铁离子的氧化性
向FeCl3溶液中先滴加一定量的NaF溶液,再滴加几滴KSCN溶液,未出现红色
加水稀释一样的倍数,醋酸的pH大
加水稀释到一样的pH,盐酸加入的水多
加水稀释一样的倍数,盐酸的pH大
加水稀释到一样的pH,醋酸加入的水多
①HY为强酸、HX为弱酸
②ab两点的溶液中:c(X-)=c(Y-)
③水的电离程度:d>c>a=b
①MOH为强碱、ROH为弱碱
②c(ROH)>c(MOH)
③水的电离程度:a>b
氢氧化钠滴定等浓度等体积的盐酸、醋酸的滴定曲线
盐酸滴定等浓度等体积的氢氧化钠、氨水的滴定曲线
一元弱酸(以CH3COOH为例)
二元酸(以草酸H2C2O4为例)
δ0为CH3COOH分布系数,δ1为CH3COO-分布系数
δ0为H2C2O4分布系数、δ1为HC2O eq \\al(\s\up11(-),\s\d4(4)) 分布系数、δ2为C2O eq \\al(\s\up11(2-),\s\d4(4)) 分布系数
温度/℃
25
40
60
80
pH
11.90
11.68
11.54
11.42
最新高考化学一轮复习【讲通练透】 第28讲 电离平衡(讲通): 这是一份最新高考化学一轮复习【讲通练透】 第28讲 电离平衡(讲通),文件包含第28讲电离平衡讲通教师版docx、第28讲电离平衡讲通学生版docx等2份试卷配套教学资源,其中试卷共30页, 欢迎下载使用。
最新高考化学一轮复习【讲通练透】 第25讲 化学反应平衡(讲通): 这是一份最新高考化学一轮复习【讲通练透】 第25讲 化学反应平衡(讲通),文件包含第25讲化学反应平衡讲通教师版docx、第25讲化学反应平衡讲通学生版docx等2份试卷配套教学资源,其中试卷共35页, 欢迎下载使用。
最新高考化学一轮复习【讲通练透】 第24讲 化学反应速率(讲通): 这是一份最新高考化学一轮复习【讲通练透】 第24讲 化学反应速率(讲通),文件包含第24讲化学反应速率讲通教师版docx、第24讲化学反应速率讲通学生版docx等2份试卷配套教学资源,其中试卷共47页, 欢迎下载使用。












