

最新高考化学一轮复习【讲通练透】 第28讲 电离平衡(讲通)
展开考纲和考试说明是备考的指南针,认真研究考纲和考试说明,可增强日常复习的针对性和方向性,避免盲目备考,按方抓药,弄清楚高考检测什么,检测的价值取向,高考的命题依据。
2.精练高考真题,明确方向
经过对近几年高考题的横、纵向分析,可以得出以下三点:一是主干知识考查“集中化”,二是基础知识新视角,推陈出新,三是能力考查“综合化”。
3.摸清问题所在,对症下药
要提高后期的备考质量,还要真正了解学生存在的问题,只有如此,复习备考才能更加科学有效。所以,必须加大信息反馈,深入总结学情,明确备考方向,对症开方下药,才能使学生的知识结构更加符合高考立体网络化要求,才能实现基础→能力→分数的转化。
4.切实回归基础,提高能力
复习训练的步骤包括强化基础,突破难点,规范作答,总结方法,通过这样的总结,学生印象深刻,应用更加灵活。
第28讲 电离平衡
目录
考情分析
网络构建
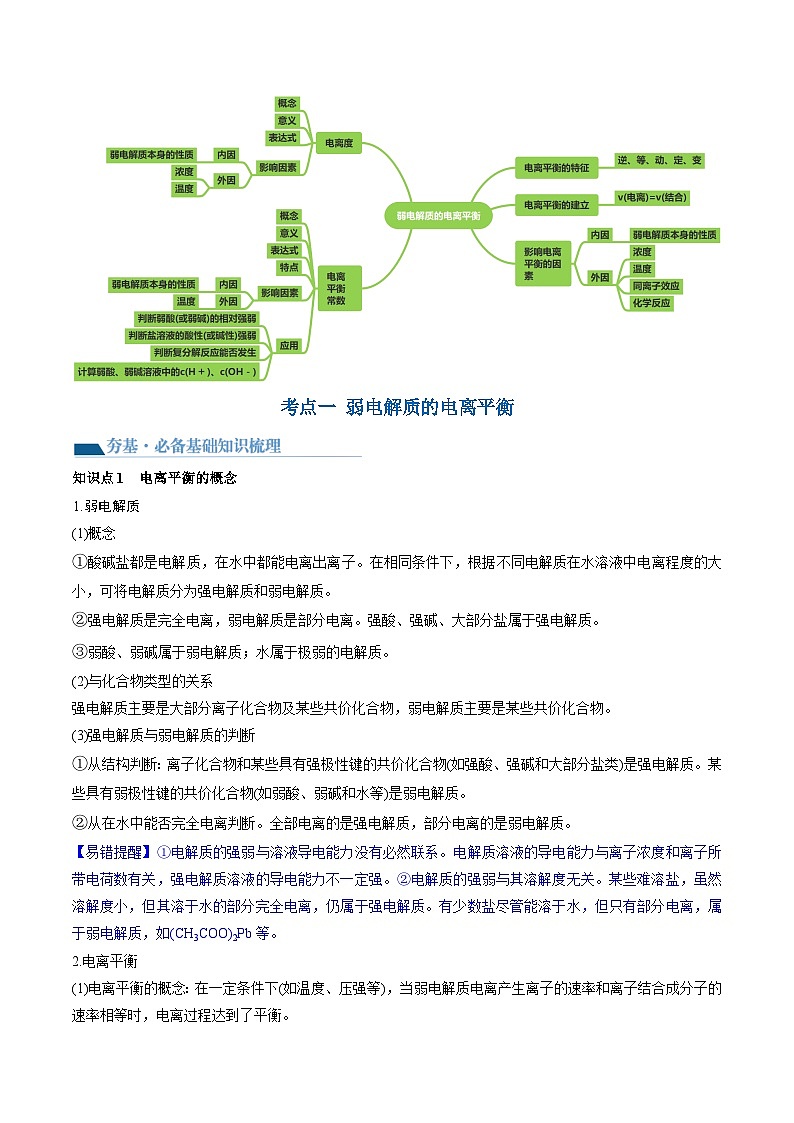
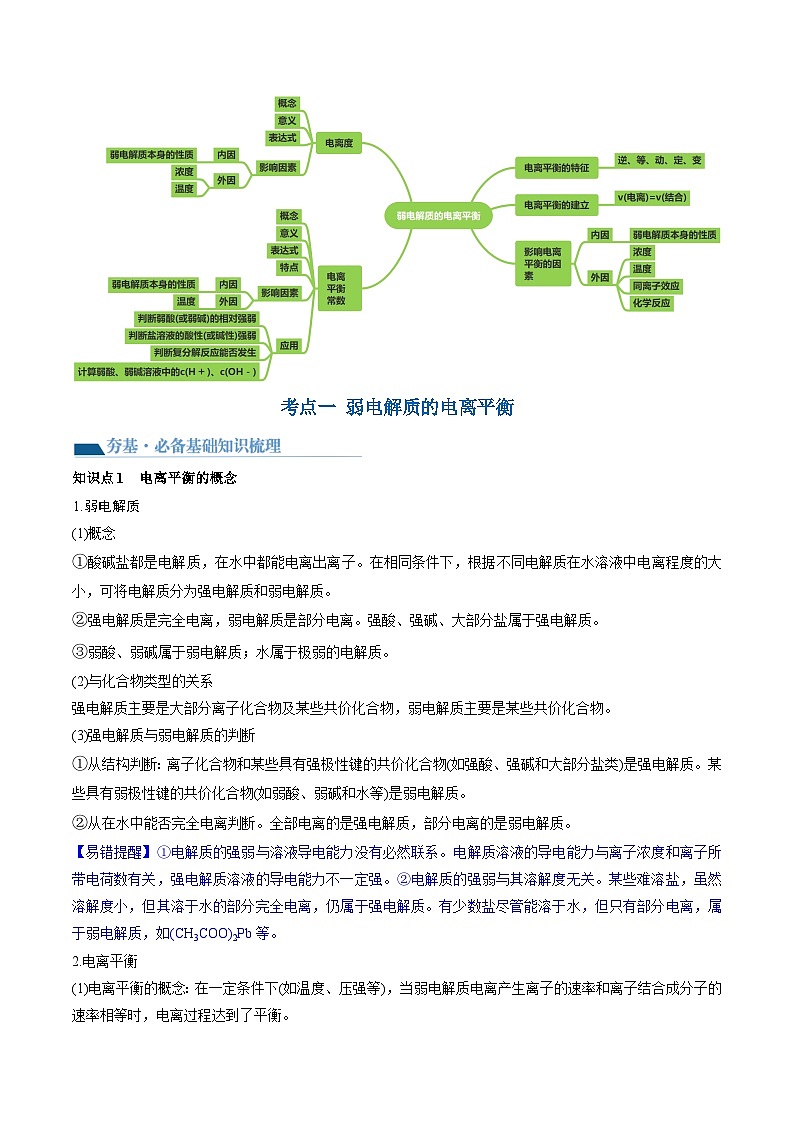
考点一 弱电解质的电离平衡
【夯基·必备基础知识梳理】
知识点1 弱电解质的电离平衡概念
知识点2 影响电离平衡的因素
【提升·必考题型归纳】
考向1 考查弱电解质的判断及溶液导电性
考向2 考查电离平衡的影响因素
考点二 电离度、电离平衡常数
【夯基·必备基础知识梳理】
知识点1 电离度
知识点2 电离常数
知识点3 强酸(碱)与弱酸(碱)的比较
知识点4 自偶电离
【提升·必考题型归纳】
考向1 考查电离常数的应用
考向2 考查电离常数的计算
真题感悟
考点一 弱电解质的电离平衡
知识点1 电离平衡的概念
1.弱电解质
(1)概念
①酸碱盐都是电解质,在水中都能电离出离子。在相同条件下,根据不同电解质在水溶液中电离程度的大小,可将电解质分为强电解质和弱电解质。
②强电解质是完全电离,弱电解质是部分电离。强酸、强碱、大部分盐属于强电解质。
③弱酸、弱碱属于弱电解质;水属于极弱的电解质。
(2)与化合物类型的关系
强电解质主要是大部分离子化合物及某些共价化合物,弱电解质主要是某些共价化合物。
(3)强电解质与弱电解质的判断
①从结构判断:离子化合物和某些具有强极性键的共价化合物(如强酸、强碱和大部分盐类)是强电解质。某些具有弱极性键的共价化合物(如弱酸、弱碱和水等)是弱电解质。
②从在水中能否完全电离判断。全部电离的是强电解质,部分电离的是弱电解质。
【易错提醒】①电解质的强弱与溶液导电能力没有必然联系。电解质溶液的导电能力与离子浓度和离子所带电荷数有关,强电解质溶液的导电能力不一定强。②电解质的强弱与其溶解度无关。某些难溶盐,虽然溶解度小,但其溶于水的部分完全电离,仍属于强电解质。有少数盐尽管能溶于水,但只有部分电离,属于弱电解质,如(CH3COO)2Pb等。
2.电离平衡
(1)电离平衡的概念:在一定条件下(如温度、压强等),当弱电解质电离产生离子的速率和离子结合成分子的速率相等时,电离过程达到了平衡。
(2)电离平衡的建立
①开始时,v(电离)最大,而v(结合)为0。
②平衡的建立过程中,v(电离)>v(结合)。
③当v(电离)=v(结合)时,电离过程达到平衡状态。
(3)电离平衡的特征
(4)电离平衡的特点
①电离过程是吸热的。
②动态平衡:即达到平衡时,正反应和逆反应还在继续进行,正反应速率和逆反应速率相等,不等于零。
③条件改变,平衡被打破。
④弱电解质在离子反应中电离平衡发生移动。
⑤弱电解质在溶液中的电离都是微弱的。在弱电解质溶液中,由于存在电离平衡只有一部分分子发生电离,绝大多数以分子形式存在,离子和分子之间存在电离平衡,即分子、离子共存,决定了它在离子方程式书写中要写成分子形式。
3.弱电解质的电离方程式
(1)弱电解质的电离方程式的书写用“”表示。如NH3·H2O的电离方程式是NH3·H2ONHeq \\al(+,4)+OH-、CH3COOH 的电离方程式为CH3COOHCH3COO-+H+。
(2)多元弱酸是分步电离的,电离程度逐步减弱,可分步书写电离方程式。如H2CO3的电离方程式是H2CO3H++HCOeq \\al(-,3),HCOeq \\al(-,3)H++COeq \\al(2-,3)。
(3)多元弱碱的电离也是分步进行的,但是一般按一步电离的形式书写。如Fe(OH)3的电离方程式是Fe(OH)3Fe3++3OH-。
知识点2 影响电离平衡的因素
1.内因:弱电解质本身的性质。
2.外因
①温度:温度越高,电离程度越大。
②浓度:在一定温度下同一弱电解质溶液中,溶液浓度越小,越易电离。
③同离子效应:加入与弱电解质具有相同离子的电解质时,可使电离平衡向结合成弱电解质分子的方向移动。
④化学反应:加入能与弱电解质电离出的离子反应的物质时,可使电离平衡向电离方向移动。
如:以0.1 ml·L-1 CH3COOH溶液为例,填写外界条件对CH3COOHCH3COO-+H+ ΔH>0的影响。
3.电解质溶液的导电性
(1)电解质导电的条件
电解质的导电条件是在水溶液中或高温熔融状态,共价化合物只能在水溶液中导电,离子化合物在熔融状态和溶液中均可导电。
(2)导电性强弱eq \b\lc\{(\a\vs4\al\c1(离子浓度\b\lc\{(\a\vs4\al\c1(溶液浓度,电离程度)),离子所带电荷))
考向1 考查弱电解质的判断及溶液的导电性
例1.(2023·天津河东·统考二模)常温下,下列事实能说明某一元酸是一元强酸的是
A.溶液的
B.溶液
C.溶液比硝酸导电能力弱
D.溶液与溶液混合
【变式训练】(2023·北京海淀·统考二模)分别测定不同浓度溶液、溶液和溶液的电导率()数值,测定结果的数据处理如下表。
已知:代表溶液的电导率数值;其他条件相同时,电导率越大,溶液导电性越好。
下列说法不正确的是
A.仅由的数据不能说明三种电解质的强弱
B.表中数据不能说明同等条件下与的导电能力强弱
C.比值数据能说明存在电离平衡
D.溶液的数据能说明溶液越稀,的电离程度越大
考向2 考查影响电离平衡的因素
例2.(2023·全国·高三专题练习)在0.1 ml·L-1的CH3COOH溶液中存在如下电离平衡:CH3COOHCH3COO-+H+。对于该平衡,下列叙述正确的是
A.加入少量NaOH固体,平衡向正反应方向移动
B.加水,平衡向逆反应方向移动
C.滴加少量0.1 ml·L-1HCl溶液,溶液中c(H+)减少
D.加入少量CH3COONa固体,平衡向正反应方向移动
【变式训练】(2023·浙江·校联考二模)甘氨酸在水溶液中主要以I、Ⅱ、Ⅲ三种微粒形式存在,且存在以下的电离平衡:
已知:常温下甘氨酸,,当氨基酸主要以两性离子存在时溶解度最小。下列说法不正确的是
A.甘氨酸晶体易溶于水,而难溶于乙醇、乙醚、苯等溶剂
B.甘氨酸钠溶液中存在:
C.pH=2的甘氨酸盐酸盐溶液中:
D.向饱和甘氨酸钠溶液中滴加盐酸至pH=6,可能会析出固体
考点二 电离度、电离平衡常数
知识点1 电离度
1.概念
在一定条件下的弱电解质达到电离平衡时,已经电离的电解质分子数占原电解质总数的百分比。
2.表示方法
α=eq \f(已电离的弱电解质分子数,溶液中原有弱电解质的总分子数)×100%,也可表示为α=eq \f(弱电解质的某离子浓度,弱电解质的浓度)×100%。
3.意义:衡量弱电解质的电离程度,在相同条件下(浓度、温度相同),不同弱电解质的电离度越大,弱电解质的电离程度越大。
4.影响因素
(1)内因:弱电解质本身的性质。
(2)外因:
①相同温度下,同一弱电解质,浓度越大,其电离度(α)越小。
②相同浓度下,同一弱电解质,温度越高,其电离度(α)越大。
知识点2 电离常数
1.概念:在一定条件下,当弱电解质的电离达到平衡时,溶液里各组分的浓度之间存在一定的关系。对一元弱酸或一元弱碱来说,溶液中弱电解质电离所生成的各种离子浓度的乘积,与溶液中未电离分子的浓度之比是一个常数,这个常数叫做电离平衡常数,简称电离常数。用K(弱酸用Ka,弱碱用Kb)表示。
2.常见弱电解质的电离常数(25 ℃,人教版教材):
3.特点
①电离常数与温度有关,与浓度无关。升高温度,K值增大。
②电离常数反映弱电解质电离程度的相对强弱,K越大,表示弱电解质越易电离,酸性或碱性越强。
③多元弱酸的各级电离常数的大小关系是K1≫K2≫K3……,故其酸性取决于第一步电离。
4.影响因素
①内因:弱电解质本身的性质。
②外因:温度越高,K值越大。
5.电离常数的应用
①判断弱酸(或弱碱)的相对强弱,电离常数越大,酸性(或碱性)越强。
②判断盐溶液的酸性(或碱性)强弱,电离常数越大,对应的盐水解程度越小,酸性(或碱性)越弱。
③判断复分解反应能否发生,一般符合“强酸制弱酸”规律。
④计算弱酸、弱碱溶液中的c(H+)、c(OH-)。稀溶液中、弱酸溶液中,c(H+)=eq \r(c·Ka),弱碱溶液中c(OH-)=eq \r(c·Kb)。
6.电离度和电离常数的关系α≈eq \r(\f(K,c))或K≈cα2。
知识点3 强酸(碱)与弱酸(碱)的比较
1.一元强酸(HCl)与一元弱酸(CH3COOH)的比较
(1)相同物质的量浓度、相同体积的盐酸与醋酸溶液的比较
(2)相同pH、相同体积的盐酸与醋酸溶液的比较
2.一元强酸(HCl)与一元弱酸(CH3COOH)稀释图像比较
(1)相同体积、相同浓度的盐酸、醋酸
(2)相同体积、相同pH值的盐酸、醋酸
3.判断HA为一元弱酸的常用方法
(1)常温下,测量NaA溶液的pH,若pH>7,则证明HA为一元弱酸。
(2)取10-aml/L的HA溶液,测其pH>a,证明HA为弱酸。
(3)测NaA的溶液中各离子的浓度若c(Na+)>c(A-),证明HA为弱酸。
(4)取aml/LHA溶液与aml/LnaOH溶液等体积混合,测其pH>7(常温),证明HA为弱酸。
(5)若已知两相同pH同体积的两瓶酸液,加等体积的进行稀释,测其pH,pH变化小的为更弱的酸。
(6)若已知两相同pH同体积的两瓶酸液,加水稀释到相同的pH,加水多的为更弱的酸。
(7)若已知pH=a的HA某酸溶液和pH=a的另一某HB酸溶液,在HA溶液中加少量固体NaA,在HB溶液中加少量固体NaB,若HA中pH不变,则HA为强酸,而HB中pH变化大,则HB为弱酸。
知识点4 自偶电离
1.定义:液态状况下溶剂分子在溶剂中自发发生的电离称为自偶电离。
2.条件:只要是液态极性共价分子化合物就可发生自偶电离,在部分酸的浓水溶液(如浓硝酸)也可发生类似反应。分子的极性越强则自偶电离的程度越大。
3.实例
(1)极性共价化合物的自偶电离
HNO3+HNO3H2NO3++NO3-
BrF3+BrF3BrF4⁻+ BrF2⁺
NH3+NH3NH4++NH2-
CH3CH2OH+CH3CH2OHCH3CH2OH2++CH3CH2O-
H2O+H2OH3O++OH-
SOCl2SOCl++Cl⁻
N2O4NO++NO3-
3HFH2F++HF2-
2SO2SO2++SO32-
3HClH2Cl++HCl2-
(2)非极性共价分子在液态时也偶有自偶电离
例如:2PCl5PCl6- + PCl4+ 、PBr5PBr4++ Br_
考向1 考查电离常数的应用
例1.(2023·海南省直辖县级单位·校联考二模)已知25℃时,部分弱酸的电离平衡常数如表:
下列反应能发生的是
A.
B.
C.
D.
【变式训练】(2023秋·天津河北·高三天津外国语大学附属外国语学校校考期末)已知25℃时,几种常见弱电解质的电离平衡常数如下表所示:
下列说法正确的是
A.溶液呈碱性
B.25℃时,0.1氨水的
C.足量与反应的离子方程式为:
D.25℃时,将等体积等浓度的苯酚溶液与氨水混合,混合溶液中各离子浓度关系:
考向2 考查电离常数的计算
例2.(2023·广西南宁·南宁二中校考模拟预测)常温下,用0.2 ml·L-1NaOH溶液滴定20.00mL一定浓度的一元酸HR溶液时,混合溶液的pH变化情况如图所示,图中a点为滴定终点。下列有关说法正确的是
A.图中x=7
B.常温下,HR的电离常数Ka=5.0×10-5
C.a点溶液中: c(R-)+ c(OH-)- c(H+)=0.1 ml·L-1
D.b点溶液中: c(Na+)> c(R-)> c(OH-)> c(H+)
【变式训练】(2023·浙江金华·统考模拟预测)常温下,可溶性一元弱碱ROH的。在某体系中,与离子不能穿过隔膜,未电离的ROH可自由穿过该膜(如图所示)。当达到平衡时,下列叙述不正确的是
A.溶液Ⅰ和Ⅱ中的相等
B.溶液Ⅰ中
C.溶液Ⅱ中的ROH的电离度约为1/101
D.增大溶液Ⅰ的pH必然使溶液Ⅱ中的pH也增大
1.(2023·海南·统考高考真题)25℃下,水溶液的pH随其浓度的变化关系如图所示。下列说法正确的是
A.时,溶液中
B.水解程度随其浓度增大而减小
C.在水中的
D.的溶液和的溶液等体积混合,得到的溶液
2.(2023·浙江·统考高考真题)氯化铁是一种重要的盐,下列说法不正确的是
A.氯化铁属于弱电解质B.氯化铁溶液可腐蚀覆铜板
C.氯化铁可由铁与氯气反应制得D.氯化铁溶液可制备氢氧化铁胶体
3.(2022·福建·统考高考真题)探究醋酸浓度与电离度关系的步骤如下,与相关步骤对应的操作或叙述正确的
4.(2023·浙江·高考真题)甲酸是重要的化工原料。工业废水中的甲酸及其盐,通过离子交换树脂(含固体活性成分,R为烷基)因静电作用被吸附回收,其回收率(被吸附在树脂上甲酸根的物质的量分数)与废水初始关系如图(已知甲酸),下列说法不正确的是
A.活性成分在水中存在平衡:
B.的废水中
C.废水初始,随下降,甲酸的电离被抑制,与作用的数目减少
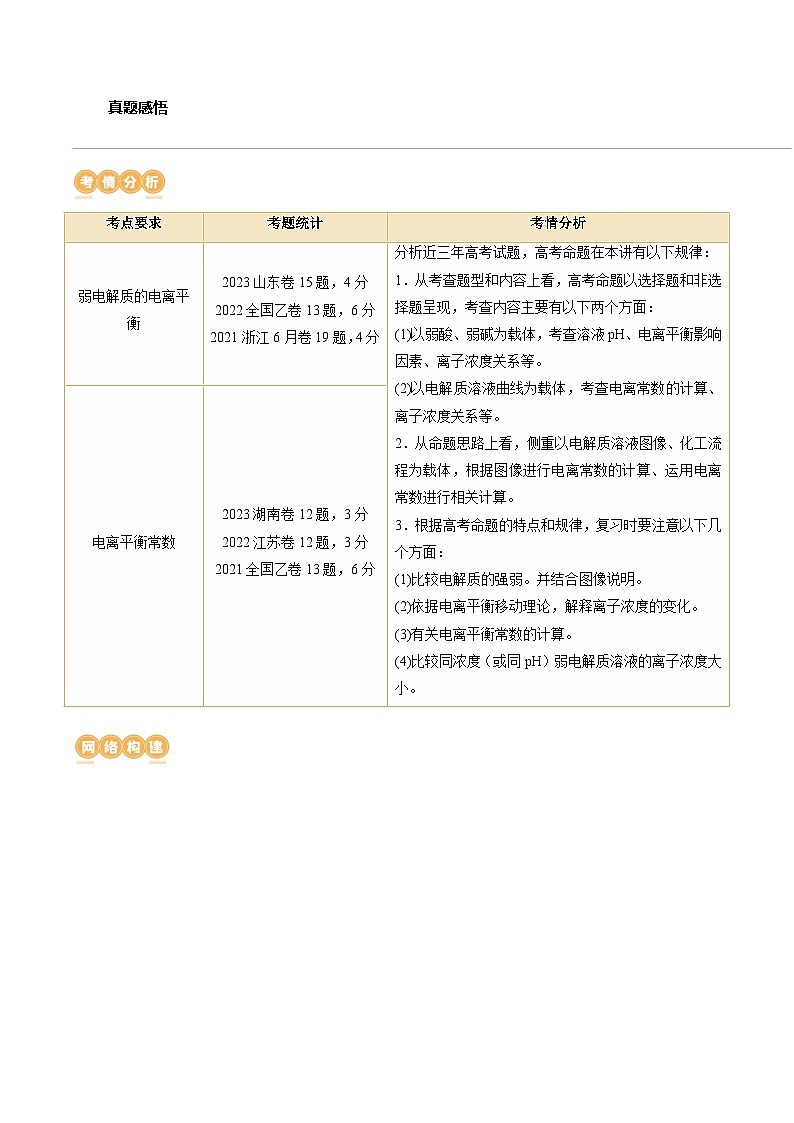
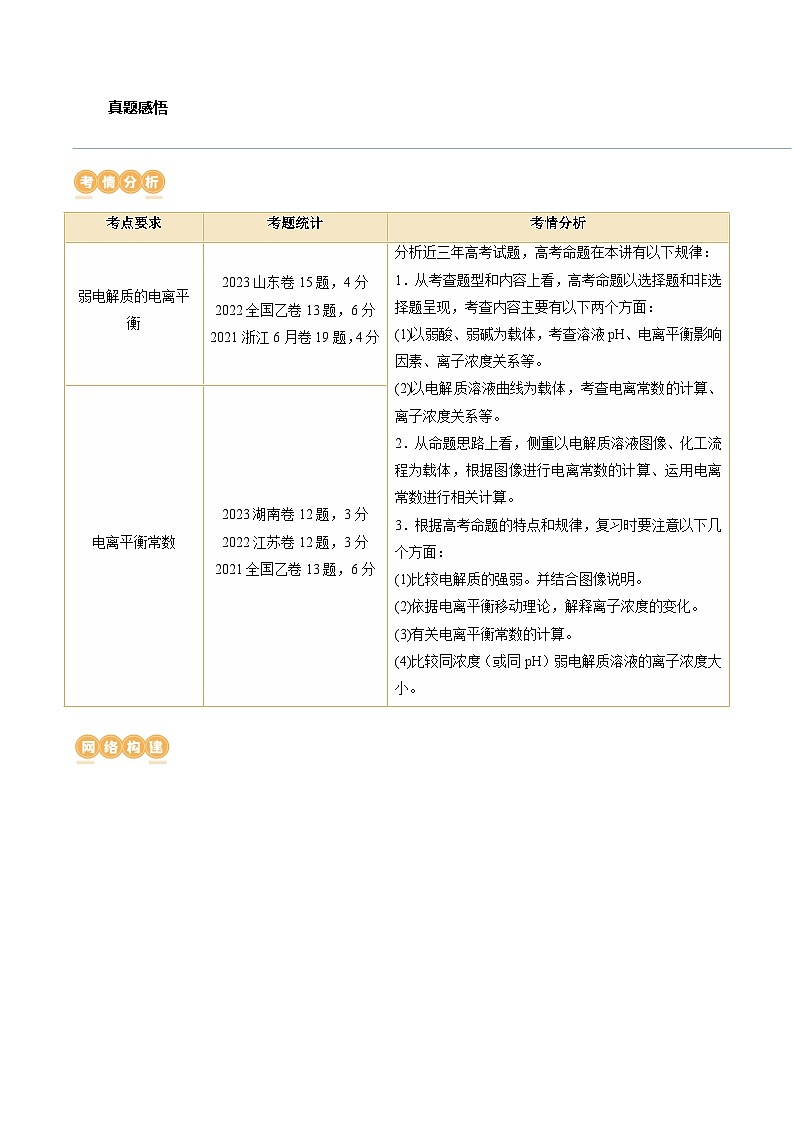
D.废水初始,离子交换树脂活性成分主要以形态存在考点要求
考题统计
考情分析
弱电解质的电离平衡
2023山东卷15题,4分
2022全国乙卷13题,6分
2021浙江6月卷19题,4分
分析近三年高考试题,高考命题在本讲有以下规律:
1.从考查题型和内容上看,高考命题以选择题和非选择题呈现,考查内容主要有以下两个方面:
(1)以弱酸、弱碱为载体,考查溶液pH、电离平衡影响因素、离子浓度关系等。
(2)以电解质溶液曲线为载体,考查电离常数的计算、离子浓度关系等。
2.从命题思路上看,侧重以电解质溶液图像、化工流程为载体,根据图像进行电离常数的计算、运用电离常数进行相关计算。
3.根据高考命题的特点和规律,复习时要注意以下几个方面:
(1)比较电解质的强弱。并结合图像说明。
(2)依据电离平衡移动理论,解释离子浓度的变化。
(3)有关电离平衡常数的计算。
(4)比较同浓度(或同pH)弱电解质溶液的离子浓度大小。
电离平衡常数
2023湖南卷12题,3分
2022江苏卷12题,3分
2021全国乙卷13题,6分
改变条件
平衡移动方向
n(H+)
c(H+)
导电能力
Ka
加水稀释
向右
增大
减小
减弱
不变
加入少量冰醋酸
向右
增大
增大
增强
不变
通入HCl(g)
向左
增大
增大
增强
不变
加NaOH(s)
向右
减小
减小
增强
不变
加CH3COONa(s)
向左
减小
减小
增强
不变
加入镁粉
向右
减小
减小
增强
不变
升高温度
向右
增大
增大
增强
增大
溶液
溶液
4839
2478
1252
51.2%
50.5%
溶液
10958
5593
2797
51.0%
50.0%
溶液
267
182
126
68.2%
69.2%
比较项目
酸
c(H+)
pH
中和碱的能力
与活泼金属反应产生H2的量
开始与金属反应的速率
盐酸
大
小
相同
相同
大
醋酸溶液
小
大
小
比较项目
酸
c(H+)
c(酸)
中和碱的能力
与足量活泼金属反应产生H2的量
开始与金属反应的速率
盐酸
相同
小
小
少
相同
醋酸溶液
大
大
多
加水稀释相同的倍数,醋酸的pH大
加水稀释到相同的pH,盐酸加入的水多
加水稀释相同的倍数,盐酸的pH大
加水稀释到相同的pH,醋酸加入的水多
化学式
HClO
电离平衡常数
电解质
苯酚()
电离平衡常数
步骤
操作或叙述
A
Ⅰ.用标准溶液标定醋酸溶液浓度
滴定时应始终注视滴定管中的液面
B
Ⅱ.用标定后的溶液配制不同浓度的醋酸溶液
应使用干燥的容量瓶
C
Ⅲ.测定步骤Ⅱ中所得溶液的
应在相同温度下测定
D
Ⅳ.计算不同浓度溶液中醋酸的电离度
计算式为
最新高考化学一轮复习【讲通练透】 第26讲 化学平衡常数及转化率 反应方向及调控(讲通): 这是一份最新高考化学一轮复习【讲通练透】 第26讲 化学平衡常数及转化率 反应方向及调控(讲通),文件包含第26讲化学平衡常数及转化率反应方向及调控讲通教师版docx、第26讲化学平衡常数及转化率反应方向及调控讲通学生版docx等2份试卷配套教学资源,其中试卷共35页, 欢迎下载使用。
最新高考化学一轮复习【讲通练透】 第25讲 化学反应平衡(讲通): 这是一份最新高考化学一轮复习【讲通练透】 第25讲 化学反应平衡(讲通),文件包含第25讲化学反应平衡讲通教师版docx、第25讲化学反应平衡讲通学生版docx等2份试卷配套教学资源,其中试卷共35页, 欢迎下载使用。
最新高考化学一轮复习【讲通练透】 第24讲 化学反应速率(讲通): 这是一份最新高考化学一轮复习【讲通练透】 第24讲 化学反应速率(讲通),文件包含第24讲化学反应速率讲通教师版docx、第24讲化学反应速率讲通学生版docx等2份试卷配套教学资源,其中试卷共47页, 欢迎下载使用。












