



最新高考化学一轮复习【讲通练透】 第25讲 化学反应平衡(练透)
展开考纲和考试说明是备考的指南针,认真研究考纲和考试说明,可增强日常复习的针对性和方向性,避免盲目备考,按方抓药,弄清楚高考检测什么,检测的价值取向,高考的命题依据。
2.精练高考真题,明确方向
经过对近几年高考题的横、纵向分析,可以得出以下三点:一是主干知识考查“集中化”,二是基础知识新视角,推陈出新,三是能力考查“综合化”。
3.摸清问题所在,对症下药
要提高后期的备考质量,还要真正了解学生存在的问题,只有如此,复习备考才能更加科学有效。所以,必须加大信息反馈,深入总结学情,明确备考方向,对症开方下药,才能使学生的知识结构更加符合高考立体网络化要求,才能实现基础→能力→分数的转化。
4.切实回归基础,提高能力
复习训练的步骤包括强化基础,突破难点,规范作答,总结方法,通过这样的总结,学生印象深刻,应用更加灵活。
第25讲 化学反应平衡
(模拟精练+真题演练)
完卷时间:50分钟
一、选择题(每小题只有一个正确选项,共12×5分)
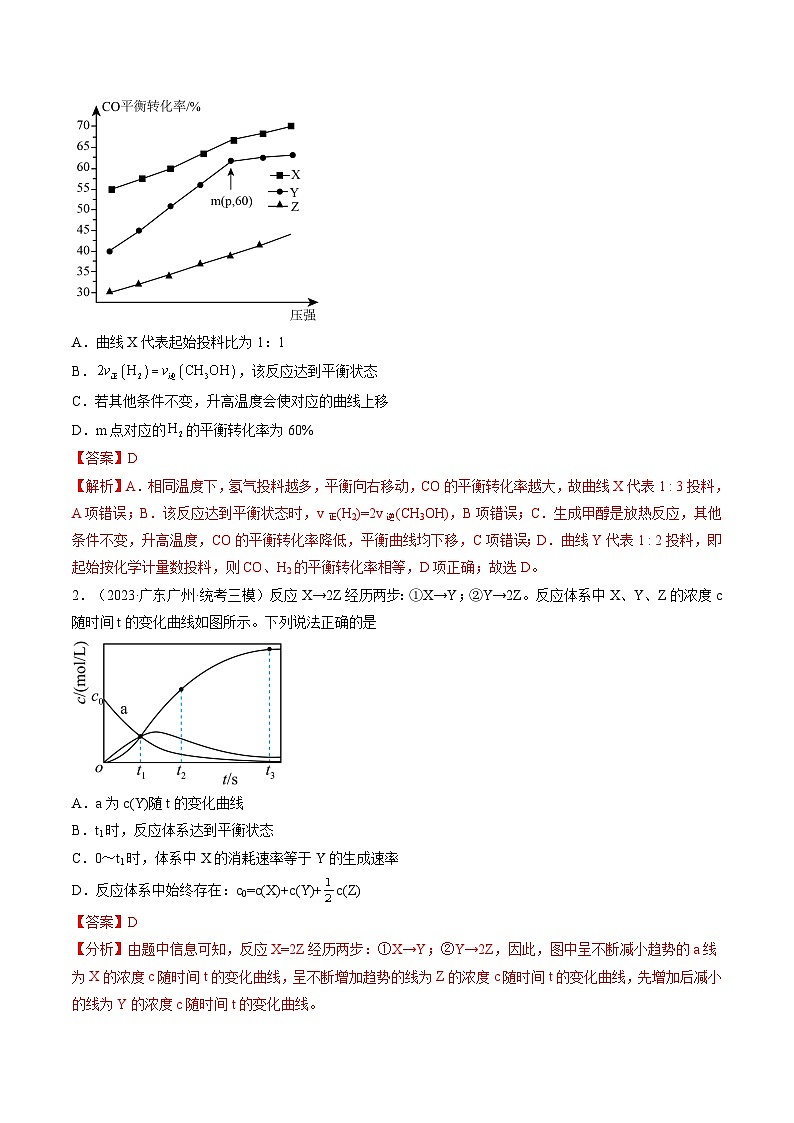
1.(2023·辽宁·校联考模拟预测)在600K下,按初始投料比分别为1:1、1:2、1:3投料,发生反应为。测得不同压强下,CO平衡转化率如图所示。下列叙述正确的是
A.曲线X代表起始投料比为1:1
B.,该反应达到平衡状态
C.若其他条件不变,升高温度会使对应的曲线上移
D.m点对应的的平衡转化率为60%
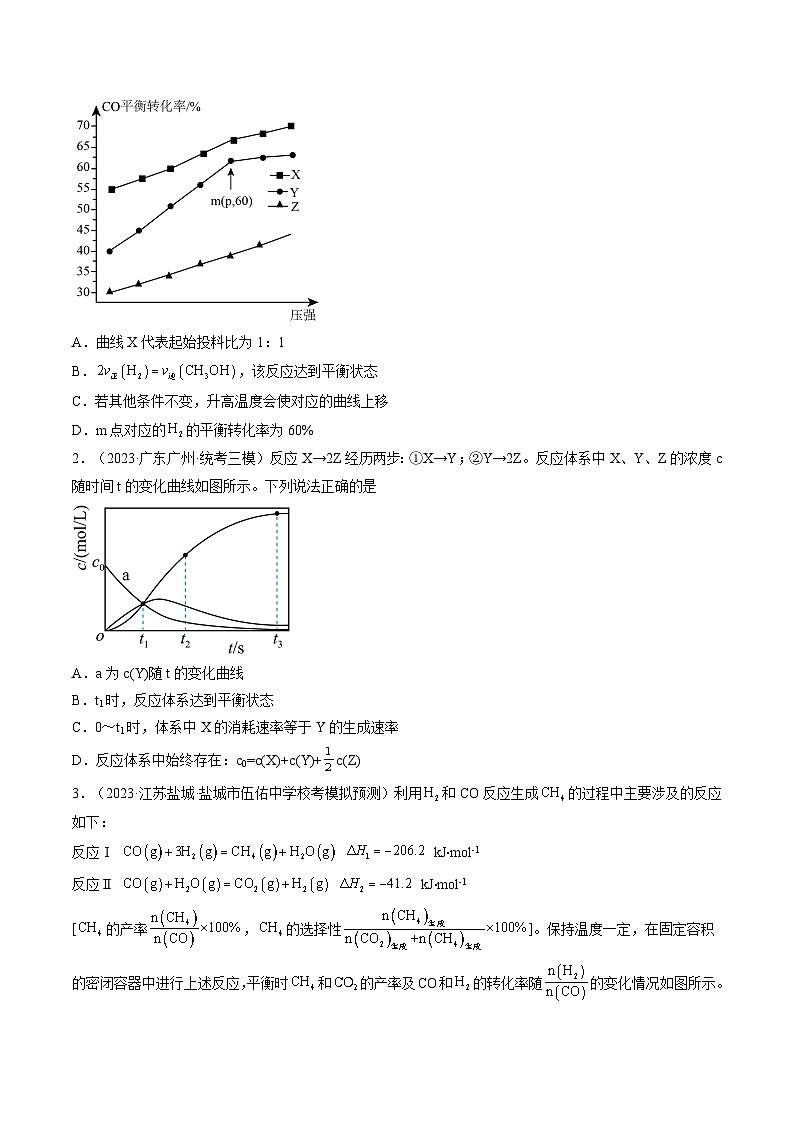
2.(2023·广东广州·统考三模)反应X→2Z经历两步:①X→Y;②Y→2Z。反应体系中X、Y、Z的浓度c随时间t的变化曲线如图所示。下列说法正确的是
A.a为c(Y)随t的变化曲线
B.t1时,反应体系达到平衡状态
C.0~t1时,体系中X的消耗速率等于Y的生成速率
D.反应体系中始终存在:c0=c(X)+c(Y)+c(Z)
3.(2023·江苏盐城·盐城市伍佑中学校考模拟预测)利用和CO反应生成的过程中主要涉及的反应如下:
反应Ⅰ kJ⋅ml-1
反应Ⅱ kJ⋅ml-1
[的产率,的选择性]。保持温度一定,在固定容积的密闭容器中进行上述反应,平衡时和的产率及CO和的转化率随的变化情况如图所示。下列说法不正确的是
A.当容器内气体总压不变时,反应Ⅱ达到平衡状态
B.曲线c表示的产率随的变化
C.,反应达平衡时,的选择性为50%
D.随着增大,的选择性先增大后减小
4.(2023·辽宁沈阳·辽宁实验中学校考模拟预测)中国积极推动技术创新,力争2060年达到碳中和。CO2催化还原的主要反应有:
(Ⅰ)
(Ⅱ)
反应(Ⅰ)和反应(Ⅱ)的、满足题图:
在恒温恒压条件下通入1mlCO2和3mlH2进行反应.下列说法错误的是
A.若反应体系密度不再变化,说明反应(Ⅰ)和(Ⅱ)都达到了平衡状态
B.使用催化剂可能在反应体系未达平衡前使甲醇产率提高
C.反应Ⅱ在高温条件下易自发进行
D.升高温度,CO2的转化率可能下降
5.(2023·江苏盐城·盐城市伍佑中学校考模拟预测)卤族元素单质及其化合物应用广泛。具有与卤素单质相似的化学性质。在常温下能与Cu反应生成致密的氟化物薄膜,还能与熔融的反应生成硫酰氟()。与浓硫酸反应可制得HF,常温下,测得氟化氢的相对分子质量约为37.通入酸性溶液中可制得黄绿色气体,该气体常用作自来水消毒剂。工业用制备的热化学方程式为 。下列关于反应的说法不正确的是
A.保持其他条件不变,平衡时升高温度,
B.保持其他条件不变,平衡时通入,达到新平衡时变小
C.反应生成1ml,转移电子数目为
D.及时分离出CO,有利于生成
6.(2023·重庆渝中·重庆巴蜀中学校考模拟预测)1,2-二甲基环丙烷的顺反异构体可相互转化:(顺式)(反式) ,该反应的速率方程为:(顺)和(反),和分别为正、逆反应速率常数。℃时,加入顺式异构体发生反应,两种异构体的质量分数w随时间t的变化如图所示。下列说法正确的是
A.反应速率:(正)(逆)
B.L点:转化率为50%,Q(浓度商)>K
C.升高温度,、增大倍数:
D.℃时发生反应,测得,则
7.(2023·海南省直辖县级单位·嘉积中学校考模拟预测)在一定温度下,和C在一密闭容器中进行反应:,CO的平衡浓度(ml/L)的对数与温度的倒数的关系如图所示,下列说法中正确的是
A.Q点CO的消耗速率大于其生成速率
B.该反应的
C.温度是时,反应的平衡常数为1
D.温度不变,将R点状态的容器体积扩大,重新达到平衡时,气体的压强减小
8.(2023·河北衡水·河北武邑中学校考模拟预测)已知阿仑尼乌斯公式是反应速率常数随温度变化关系的经验公式,可写作(k为反应速率常数,为反应活化能,R和C为大于0的常数),为探究m、n两种催化剂对某反应的催化效能,进行了实验探究,依据实验数据获得曲线如图所示。下列说法错误的是
A.在m催化剂作用下,该反应的活化能
B.对该反应催化效能较高的催化剂是m
C.不改变其他条件,只升高温度,k值增大
D.无法根据该图像判断升高温度时平衡移动的方向
9.(2023·辽宁·朝阳市第一高级中学校联考一模)氨气去除NO的反应原理为: ,反应速率与浓度之间存在如下关系:,,、为速率常数,只受温度影响。350℃时,在2L恒容密闭容器中,通入和发生反应,保持温度不变,5min后反应达平衡,NO的转化率为50%。下列说法正确的是
A.用表示的化学反应速率为
B.350℃时,该反应的平衡常数为0.5
C.其他条件不变,往反应后的容器中再通入和,重新达平衡时NO的体积分数减小
D.当温度改变为T℃时,若,则
10.(2023·上海·模拟预测)一定温度下,向1L密闭容器中充入2mlX和1mlY,发生反应2X(g)+Y(g)⇌3Z(?)。达到平衡时,容器的压强从原来的P0变为0.4P0。下列说法错误的是
A.Z不可能为气体
B.达到平衡时容器内有1.8mlZ
C.压缩体积,再次达到平衡,X的浓度不变
D.Y的体积分数不变说明反应达到平衡状态
11.(2023·重庆·校联考模拟预测)一定温度下,在三个容积均为2.0L的恒容密闭容器中仅发生反应:CH3COOH(g)CH3OH(g)+CO(g) ΔH>0。下列说法正确的是
A.达平衡时,容器I与容器II中的总压强之比为6∶7
B.达平衡时,容器II中比容器I中的大
C.达平衡时,容器III与容器I中的正反应速率相等
D.达平衡时,容器I中CH3OH转化率与容器III中CH3COOH转化率之和大于1
12.(2023·重庆沙坪坝·重庆一中校考模拟预测)在催化剂的作用下,氢气还原的过程中可同时发生反应①②。
①
②
在恒温恒容密闭容器中,充入一定量的及,起始及达到平衡时,容器内各气体的物质的量及总压的部分数据如下表所示。
下列说法正确的是
A.反应①任意温度下均能自发进行
B.恒温恒容下,再充入和,反应①平衡右移,反应②平衡不移动
C.
D.反应②的平衡常数
二、主观题(共3小题,共40分)
13.(14分)(2023·上海·模拟预测)Ⅰ.H2S与CH4重整,不但可以消除污染,还可以制氢。主要反应如下:①CH4(g)+2H2S(g) CS2(g)+4H2(g)+Q(Q<0)
(1)在恒温恒容条件下,可作为反应①达到平衡状态的判断依据是___________(选填编号)。
A.混合气体密度不变B.容器内压强不变
C.2v正(H2S)=v逆(CS2)D.CH4与H2的物质的量分数之比保持不变
Ⅱ.在恒压条件下,以n(CH4)∶n(H2S)=1∶2的组成的混合气体发生反应①,达到平衡状态时,四种组分物质的量分数随温度的变化如图所示。
(2)如图中表示CH4、CS2变化的曲线分别是 、 (选填编号)。
(3)M点对应温度下,H2S的转化率是 。
Ⅲ.在研究反应发生的适宜条件时发现:过多的CH4会导致Al2O3催化剂失活;C助剂有稳定催化剂的作用。如图表示800℃,Al2O3催化剂条件下投入等量H2S,投料比[n(CH4)∶n(H2S)]分别为1∶1、1∶3、12∶1,达平衡时H2S转化率、平均反应速率。
(4)投料比n(CH4)∶n(H2S)=1∶1为对应图中 组图像(选填“A”“B”或“C”);在三组图像中,C组图像中平均反应速率最低的可能原因是 。
(5)未添加C助剂时,无积碳,随着C添加量的变化,积碳量变化如图所示,C助剂可能催化原料气发生反应的化学方程式为 。
14.(12分)(2023·上海静安·统考二模)聚丙烯腈纤维俗名人造羊毛,由丙烯腈聚合而得。用丙烯合成丙烯腈的反应如下: 2C3H6(g)+2NH3(g)+3O2(g) 2C3H3N(g)+6H2O(g)+1030kJ
(1)某密闭容器中发生上述反应,生成丙烯腈的反应速率与反应时间的关系如下图所示。
t1时刻表示体系改变的反应条件为 ; t2时刻表示体系改变了另一反应条件,此时平衡 移动(填“正向”、“逆向”或“不”)。
丙烯的转化率与反应温度的关系如图示:
(2)有利于提高丙烯平衡转化率的反应条件有 ;
(3)最大转化率所对应的温度为460℃。当温度低于460℃时,丙烯的转化率 (填“是”或“不是”)所对应温度下的平衡转化率,理由是 。
(4)一定条件下,在2L恒容密闭容器中,通入84g C3H6、34g NH3、96g O2,若该反应5 min到达a点,则0~5min内丙烯的平均反应速率为 ml∙L−1∙min−1。
15.(14分)(2023·上海黄浦·统考二模)NOx的排放主要来自于汽车尾气,包含NO2和NO。若用活性炭对NO进行吸附,可发生C(s)+2NO(g)N2(g)+CO2(g),在T1℃时,借助传感器测得反应在不同时间点上各物质的浓度如表:
(1)关于该反应说法错误的是 。
a.该反应体现了NO的氧化性
b.降低NO浓度能够减慢反应速率
c.加入足量的炭粉可以使NO100%转化
d.合适的催化剂可以加快反应速率
(2)表中0~10min内,NO的平均反应速率v(NO)= ;当升高反应温度,该反应的平衡常数K减小,说明正反应为 反应(填“吸热”或“放热”).
(3)30min后,只改变某一条件,反应重新达到平衡;根据表中的数据判断改变的条件可能是 (填字母)。
a.加入一定量的活性炭 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
某实验室模拟该反应,在恒压密闭容器中加入足量的活性炭和一定量的NO气体,测得NO的转化率随温度的变化如图所示:
(4)由图可知,1050K前反应中NO的转化率随温度升高而增大,原因是 ;在1100K时,CO2的体积分数为 。
(5)NO2排放到大气中会引起 (填两个)等环境问题。
1.(2022·天津·统考高考真题)向恒温恒容密闭容器中通入2ml 和1ml ,反应达到平衡后,再通入一定量,达到新平衡时,下列有关判断错误的是
A.的平衡浓度增大B.反应平衡常数增大
C.正向反应速率增大D.的转化总量增大
2.(2022·北京·高考真题)某多孔材料孔径大小和形状恰好将“固定”,能高选择性吸附。废气中的被吸附后,经处理能全部转化为。原理示意图如下。
已知:
下列说法不正确的是
A.温度升高时不利于吸附
B.多孔材料“固定”,促进平衡正向移动
C.转化为的反应是
D.每获得时,转移电子的数目为
3.(2022·辽宁·统考高考真题)某温度下,在恒容密闭容器中发生反应,有关数据如下:
下列说法错误的是
A.时,Z的浓度大于
B.时,加入,此时
C.时,Y的体积分数约为33.3%
D.时,X的物质的量为
4.(2022·海南·统考高考真题)某温度下,反应CH2=CH2(g)+H2O(g)CH3CH2OH(g)在密闭容器中达到平衡,下列说法正确的是
A.增大压强,,平衡常数增大
B.加入催化剂,平衡时的浓度增大
C.恒容下,充入一定量的,平衡向正反应方向移动
D.恒容下,充入一定量的,的平衡转化率增大
5.(2022·浙江·统考高考真题)恒温恒容的密闭容器中,在某催化剂表面上发生氨的分解反应:,测得不同起始浓度和催化剂表面积下氨浓度随时间的变化,如下表所示,下列说法不正确的是
A.实验①,,
B.实验②,时处于平衡状态,
C.相同条件下,增加氨气的浓度,反应速率增大
D.相同条件下,增加催化剂的表面积,反应速率增大
6.(2023·山东·统考高考真题)一定条件下,化合物E和TFAA合成H的反应路径如下:
已知反应初始E的浓度为0.10ml∙L-1,TFAA的浓度为0.08ml∙L-1,部分物种的浓度随时间的变化关系如图所示,忽略反应过程中的体积变化。下列说法正确的是
A.t1时刻,体系中有E存在
B.t2时刻,体系中无F存在
C.E和TFAA反应生成F的活化能很小
D.反应达平衡后,TFAA的浓度为0.08ml∙L-1容器编号
温度/K
物质的起始浓度/ml·L-1
物质的平衡浓度/ml·L-1
c(CH3OH)
c(CO)
c(CH3COOH)
c(CH3COOH)
I
230
0.60
0.60
0
0.40
II
230
0.30
0.30
0.40
III
210
0
0
0.60
总压
起始
0.5
0.9
0
0
0
1.4p
平衡
m
0.3
p
浓度(ml•L-1)
时间(min)
0
10
20
30
40
50
NO
1.00
0.58
0.40
0.40
0.48
0.48
N2
0
0.21
0.30
0.30
0.36
0.36
时间段/
产物Z的平均生成速率/
0~2
0.20
0~4
0.15
0~6
0.10
最新高考化学一轮复习【讲通练透】 第28讲 电离平衡(练透): 这是一份最新高考化学一轮复习【讲通练透】 第28讲 电离平衡(练透),文件包含第28讲电离平衡练透教师版docx、第28讲电离平衡练透学生版docx等2份试卷配套教学资源,其中试卷共23页, 欢迎下载使用。
最新高考化学一轮复习【讲通练透】 第28讲 电离平衡(讲通): 这是一份最新高考化学一轮复习【讲通练透】 第28讲 电离平衡(讲通),文件包含第28讲电离平衡讲通教师版docx、第28讲电离平衡讲通学生版docx等2份试卷配套教学资源,其中试卷共30页, 欢迎下载使用。
最新高考化学一轮复习【讲通练透】 第27讲 化学反应速率、平衡图像(练透): 这是一份最新高考化学一轮复习【讲通练透】 第27讲 化学反应速率、平衡图像(练透),文件包含第27讲化学反应速率平衡图像练透教师版docx、第27讲化学反应速率平衡图像练透学生版docx等2份试卷配套教学资源,其中试卷共37页, 欢迎下载使用。












