

高中化学人教版 (2019)选择性必修1第二节 电解池精品一课一练
展开『知识梳理』
一、电解原理
〖电解池〗
◆定义:将电能转化为 的装置,也称 。
◆构成条件
①与电源相连的两个 。
②电解质溶液或 电解质。
③形成 。
◆电解:使电流通过电解质溶液(或熔融电解质)而在阳极、阴极引起 反应的过程。
〖电解原理〗
〖电解时电极名称的判断〗
〖原电池与电解池的比较〗
二、电解原理的应用
〖电解饱和食盐水〗
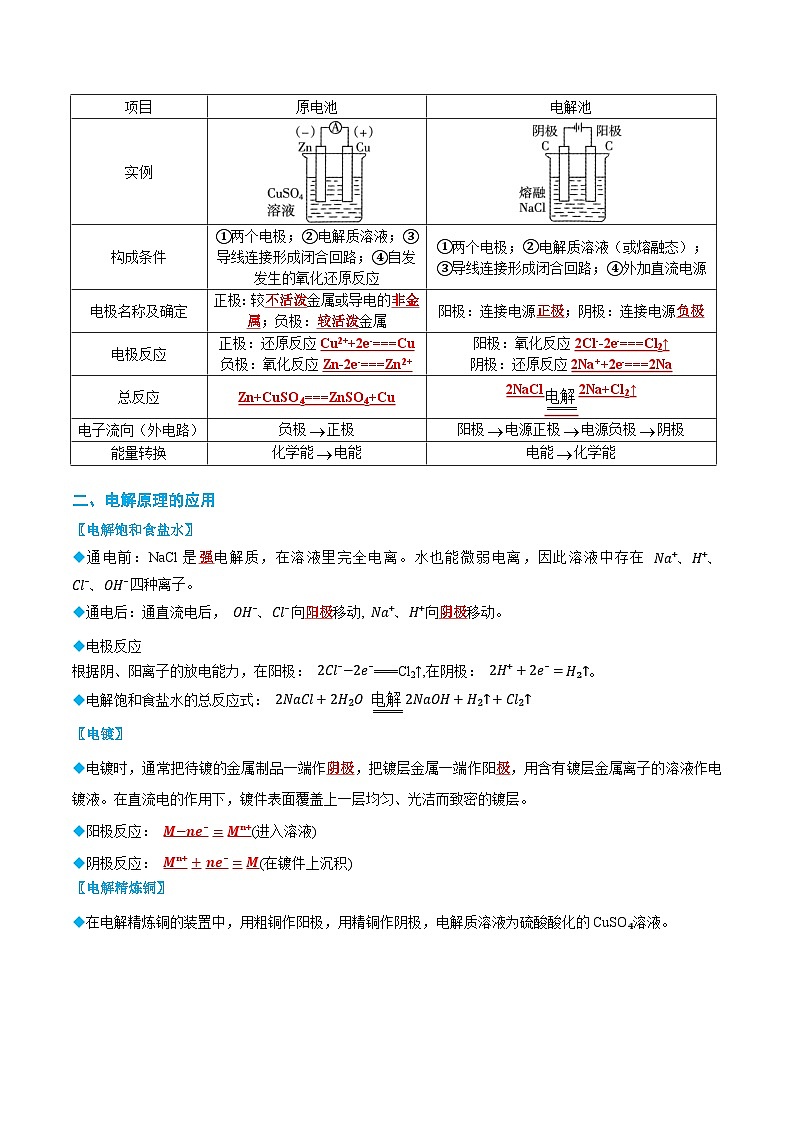
◆通电前:NaCl是 电解质,在溶液里完全电离。水也能微弱电离,因此溶液中存在 Na⁺、H⁺、 Cl⁻、OH⁻四种离子。
◆通电后:通直流电后, OH⁻、Cl⁻向 移动, Na⁺、H⁺向 移动。
◆电极反应
根据阴、阳离子的放电能力,在阳极: 2Cl⁻−2e⁻===Cl2↑,在阴极: 2H⁺+2e⁻=H₂↑。
◆电解饱和食盐水的总反应式: 2NaCl+2H2O 2NaOH+H2↑+Cl2↑
〖电镀〗
◆电镀时,通常把待镀的金属制品一端作 ,把镀层金属一端作阳 ,用含有镀层金属离子的溶液作电镀液。在直流电的作用下,镀件表面覆盖上一层均匀、光洁而致密的镀层。
◆阳极反应: (进入溶液)
◆阴极反应: (在镀件上沉积)
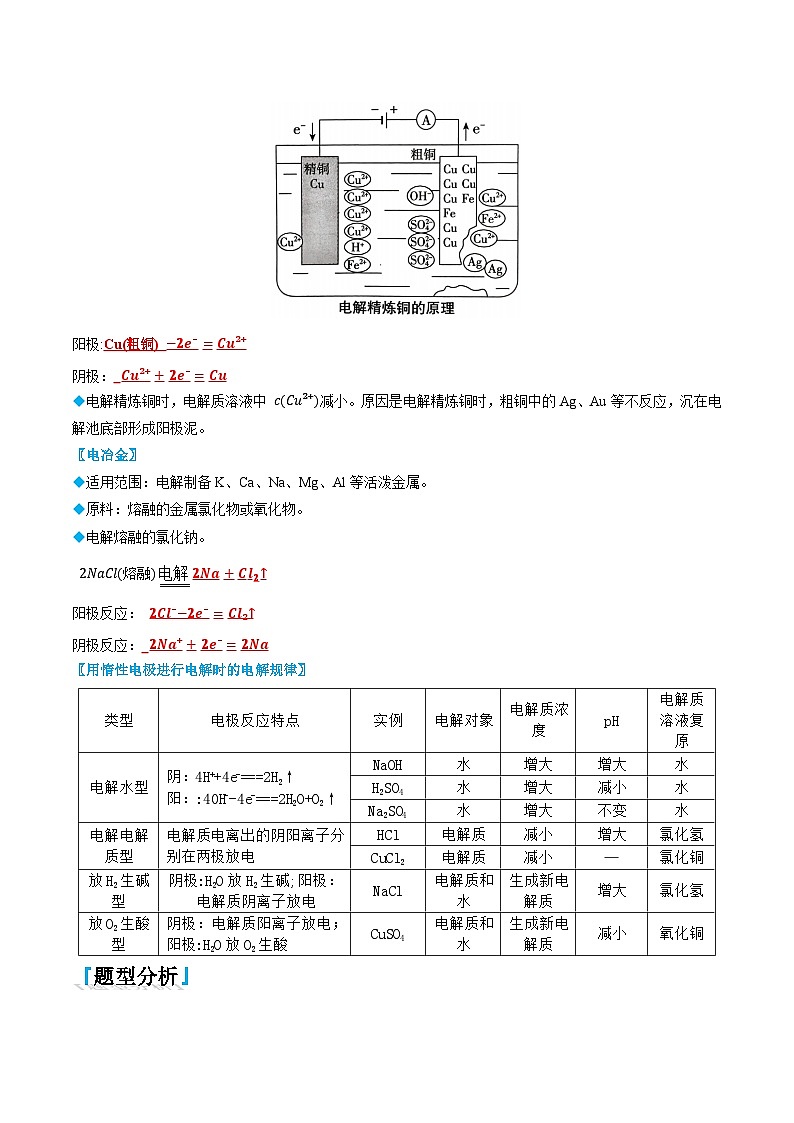
〖电解精炼铜〗
◆在电解精炼铜的装置中,用粗铜作阳极,用精铜作阴极,电解质溶液为硫酸酸化的CuSO₄溶液。
阳极:
阴极: ◆电解精炼铜时,电解质溶液中 cCu²⁺减小。原因是电解精炼铜时,粗铜中的Ag、Au等不反应,沉在电解池底部形成阳极泥。
〖电冶金〗
◆适用范围:电解制备K、Ca、Na、Mg、Al等活泼金属。
◆原料:熔融的金属氯化物或氧化物。
◆电解熔融的氯化钠。
2NaCl熔融
阳极反应:
阴极反应: 〖用惰性电极进行电解时的电解规律〗
『题型分析』
『题型一』电解池概念及组成
〖典例1〗下列装置或过程能实现电能转化为化学能的是( )
A.AB.BC.CD.D
【答案】C
【详解】A.火力发电将化学能转化为内能,再由内能转化为动能,由动能转化为电能,故A不符合题意;B.碱性锌锰电池将化学能转化为电能,故B不符合题意;C.电解饱和食盐水为电解池装置,将电能转化为化学能,故C符合题意;D.氢氧燃料电池将化学能转化为电能,故D不符合题意;故选C。
〖变式1-1〗中国科学家最近开发了种从空气中提取水制取H2的新技术,即利用太阳能风能等绿色能源驱动电解槽装置吸收空气中的水分并将获得的水分解成H2和O2。下列说法正确的是( )
A.该装置工作时仅涉及两种能量转化
B.阳极反应式为2H2O+2e-=2OH-+H2↑
C.该装置获得H2、O2的物质的量之比为2:1
D.该装置工作时阳离子向阳极迁移
〖变式1-2〗下列有关电解的说法错误的是( )
A.与电源正极相连的是阳极B.与电源负极相连的是阴极
C.在阴极上发生氧化反应D.阴离子向阳极方向移动
〖变式1-3〗下列关于原电池和电解池的叙述正确的是( )
A.原电池中失去电子的电极为正极
B.原电池的负极、电解池的阳极都发生氧化反应
C.原电池的两极一定是由活动性不同的两种金属组成的
D.电解时电解池的阳极一定是阴离子放电
『题型二』电解原理
〖典例2〗酸性条件下通过电催化法可生成,c-NC、i-NC是可用于阴极电极的两种电催化剂,其表面发生转化原理如图所示。下列有关说法正确的是( )
A.i-NC电极处发生氧化反应
B.合成过程中均作为还原剂
C.合成过程中用c-NC作电极催化剂更利于生成
D.c-NC电极上发生反应:
【答案】C
【详解】A.i-NC电极上得电子生成CO,发生还原反应,故A错误;B.c-NC电极上转化为,i-NC电极上得电子生成CO和,均发生还原反应,均做氧化剂,故B错误;C.由图示可知,i-NC电极上生成CO和两种产物,c-NC作电极催化剂完全将转化为,由此可知c-NC作电极催化剂利用率更高,更利于生成,故C正确;D.电解质为酸性介质,电极反应为:,故D错误;故选:C。
〖变式2-1〗2022年10月31日,梦天实验舱在我国文昌航天发射场成功发射,中国空间站“T”字基本构型即将在轨组装完成,空间站内能量转化关系如图所示。下列说法正确的是( )
A.太阳能电池的工作原理与氢氧燃料电池工作原理相同
B.水电解系统将电能转化为化学能,该过程中的△H>0
C.燃料电池系统内部H2与O2剧烈燃烧,释放大量的热量
D.水电解系统和燃料电池系统工作时均发生了自发的氧化还原反应
〖变式2-2〗已知甲、乙为单质,丙为化合物。能实现下述转化关系的是( )
甲+乙丙丙溶液甲
A.若溶液丙中滴加NaOH溶液有白色沉淀生成后沉淀溶解,则甲可能为Al
B.若溶液丙遇放出气体,则甲不可能是
C.若溶液丙中滴加邻二氮菲溶液显橙红色,则甲可能为Fe
D.若丙溶于水后得到强碱溶液,则甲可能是
〖变式2-3〗近日,国内某课题组系统地研究了晶态铋氧簇(和)电催化还原为HCOOH的反应机理,其相对能量变化如图:
已知图中*表示微粒在催化剂表面吸附,由此判断下列叙述错误的是( )
A.中间体*OCHO的能量高低与催化剂无关
B.在电还原过程中,HCOOH是阴极产物
C.为催化剂时,还原反应最大活化能为0.52eV
D.以为催化剂时,HCOOH的选择性更高
『题型三』电解饱和食盐水
〖典例3〗在氯碱工业中,离子交换膜法电解饱和食盐水示意图如下,下列说法不正确的是( )
A.电极A为阳极,发生氧化反应生成氯气
B.离子交换膜为阳离子交换膜
C.溶液从d处出
D.电解饱和食盐水的离子方程式为:
【答案】D
【分析】由图可知,A极氯离子失去电子发生氧化反应生成氯气,为阳极,则B为阴极。
【详解】A.由分析可知,电极A为阳极,氯离子失去电子发生氧化反应生成氯气,A正确;B.氯气能和氢氧根离子反应,故钠离子向阴极迁移在右侧得到氢氧化钠,离子交换膜为阳离子交换膜,B正确;C.由B分析可知,溶液从d处出,C正确;D.电解饱和食盐水生成氢气、氯气和氢氧化钠,离子方程式为:,D错误;故选D。
〖变式3-1〗用惰性电极电解饱和食盐水的反应原理为2NaCl+2H2O2NaOH+H2↑+Cl2↑,下列说法错误的是( )
A.阳极反应式为:2Cl--2e-=Cl2↑
B.H2O为还原剂,得到电子
C.电解一段时间后,溶液的pH变大
D.NaOH既不是氧化产物也不是还原产物
〖变式3-2〗在氯碱工业中,离子交换膜法电解饱和食盐水示意图如下。下列说法错误的是( )
A.碳纳米电极为阳极,发生氧化反应生成氯气
B.离子交换膜为阳离子交换膜
C.精制饱和NaCl溶液从b处进,NaOH溶液从c处出
D.迁移过交换膜的数量等于导线上通过电子的数量
〖变式3-3〗在氯碱工业中,离子交换膜法电解饱和食盐水示意图如下。下列说法错误的是( )
A.碳纳米电极为阳极,发生氧化反应生成氯气
B.离子交换膜为阳离子交换膜
C.精制饱和NaCl溶液从b处进,NaOH溶液从c处出
D.迁移过交换膜的数量等于导线上通过电子的数量
『题型四』电镀
〖典例4〗如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色,下列说法错误的个数是( )
①X是负极,Y是正极
②若用右侧装置(电解液改为溶液)在钥匙上镀铜,则将钥匙放在b处
③溶液的酸性先增强,当铜电极有气泡产生时,此后一段时间酸性会继续增强
④若用右侧装置(电解液改为溶液)精炼粗铜时,则将粗铜放在b处
A.1个B.2个C.3个D.4个
【答案】B
【分析】a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色,则b极上水放电得到电子发生还原反应生成氢气和氢氧根离子,b为阴极,与之相连的Y为负极,则a为阳极、X为正极、Pt极为阳极、Cu为阴极。
【详解】①由分析可知,X是正极,Y是负极,错误;②若用右侧装置(电解液改为溶液)在钥匙上镀铜,则镀件钥匙应该作为阴极,故放在b处,正确;③溶液开始电解生成铜单质和氢离子,溶液酸性先增强;当铜电极有气泡产生时,此时本质为电解水,使得生成硫酸浓度变大,此后一段时间酸性会继续增强,正确;④若用右侧装置(电解液改为溶液)精炼粗铜时,则将粗铜放在阳极a处,错误;故选B。
〖变式4-1〗下列实验过程可达到实验目的的是( )
A.AB.BC.CD.D
〖变式4-2〗下列有关实验装置进行的相应实验,能达到实验目的的是( )
A.用图1所示装置在铁上镀铜
B.用图2所示装置除去Cl2中含有的少量HCl
C.用图3所示装置蒸干NH4Cl饱和溶液制备NH4Cl固体
D.用图4所示装置制取少量纯净的CO2气体
〖变式4-3〗下列说法正确的是( )
A.用惰性电极电解氢氧化钠溶液后溶液的pH值会发生下降
B.加热蒸干溶液得到固体
C.酸碱中和滴定时实验时,用待测液润洗锥形瓶以减小实验误差
D.通过电解,在铁上镀铜的过程中,电解质硫酸铜的浓度减少
『题型五』铜的电解精练
〖典例5〗下列说法正确的是( )
A.工业制镁电解熔融MgCl2时,阳极的电极反应为:2Cl--2e-=Cl2↑
B.氢氧燃料电池的负极反应:O2+2H2O+4e-=4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应为:Cu-2e-=Cu2+
D.钢铁发生电化学腐蚀的正极反应:Fe-2e-=Fe2+
【答案】A
【详解】A.工业制镁电解熔融MgCl2时,阳极是氯离子失去电子变为氯气,其电极反应为:2Cl--2e-=Cl2↑,故A正确;B.氢氧燃料电池,不清楚是酸性还是碱性电池,因此无法写出具体的电极反应式,故B错误;C.粗铜精炼时,与电源正极相连的是粗铜,电极反应为:Zn-2e-=Cu2+,Fe-2e-=Fe2+,Cu-2e-=Cu2+,故C错误;D.钢铁发生电化学腐蚀的负极反应:Fe-2e-=Fe2+,故D错误。综上所述,答案为A。
〖变式5-1〗下列说法中正确的是( )
A.电解精炼铜时,电解质溶液的浓度不变
B.用Na2S作沉淀剂,除去废水中的Cu2+和Hg2+
C.用浓硫酸清洗锅炉中的水垢
D.氯化铝是一种电解质,可用电解氯化铝的方法制铝
〖变式5-2〗下列叙述正确的是( )
A.稀溶液中,H+(aq)+OH-(aq)=H2O(1) △H1=-57.3kJ·ml-1,若将含0.5mlH2SO4的浓溶液与含1mlNaOH的溶液混合,放出的热量大于57.3kJ
B.等物质的量的硫蒸气和硫粉分别完全燃烧,后者放出热量多
C.用惰性电极电解水制取H2和O2时,为了增强导电性,常加入NaCl进行电解
D.粗铜精炼时,与电源正极相连的应是粗铜,该极发生的电极反应只有Cu-2e-=Cu2+
〖变式5-3〗下列有关电化学原理及应用的说法正确的是( )
A.纯铁比钢铁更容易发生电化学腐蚀
B.铁制品表面镀锌时,铁制品应与电源正极相连
C.电解精炼铜时,阳极质量的变化大于阴极
D.右图装置中正极反应式为2H2O+2e- = H2↑+ 2OH-
『巩固练习』
一、单选题
1.在原电池和电解池的电极上发生的反应,同属氧化反应或同属还原反应的有( )
①原电池的正极和电解池的阳极所发生的反应;②原电池的正极和电解池的阴极所发生的反应
③原电池的负极和电解池的阳极所发生的反应
④原电池的负极和电解池的阴极所发生的反应
A.①②B.①④C.③④D.②③
2.能量与科学、技术、社会、环境关系密切。下列应用中能量转化关系错误的是( )
A.AB.BC.CD.D
3.有关电镀铜的实验,下列说法正确的是( )
A.电镀铜电解质溶液的浓度不断减小
B.电镀过程中硫酸铜溶液中铜离子浓度不变
C.阳极材料一般选择石墨等惰性材料
D.电镀使用的电压越大,反应速率越快,效率越高
4.某电解池装置如图所示,电解质溶液为等浓度的、、混合溶液,则电解一段时间后(溶液有剩余),阴极可能得到的产物依次为( )
A.Cu、B.Cu、、NaC.、D.、Cu
5.为阿伏加德罗常数的值。下列说法不正确的是( )
A.0.1mlH2和0.1mlI2于密闭容器中充分反应后,其分子总数为
B.标准状况下22.4LCO2和N2的混合气体中含有键的数目为
C.电解精炼铜时,当电路中转移个电子,阳极的质量一定减轻了32g
D.密闭容器中,46gNO2和N2O4的混合气体所含原子总数为
6.下列说法不正确的是( )
A.锌铜原电池中铜是正极B.在镀件上镀铜时可用金属铜作阳极
C.电解精炼铜时,纯铜作阳极D.生铁比纯铁容易生锈
7.如图所示的装置,甲中盛有CuSO4溶液,乙中盛有KI溶液,电解一段时间后,分别向C、D电极附近滴入淀粉溶液,D电极附近变蓝。下列说法正确的是
A.E、F电极分别是阴极、阳极
B.若甲池是电解精炼铜,则A电极为粗铜
C.甲中Cu2+移向B电极
D.若C电极为惰性电极,则电解后乙中溶液的pH增大
8.氟离子电池是一种前景广阔的新型电池,其能量密度是目前锂电池的十倍以上且不会因为过热而造成安全风险。如图是氟离子电池工作示意图,其中充电时从乙电极流向甲电极。已知和均难溶于水。下列说法正确的是( )
A.放电时,电子由乙电极经由导线流向甲电极
B.放电时,甲电极上的反应为:
C.充电时,导线上每通过1ml ,甲电极质量增加38g
D.充电时,外加电源的正极与乙电极相连
9.关于下列装置说法正确的是( )
A.装置①中,盐桥中的移向溶液
B.装置②工作一段时间后,a极附近溶液的pH增大
C.用装置③精炼铜时,c极为粗铜
D.装置④中电子由流向,为正极有气泡生成
10.以纯碱溶液为原料,通过电解的方法可制备小苏打,原理装置图如下:
上述装置工作时,下列有关说法正确的是
A.乙池电极接电池正极,气体X为
B.由乙池穿过交换膜进入甲池
C.甲池中只发生反应:
D.NaOH溶液Z的浓度比NaOH溶液Y的小
11.微生物电化学产甲烷法能将电化学法和生物还原法有机结合,装置如图所示(左侧转化为和,右侧和转化为)。有关说法正确的是( )
A.电源a端为负极
B.该方法能实现二氧化碳零排放
C.b电极的反应为:
D.外电路中每通过,与a相连的电极将产生
12.钠离子电池成本优势明显,有望在大规模储能中取代传统铅酸电池。下图为一种钠离子电池放电的示意图,关于该电池说法正确的是( )
A.a为电池的负极
B.放电时b极反应:
C.充电时a极反应:
D.用该电池给铅酸电池充电时,b电极接铅酸电池的极
13.次磷酸是一元中强酸,工业上采用电渗析法制备,其工作原理如图所示。下列叙述错误的是( )
A.M室发生的电极反应式为
B.电解过程中N室溶液的逐渐增大
C.装置中a膜、b膜、c膜均为阳离子交换膜
D.理论上M室和N室石墨电极上产生的气体物质的量之比为1∶2
14.锂离子电池是目前手机、笔记本电脑等现代数码产品中应用最广泛的电池,它主要依靠锂离子在正极和负极之间移动来工作。典型的锰酸锂可充电电池的总反应为:LixC6 + Li1−xMn2O4C6 + LiMn2O4。其电极分别为层状LiMn2O4和碳材料。下列说法正确的是( )
A.放电时层状LiMn2O4电极作正极
B.充电时碳材料应接电源的正极
C.充电时阳极反应为:C6 + xLi+ - xe− = LixC6
D.放电时,Li+嵌入碳材料使该电极增重
15.下列关于电解原理应用的说法错误的是( )
A.氯碱工业的电解槽需使用阳离子交换膜隔开两极产物
B.在铁上镀铜时,铁作阴极
C.钠、镁、铝均可通过电解其熔融氯化物的方法冶炼得到
D.电解精炼铜一段时间,电解质溶液中c(Cu2+)略减小
16.氟离子电池是新型电池中的一匹黑马,其理论比能量高于锂电池。一种氟离子电池的工作原理如图所示,下列说法正确的是( )
A.放电时,a是电源的负极
B.放电时,a极的电极反应为:LaSrMnO4F2-2e-=LaSrMnO4+2F-
C.充电时,电极a接外电源的正极
D.可将含F-的有机溶液换成水溶液以增强导电性
二、工业流程题
17.镍是一种银白色金属,被用来制造不锈钢、高镍合金钢和合金结构钢,广泛用于飞机、坦克、雷达等各种军工制造业。工业上以一种富镍矿石(主要含有NiS,还含有Cu、Si、Fe、Mg、Ca等元素)中提取镍的工艺流程如图所示。
查阅资料:室温下,氢氧化物沉淀的pH如下表所示:
回答下列问题:
(1)煅烧前要将矿石粉碎过筛,能够达到同样目的的措施还有_______(任写两条),酸浸后得到的滤渣主要成分有_______、_______(填化学式)。
(2)写出NiS在空气中煅烧的反应化学方程式:_______。
(3)“沉镍”时需保持pH不低于_______,此时溶液中的最大值为_______ml/L。
(4)若采用惰性电极电解硫酸镍溶液制镍,阳极产物是_______。
18.镍、铬等属于宝贵的金属资源。一种回收电化学废渣中铬镍的工艺流程如下:
已知:①铬镍渣中含有Cr2O3、NiO、Fe2O3、FeO、SiO2等;②25℃时,部分物质的溶度积表:
回答下列问题:
(1)“氧化焙烧”时,发生的化学方程式___________。
(2)为提高“酸浸”的浸出率,可采取的措施有___________(填字母)。
A.适当增强硫酸的浓度 B.缩短酸浸时间
C. 适当降低酸浸温度 D.使用强力搅拌器搅拌
(3)“调pH”时,若pH至少为___________时,沉淀完全。()
(4)“沉镍”后,“煅烧”的化学方程式为___________。
(5)已知“电解”操作中的装置如下图所示。
①a接电源的___________(填“正”或“负”)极。
②电极N上的电极反应式为___________。
③电解过程中,溶液中反应的离子方程式为___________。
三、原理综合题
19.“碳中和”引起各国的高度重视,正成为科学家研究的主要课题,利用催化加氢制二甲醚,可以实现的再利用,涉及以下主要反应:
Ⅰ.
Ⅱ.
相关物质及能量变化的示意图如图所示。
(1)反应Ⅱ的=___________,该反应在___________(填“高温”“低温”或“任何温度”)下能自发进行。
(2)恒压条件下,、起始量相等时,的平衡转化率和的选择性随温度变化如图所示。已知:的选择性
①高于300℃,的平衡转化率随温度升高而上升的原因是___________。
②300℃时,反应Ⅱ的平衡常数表达式:K=___________,通入、各1ml,平衡时的选择性、的平衡转化率都为30%,平衡时生成的物质的量为___________ml。
③220℃时,不改变反应时间和温度,一定能提高的选择性的措施有___________(任写一种)
(3)利用燃料电池电解,可将雾霾中的NO、分别转化为和,如图装置所示,则a极发生的电极反应式为___________。
四、实验题
20.电化学与科研、生产、生活紧密相联。回答下列问题:
(1)某兴趣小组研究酸碱性环境对电化学反应的影响,连接如图装置。
设计如下两个独立实验。
①向左侧烧杯中滴入NaOH溶液,出现蓝灰色沉淀,继续缓慢滴入NaOH溶液,灵敏电流计指针向右偏转(电子从左向右运动),此时左侧的电极反应式为_____。
②向右侧烧杯中滴入NaOH溶液,有微小气泡生成,灵敏电流计指针向左偏转,左侧无明显变化。此时原电池中的总反应的化学方程式为_______。
(2)我国科学家设计了一种协同转化装置,实现对天然气中和的高效去除,装置如图所示。其中电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯。
①ZnO@石墨烯是_______(填“阳”或“阴”)极。
②石墨烯电极区发生反应为:
i.EDTAEDTA;ii._______。
③协同转化总反应的化学方程式为_______。
④工作时,ZnO@石墨烯电极区的pH基本保持不变,结合工作原理解释其原因:_______。
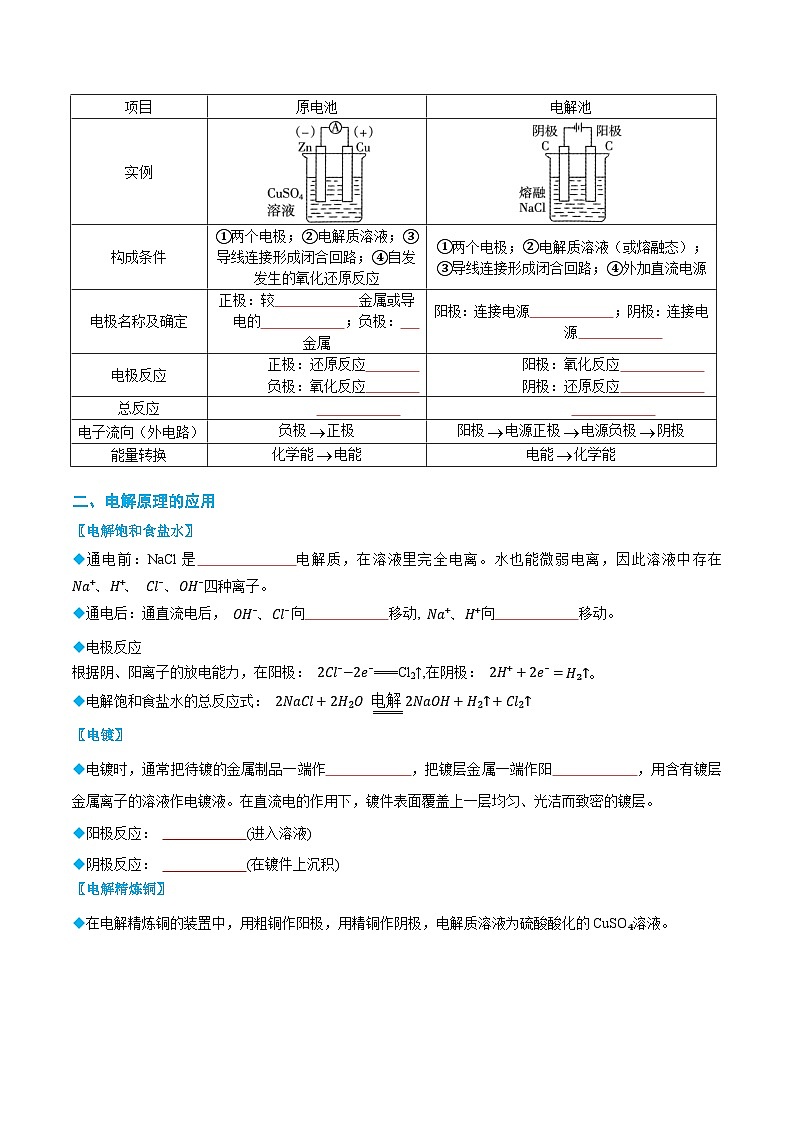
项目
原电池
电解池
实例
构成条件
①两个电极;②电解质溶液;③导线连接形成闭合回路;④自发发生的氧化还原反应
①两个电极;②电解质溶液(或熔融态);
③导线连接形成闭合回路;④外加直流电源
电极名称及确定
正极:较 金属或导电的 ;负极: 金属
阳极:连接电源 ;阴极:连接电源
电极反应
正极:还原反应
负极:氧化反应
阳极:氧化反应
阴极:还原反应
总反应
电子流向(外电路)
负极正极
阳极电源正极电源负极阴极
能量转换
化学能电能
电能化学能
类型
电极反应特点
实例
电解对象
电解质浓度
pH
电解质溶液复原
电解水型
阴:4H++4e-===2H2↑
阳::40H--4e-===2H2O+O2↑
NaOH
水
增大
增大
水
H2SO4
水
增大
减小
水
Na2SO4
水
增大
不变
水
电解电解质型
电解质电离出的阴阳离子分别在两极放电
HCl
电解质
减小
增大
氯化氢
CuCl2
电解质
减小
—
氯化铜
放H2生碱型
阴极:H2O放H2生碱;阳极:电解质阴离子放电
NaCl
电解质和
水
生成新电解质
增大
氯化氢
放O2生酸型
阴极:电解质阳离子放电;阳极:H2O放O2生酸
CuSO4
电解质和
水
生成新电
解质
减小
氧化铜
A.火力发电
B.碱性锌锰电池
C.电解饱和食盐水
D.氢氧燃料电池
A
B
C
D
铁件上镀铜
测定稀硫酸和稀氢氧化钠的中和热
测反应生成H2的体积
无水MgCl2固体
水电站
硅太阳能电池
天然气燃气炉
电解镀锌
A.化学能→电能
B.太阳能→电能
C.化学能→热能
D.电能→化学能
沉淀物
开始沉淀时(0.01ml/L)的pH
2.2
9.4
6.3
7.2
沉淀完全时()的pH
3.2
12.4
8.3
9.2
物质
Ksp
人教版 (2019)选择性必修1第一节 原电池精品课时练习: 这是一份人教版 (2019)选择性必修1<a href="/hx/tb_c4002434_t7/?tag_id=28" target="_blank">第一节 原电池精品课时练习</a>,文件包含41原电池原卷版docx、41原电池解析版docx等2份试卷配套教学资源,其中试卷共56页, 欢迎下载使用。
人教版 (2019)选择性必修1第三节 盐类的水解优秀当堂达标检测题: 这是一份人教版 (2019)选择性必修1<a href="/hx/tb_c4002428_t7/?tag_id=28" target="_blank">第三节 盐类的水解优秀当堂达标检测题</a>,文件包含33盐类的水解原卷版docx、33盐类的水解解析版docx等2份试卷配套教学资源,其中试卷共50页, 欢迎下载使用。
高中化学人教版 (2019)选择性必修1第一节 电离平衡优秀习题: 这是一份高中化学人教版 (2019)选择性必修1<a href="/hx/tb_c4002426_t7/?tag_id=28" target="_blank">第一节 电离平衡优秀习题</a>,文件包含31电离平衡原卷版docx、31电离平衡解析版docx等2份试卷配套教学资源,其中试卷共50页, 欢迎下载使用。













