
江苏省常熟中学2023-2024学年高二上学期12月学业水平调研化学试题(Word版附答案)
展开请将选择题答案填涂在答题卡上,非选择题答案填写在答题纸
单选题:本题包括14小题,每小题3分。
可能用到的相对原子质量:H-1、C-12、N-14、O-16、Na-23、S-32、Cl-35.5、K-39、Fe-56、Zn-65、Ba-137、Mg-24、Pb-207
1.中国航天科技发展举世瞩目。2020年“嫦娥五号”成功携带月球样品返回地球,2021年“天问一号”着陆火星,它们都是由以液氢为燃料的“长征五号”火箭搭载升空的。下列有关说法错误的是
A.氢气燃烧的产物不污染环境,有利于实现“碳中和”
B.低温液态储氢可以大大提高氢气的密度,降低储运成本
C.已知2H2(g)+O2(g)=2H2O(g),△H2=-483.6kJ/ml,则H2燃烧热△H=-241.8 kJ/ml
D.氢气的来源较多,包括水的电解、煤的气化、乙烷裂解和氯碱工业等
2.我国古代就掌握了青铜(铜-锡合金)的冶炼、加工技术,制造出许多精美的青铜器;Pb、PbO2是铅蓄电池的电极材料,不同铅化合物一般具有不同颜色,历史上曾广泛用作颜料,下列物质性质与用途具有对应关系的是
A.石墨能导电,可用作润滑剂 B.单晶硅熔点高,可用作半导体材料
C.青铜比纯铜熔点低、硬度大,古代用青铜铸剑 D.含铅化合物颜色丰富,可用作电极材料
3.下列实验原理与装置能达到实验目的的是
A.用装置甲蒸发NaHCO3溶液得NaHCO3晶体
B.用装置乙进行中和热的测定
C.用装置丙电解MgCl2溶液,制备金属Mg
D.用装置丁探究铁钉吸氧腐蚀
4.下列说法不正确的是
A.KAl(SO4)2·12H2O溶于NaOH溶液可形成Al(OH)3胶体
B.将KCl溶液从常温加热至80'C,溶液的pH变小但仍保持中性
C.常温下,NaCN溶液呈碱性,说明HCN是弱电解质
D.常温下,pH为3的醋酸溶液中加入醋酸钠固体,溶液pH增大
s.对于反应2NO(g)+2CO(g)=2CO2(g)+N2(g) △H=-746.5kJ/ml,下列说法正确的是
A.该反应在任何条件下都能自发进行
B.反应的平衡常数可表示为K=
C.使用高效的催化剂可以降低反应的焓变
D.其它条件不变,增大的值,NO的转化率下降
6.下列表述正确的是
A.向0.1ml/LpH=1的NaHA溶液中加入NaOH溶液的离子方程式:HA-+OH-=A2-+H2O
B.常温下水电离的c(H+)=1×10-12ml/L溶液中:Cl-、、、S2-一定能大量共存
C.稀NaOH溶液与稀HCl中和的热化学方程式:NaOH+HCl=NaCl+H2O △H=-57.3kJ/ml
D.NH4HCO3稀溶液与足量NaOH稀溶液反应的离子方程式:++2OH-=NH3·H2O+
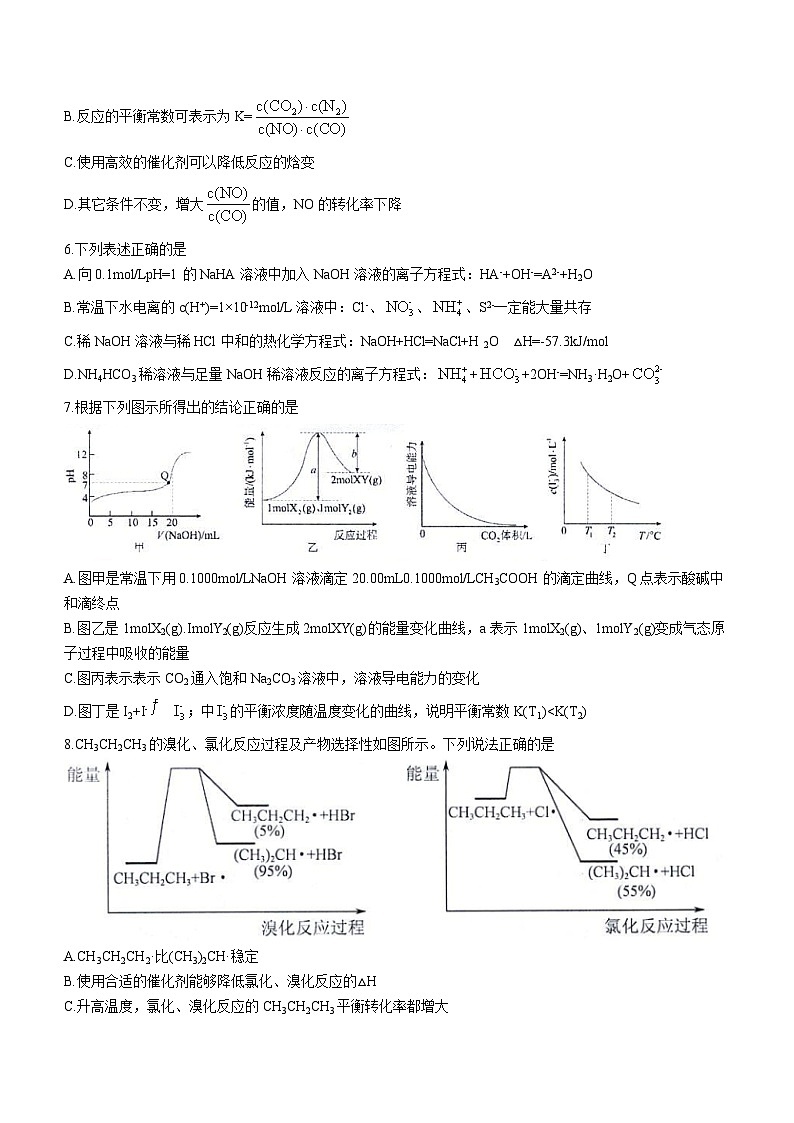
7.根据下列图示所得出的结论正确的是
A.图甲是常温下用0.1000ml/LNaOH溶液滴定的滴定曲线,Q点表示酸碱中和滴终点
B.图乙是1mlX2(g).ImlY2(g)反应生成2mlXY(g)的能量变化曲线,a表示1mlX2(g)、1mlY2(g)变成气态原子过程中吸收的能量
C.图丙表示表示CO2通入饱和Na2CO3溶液中,溶液导电能力的变化
D.图丁是I2+I-;中的平衡浓度随温度变化的曲线,说明平衡常数K(T1)
A.CH3CH2CH2·比(CH3)2CH·稳定
B.使用合适的催化剂能够降低氯化、溴化反应的△H
C.升高温度,氯化、溴化反应的CH3CH2CH3平衡转化率都增大
D.以CH3CH2CH3为原料合成2-丙醇时,应该选用溴化反应,然后再水解
9.常温下,下列有关氨水的说法正确的是
A.相同浓度的氨水和NaOH溶液的导电能力相同
B.相同浓度的氨水和NH4Cl溶液中,水的电离程度相同
C.pH均为10的氨水和Ba(OH)2,溶液中,OH-的物质的量浓度相同
D.将pH均为10的氨水和NaOH溶液稀释相同倍数后,NaOH溶液的pH大于氨水
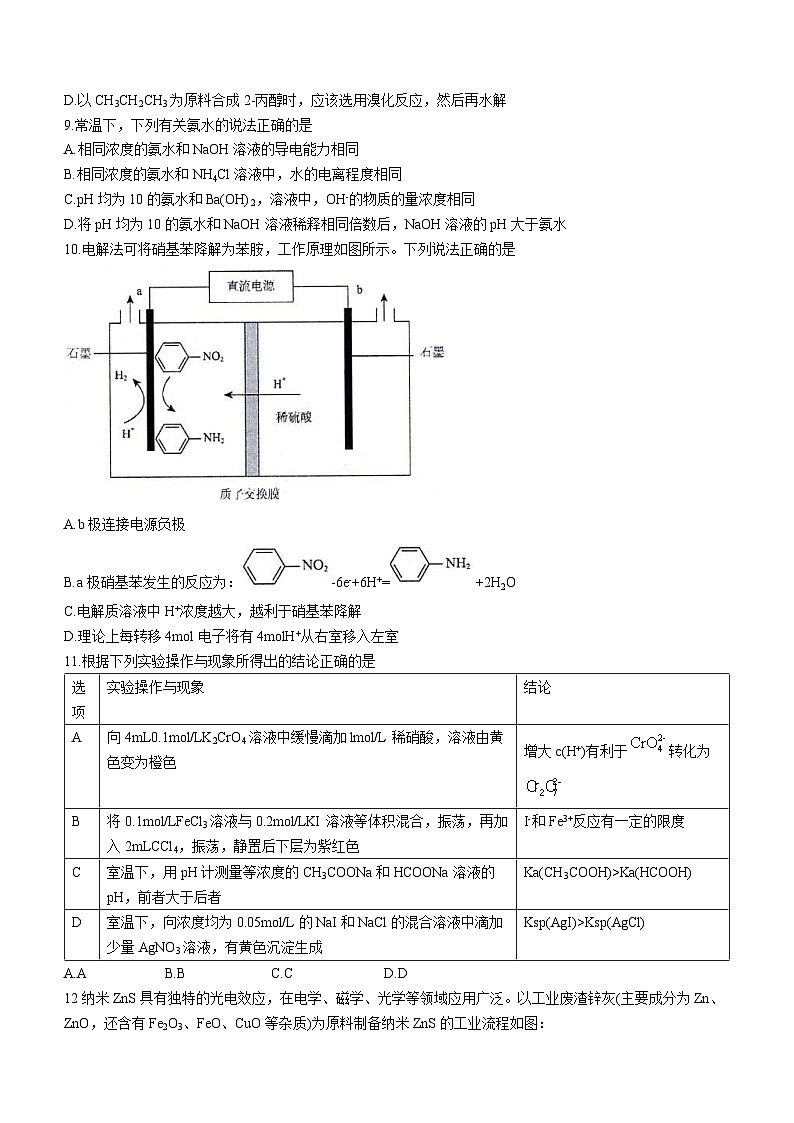
10.电解法可将硝基苯降解为苯胺,工作原理如图所示。下列说法正确的是
A.b极连接电源负极
B.a极硝基苯发生的反应为:-6e-+6H+=+2H2O
C.电解质溶液中H+浓度越大,越利于硝基苯降解
D.理论上每转移4ml电子将有4mlH+从右室移入左室
11.根据下列实验操作与现象所得出的结论正确的是
A.A B.B C.C D.D
12纳米ZnS具有独特的光电效应,在电学、磁学、光学等领域应用广泛。以工业废渣锌灰(主要成分为Zn、ZnO,还含有Fe2O3、FeO、CuO等杂质)为原料制备纳米ZnS的工业流程如图:
已知:Ksp[Fe(OH)3]=3.8×10-38;Ksp[Cu(OH)2]=2×10-20,Ksp(ZnS)=1.6×10-24。下列说法不正确的是
A.酸浸时FeO与稀硝酸反应的离子方程式为3FeO+10H++=3Fe3++NO↑+5H2O
B.将酸浸的尾气循环利用,加入的X气体可以是O2
C.滤渣2中的成分是Zn和Fe
D.当溶液中Zn2+浓度小于1.0×10-5ml/L时,则可认为其沉淀完全。若要使Zn2+沉淀完全,溶液中S2-浓度应大于1.6×10-19ml/L
13常温下,H2A是一种易溶于水的二元酸,将NaOH溶液滴入等物质的量浓度的H2A溶液中,溶液中H2A、HA-、A2-的物质的量分数随溶液pH的变化关系如图所示。下列说法正确的是
A.常温下,H2A的一级电离平衡常数Ka1=10-6.27
B.当V(NaOH溶液):V(H2A溶液)=1:1时,c(H+)-c(OH-)=2c(A2-)-c(H2A)
C.当pH=6.27时,c(A2-)=c(HA-)>c(H+)>c(OH-)
D.当溶液呈酸性时,c(Na+)>2c(A2-)+c(HA-)
14.在一定的温度和压强下,将按一定比例混合的CO2和H2通过装有催化剂的反应器可得到甲烷。已知:
CO2(g)+4H2(g)=CH4(g)+2H2O(g) △H=-165kJ/ml
CO2(g)+H2(g)=CO(g)+H2O(g) △H=+41kJ/ml
催化剂的选择是CO2甲烷化技术的核心。在两种不同催化剂作用下反应相同时间,测CO2转化率和生成CH4选择性随温度变化的影响如图所示。
CH4选择性=×100%
下列有关说法正确的是
A.在260℃~320℃间,以Ni-CeO2为催化剂,升高温度CH4的产率不变
B.延长W点的反应时间,一定能提高CO2的转化率
C.高于320℃后,以Ni为催化剂,随温度的升高CO2转化率上升的原因是平衡正向移动
D.CO(g)+3H2(g)=CH4(g)+H2O(g) △H=-206kJ/ml
15.某研究小组为了精确检测果脯蜜饯中添加剂亚硫酸盐的含量,用如图所示装置进行实验:
Ⅰ.三颈烧瓶中加入25.000g均匀的果脯蜜饯样品和200mL水,锥形瓶中加入溶液。
Ⅱ.以0.1L/min流速通入氮气,再滴入磷酸,加热并保持微沸,待锥形瓶中溶液的颜色不再发生变化,停止加热。
Ⅲ.向润洗过的滴定管中装入0.0500ml/L(NH4)2Fe(SO4)2溶液至0刻度以上,排尽空气后记录读数,将(NH4)2Fe(SO4)2溶液逐滴滴入锥形瓶,待溶液变为浅红色时,用蒸馏水洗涤锥形瓶内壁,继续滴定至溶液由浅红色褪为无色,记录读数。
Ⅳ.重复上述实验3次,记录消耗的(NH4)2Fe(SO4)2溶液体积如下表:
回答下列问题:
(1)冷凝管的进水方向为____(填“a”或“b”)。
(2)步骤Ⅱ中KMnO4被还原为Mn2+,其发生反应的离子方程式为_______________。
(3)设计步骤Ⅲ目的是_____________,其中所用滴定管的名称是_________。
(4)上述实验中若先加磷酸再通氮气,会使测定结果______(填“偏高”或“偏低”或“无影响”),该样品中亚硫酸盐含量(以SO2计)为____g/kg,(写出计算过程)
16.已知25℃时,醋酸、碳酸、氢氰酸的电离平衡常数如下表:25℃时,三种酸的电离平衡常数如下:
回答下列问题:
(1)25℃时,pH相等的三种溶液①CH3COONa溶液、②Na2CO3溶液、③NaCN溶液,浓度由大到小的顺序为____(填序号);
(2)25℃时,向NaCN溶液中通入少量CO2,反应的离子方程式为______________。
(3)将浓度为0.02ml/L的HCN与0.01ml/LNaOH溶液等体积混合,则混合溶液中c(H+)______c(OH-)(填“>”、“<”或“=”);
(4)用蒸馏水稀释0.10ml/L的醋酸,下列各式表示的数值随水量的增加而增大的是_________。
A. B. C. D.
(5)常温下,向浓度为0.1ml/L、体积为VL的氨水中逐滴加入一-定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图中信息回答下列问题:
①比较b、c、d三点时的溶液中,由水电离出的c(H+)由大到小顺序为_________。
②根据以上滴定曲线判断下列说法正确的是______(溶液中N元素只存在和NH3·H2O两种形式)。
A.点b所示溶液中:c()+c(H+)=c(OH-)+c(NH3·H2O)
B.点c所示溶液中:c(Cl-)=c(NH3·H2O)+c()
C.点d所示溶液中:c(Cl-)>c(H+)>c()>c(OH-)
D.滴定过程中可能有:c(NH3·H2O)>c()>c(OH-)>c(Cl-)>c(H+)
17.天然气中含有的H2S会腐蚀管道设备,开采天然气后须及时除去H2S。在此过程中会产生大量含硫废水(其中硫元素的主要化合价是-2价),对设备、环境等边成严重危害。
已知:ⅰ:H2S有剧毒;常温下溶解度为1:2.6(体积)。
ⅱ:H2S、HS-、S2-在水溶液中的物质的量分数随pH的分布曲线如下图。
ⅲ:碳酸的电离平衡常数:Ka1=4.5×10-7,Ka2=4.7×10-11
(1)用过量的Na2CO3溶液吸收天然气中的H2S的离子方程式是_________________,该反应对应的化学平衡常数K=________。
(2)①当pH≈8时,含硫废水中H2S、HS-的浓度比是_____________。
②NaHS溶液呈碱性,原因是__________________。(计算说明)。
(3)沉淀法处理含硫废水:
向pH≈9的含硫废水中加入适量Cu2+的溶液,观察到有黑色沉淀生成,则溶液的pH______(填“升高““降低”或“不变”)。
(4)氧化还原法处理含硫废水:
向pH≈9的含硫废水中加入一定浓度的Na2SO3溶液,加酸将溶液调为pH=5,产生淡黄色沉淀。
①反应的离子方程式是_____________。
②不同pH时,硫化物去除率随时间的变化曲线如右图所示。本工艺选择控制体系的pH=5,不选择pH<5,从环境保护的角度分析其主要原因:____________。
18.有效去除大气中的NOx和水体中的氮是环境保护的重要课题。
(1)已知:①2CO(g)+O2(g)=2CO2(g);△H1=-566.0kJ/ml
②N2(g)+2O2(g)=2NO2(g);△H2=+64kJ/ml
反应2NO2(g)+4CO(g)=N2(g)+4CO2(g);△H3=_____________。
(2)磷酸铵镁(MgNH4PO4)沉淀法可去除水体中的氨氮(和NH3)。实验室中模拟氨氮处理:1L的模拟氨氮废水(主要含),置于搅拌器上,设定反应温度为25℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30min后,取液面下2cm处清液测定氨氮质量浓度。
①生成磷酸铵镁沉淀的离子反应方程式为______________。
②测得反应pH对氨氮去除率的影响如图1所示,当pH从7.5增至9.0的过程中,水中氨氮的去除率明显增加,原因是____________________________。
③当反应pH为9.0时,该沉淀法对氨氮的去除率达到最高,当pH继续增至10.0时,氨氮的去除率下降,原因是_____________________________。
(3)纳米零价铁(NZVI)/BC与(CuPd)/BC联合作用可去除水体中的硝态氮。
在NZVI/BC和(CuPd)/BC复合材料联合作用的体系中,生物炭(BC)作为NZVI、Cu、Pb的载体且减少了纳米零价铁的团聚,纳米零价铁作为主要还原剂,Cu和Pd作为催化剂且参与吸附活性H。
①NZVI/BC和(CuPd)BC复合材料还原硝酸盐的反应机理如图2所示,转化为N2或的过程可描述为____________________。
②实验测得体系初始pH对去除率的影响如图3,前200min内,pH=9.88时的去除率远低于pH=4.05时,其可能的原因是________________________。
选项
实验操作与现象
结论
A
向4mL0.1ml/LK2CrO4溶液中缓慢滴加lml/L稀硝酸,溶液由黄色变为橙色
增大c(H+)有利于转化为
B
将0.1ml/LFeCl3溶液与0.2ml/LKI溶液等体积混合,振荡,再加入2mLCCl4,振荡,静置后下层为紫红色
I-和Fe3+反应有一定的限度
C
室温下,用pH计测量等浓度的CH3COONa和HCOONa溶液的pH,前者大于后者
Ka(CH3COOH)>Ka(HCOOH)
D
室温下,向浓度均为0.05ml/L的NaI和NaCl的混合溶液中滴加少量AgNO3溶液,有黄色沉淀生成
Ksp(AgI)>Ksp(AgCl)
第一次
第二次
第三次
第四次
(NH4)2Fe(SO4)2溶液体积
19.98mL
20.50mL
20.00mL
20.02mL
化学式
CH3COOH
H2CO3
HCN
电离平衡常数
K.=1.8×10-5
Ka1=4.3×10-7 Ka2=5.6×10-11
K=6.2×10-10
江苏省常熟中学2023~2024学年高二上学期12月阶段学习
质量检测化学试题答案
15.(1)a(2分)
(2)2+5SO2+2H2O==2Mn2++5+4H+(2分)
(3)测定锥形瓶中剩余的KMnO4(2分)酸式滴定管(2分)
(4)偏低(2分)1.28g/kg(4分)
16.(1)①>③>②(2分)
(2)CN-+CO2+H2O=HCN+;(2分)
(3)<(2分)
(4)B(2分)
(5)①10-5(2分)②d>c>b(2分)③D(2分)
17.[答案](1)
H2S+=+HS-
K=≈2.13×103
(2)1:10;HS-水解平衡常数Kh==10-7>Ka2=10-12.9,可知水解程度大于电离程度,则水解生成的c(OH-)>c(H+),溶液呈碱性
(3)降低;(4)2HS-++4H+=3S↓+3H2O;pH<5时,溶液中-2价S元素主要以H2S的形式存在,常温下H2S的溶解度为1:2.6,酸性强使H2S更易逸出,H2S有剧毒会污染环境
18.(1)-1196kJ/ml
(2)①Mg2++OH-++=MgNH4PO4↓+H2O
②随着pH的增大,转化为,c()浓度增大,使得生成沉淀的反应速率加快,氨氮去除率增加③OH-浓度增大,使得Mg2+生成Mg(OH)2,MgNH4PO4沉淀会转化为Mg(OH)2沉淀,释放促使溶液中氨氮的去除率下降1
2
3
4
5
6
7
C
C
C
A
D
D
B
8
9
10
11
12
13
14
D
C
D
A
C
C
D
2022-2023学年江苏省常熟中学高一下学期学业质量阳光指标调研化学试题: 这是一份2022-2023学年江苏省常熟中学高一下学期学业质量阳光指标调研化学试题,文件包含江苏省常熟中学高一下学期学业质量阳光指标调研化学试题原卷版docx、江苏省常熟中学高一下学期学业质量阳光指标调研化学试题解析版docx等2份试卷配套教学资源,其中试卷共40页, 欢迎下载使用。
江苏省常熟市中学2023-2024学年高一上学期12月学业水平调研化学试卷: 这是一份江苏省常熟市中学2023-2024学年高一上学期12月学业水平调研化学试卷,共7页。
江苏省常熟市中学2023-2024学年高二上学期12月学业水平调研化学试卷: 这是一份江苏省常熟市中学2023-2024学年高二上学期12月学业水平调研化学试卷,共10页。












