




2022-2023学年江苏省常熟中学高一下学期学业质量阳光指标调研化学试题
展开可能用到的相对原子质量:H:1 C:12 O:16 S:32 Cl:35.5 Na:23 Mg:24 Ag:108 Ba:137
一、单项选择题(每小题3分,共39分)
1. 我国力争在2060年前实现“碳中和”,体现了中国对解决气候问题的大国担当。在实际生产中,可利用反应来捕捉废气中的,下列有关化学用语或说法正确的是
A. 中子数为8的氧原子:
B. H、D、T互为同位素
C. 的结构示意图:
D. 的电离方程式:
2. 离子方程式BaCO3 + 2H+ = CO2↑+ H2O + Ba2+ 中的H+ 不能代表的物质是
①HCl ②H2SO4 ③HNO3 ④NaHSO4 ⑤CH3COOH
A ②④⑤B. ④⑤C. ①③D. ⑤
3. 每年10月23日上午6:02到下午6:02被誉为“摩尔日”(MleDay),美式写法为6:02/10/23,外观与阿伏加德罗常数的值6.02×1023相似。设NA表示阿伏加德罗常数的值,下列说法正确的是
A. 25℃,1.01×105Pa,32gO2和O3的混合气体所含原子数为2.5NA
B. 常温常压下,44gCO2含有的原子数为3NA
C. 标准状况下,11.2LH2O含有的原子数为1.5NA
D. 含有NA个氦原子的氦气在标准状况下的体积约为11.2L
4. 下列有关实验操作、原理和装置不能达到实验目的的是
A. 用装置甲除去食盐水中的泥沙B. 用装置乙灼烧海带
C. 用装置丙分离酒精和水的混合物D. 用装置丁制取少量蒸馏水
5. 在给定条件下,下列选项所示的物质间转化均能实现的是
A.
B.
C.
D.
6. 已知X、Y、Z、W、R五种元素,X是原子序数最小的元素;Y元素原子最外层电子数是内层电子总数的2倍;Z元素原子最外层电子数比其次外层电子数多4个;W元素原子K层和M层电子总数等于其L层电子数;R元素原子最外层有1个电子,其阳离子与Z的阴离子原子核外电子总数相同。下列说法不正确的是
A. X2Z常温下为液态
B. R的氧化物不与酸反应
C. Y的一种单质可导电
D. W的一种氧化物可形成酸雨
7. 类比推理是重要的学科思想,下列有关类比推理的说法正确的是
A. 通入溶液中无白色沉淀产生,推测通入溶液中也无白色沉淀产生
B. 与反应生成和,则与反应生成和
C. 能使溶液先浑浊后澄清,则也能使溶液先浑浊后澄清
D. 木炭在足量的氧气中燃烧生成,则硫黄在足量的氧气中燃烧生成
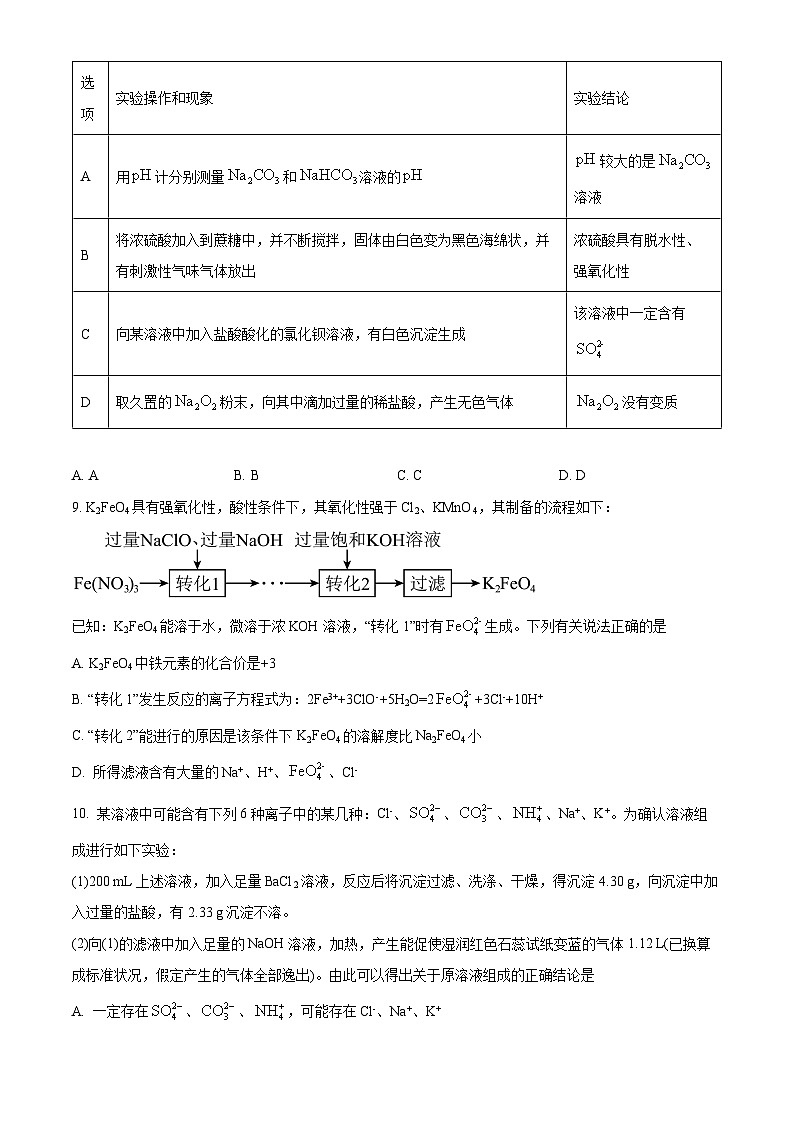
8. 根据下列实验操作和现象所得到的结论正确的是
A. AB. BC. CD. D
9. K2FeO4具有强氧化性,酸性条件下,其氧化性强于Cl2、KMnO4,其制备的流程如下:
已知:K2FeO4能溶于水,微溶于浓KOH溶液,“转化1”时有生成。下列有关说法正确的是
A. K2FeO4中铁元素的化合价是+3
B. “转化1”发生反应的离子方程式为:2Fe3++3ClO-+5H2O=2+3Cl-+10H+
C. “转化2”能进行的原因是该条件下K2FeO4的溶解度比Na2FeO4小
D. 所得滤液含有大量的Na+、H+、、Cl-
10. 某溶液中可能含有下列6种离子中的某几种:Cl-、、、、Na+、K+。为确认溶液组成进行如下实验:
(1)200 mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30 g,向沉淀中加入过量的盐酸,有2.33 g沉淀不溶。
(2)向(1)的滤液中加入足量的NaOH溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体1.12 L(已换算成标准状况,假定产生的气体全部逸出)。由此可以得出关于原溶液组成的正确结论是
A. 一定存在、、,可能存在Cl-、Na+、K+
B. 一定存在、、、Cl-,一定不存在Na+、K+
C. c()=0.01 ml·L-1,c()>c()
D. 如果上述6种离子都存在,则c(Cl-)>c()
11. 下列指定反应的离子方程式正确的是
A. 向含有和的混合溶液中通入少量:
B. 向饱和食盐水中先通入足量的,再通入足量的:
C. 向溶液中加入少量粉末:
D. 用过量除去水中溶解的氯气:
12. 某澄清透明溶液中只可能含、、、、、、和中的几种(忽略水的电离)。取溶液,平均分成甲、乙、丙三等份,设计如下实验。下列说法正确的是
A. 溶液一定含有,可能含有
B. 由于溶液是澄清透明,所以不含
C. 无法确定该溶液中是否存在、,可通过焰色反应进行检验
D. 乙中的实验可以确定原溶液中不存在
13. 标准状况下,将和组成的混合气体通入溶液中充分反应后(气体被充分吸收且无剩余),溶液的棕黄色变浅。向反应后的溶液中加入足量的溶液,将所得沉淀过滤、洗涤、干燥后称重,其质量为。则下列关于该过程的推断正确的是
A. 所得沉淀为的B. 混合气体中体积可能为
C. 的取值范围为D. 混合气体中体积无法确定
二、非选择题(共61分)
14. 亚氯酸钠()是一种高效氧化剂和优质漂白剂。一种以氯酸钠()为原料制备粗品的工艺流程如图所示:
已知:①纯易分解爆炸,空气中的体积分数在以下比较安全;为强酸;
②在碱性溶液中稳定存在,在酸性溶液中迅速分解;
③含水受热易分解。
(1)现由浓硫酸配制“溶解”时所需的稀溶液,需要用到的玻璃仪器有烧杯、玻璃棒、量筒、_______、___________。如果定容时仰视容量瓶刻度线,配制的溶液浓度会___________(填“偏高”、“偏低”或“无影响”)。
(2)试剂A可以选择___________(填字母序号)。
a. b.浓硝酸 c.
反应Ⅰ发生的离子方程式为___________。
(3)反应Ⅱ的离子方程式为___________。
(4)下列关于上述流程的说法中,合理的是___________(填字母序号)。
a.反应I进行过程中应持续鼓入空气
b.反应Ⅰ后得到的母液中,溶质的主要成分是
c.反应Ⅱ中应过量
(5)中间产物二氧化氯在生产生活中也有广泛应用。用处理泄漏的氰化钠(,其中化合价为价),得到无毒的、和。请写出该反应的化学方程式___________。
(6)一种有效成分为、、的“二氧化氯泡腾片”。能快速溶于水,溢出大量气泡,同时得到溶液。上述过程,写出产生“气泡”的离子方程式___________;写出生成的离子方程式___________。
(7)含氯消毒剂次氯酸钠可通过将氯气通入烧碱溶液制备,若将氯气通入热的烧碱溶液中(会发生副反应),可以得到、和的混合液。当混合液中和的个数比为时,混合液中和的个数比为___________。
(8)利用海洋资源获得溴的主要工业生产流程如下所示。
①吹出塔中通入热空气吹出利用了的_______(填序号);吸收塔中吸收,利用了的_______(填序号)。
A.氧化性 B.还原性 C.挥发性 D.易溶于水
②吸收塔中反应的化学方程式是_______。若用沉淀法检验,沉淀颜色为_______,对应的离子方程式_______。
③以海带为原料获取碘的工艺流程如图,向酸化的滤液中加过氧化氢溶液写出该反应的离子方程式_______。
(9)向、的混合溶液中通入一定量氯气,溶液中各种离子物质的量的变化如图所示。已知还原性:,原混合溶液中___________。
15. 硫元素是动植物生长不可缺少的元素,图1是自然界中硫元素的存在示意图。图2是硫元素的常见化合价与部分物质类别的对应关系,回答下列问题。
(1)图1中与图2中M、N对应的物质分别是___________、___________。
(2)与反应中氧化剂与还原剂的物质的量之比为___________。
(3)溶液易变质,实验室检验溶液是否变质的基本操作是___________。
(4)已知能被酸性氧化为,则的溶液与的溶液恰好反应时,发生的离子方程式为:___________。
(5)的排放是造成酸雨的主要因素。形成酸雨的原理之一可简单表示如下:
请回答下列问题:
①反应b的化学方程式为:___________。
②在一段时间内连续不断测定溶液的,发现变小,表示该变化的化学方程式是:___________。
③若用足量氢氧化钠溶液吸收含二氧化硫的工业废气,写出该反应的离子方程式:___________。
(6)过二硫酸钠()有强氧化性,在碱性条件下溶液能将氧化成,且反应后的溶液滴入溶液生成不溶于稀盐酸的白色沉淀,该反应的离子方程式为___________。
(7)雌黄()和雄黄()在自然界中共生且可以相互转化(两者的硫元素价态均为价)。
①和在盐酸中恰好完全反应转化为和并放出气体。则参加反应的和的物质的量之比为___________。
②和可以相互转化,转化过程中存在如图所示的步骤。若1mlAs4S4参加反应时,转移电子,则物质为___________,消耗氧气___________。
16. 以海水为原料可获得钠、镁等金属及其化合物。
(1)实验室有瓶标签已损坏的白色固体纯净物(不含结晶水),要确定其化学式,有如下操作:
①取少量固体在试管中加热,一段时间后称量,质量不变。
②待试管冷却后,再加水使固体完全溶解,将溶液分成两份,一份滴入1~2滴酚酞,溶液变红,说明该溶液显___________;一份逐滴加入盐酸,开始无气体,后产生无色无味能使澄清石灰水变浑浊的气体。该固体化学式为___________。
(2)向一定体积一定物质的量浓度的溶液中缓慢通入一定量的,充分反应后,得到含有溶质M和N的溶液,则M和N不可能是_________(填序号)。
A.和 B.和 C.和
(3)将金属钠分别放入下列溶液中,既有气体产生,又有沉淀产生的是___________(填序号,下同)
①溶液 ②溶液 ③溶液 ④溶液 ⑤溶液 ⑥溶液 ⑦饱和澄清石灰水
(4)某同学拟用溶液吸收气体制备溶液,他设计了如下实验步骤:
①用溶液吸收过量的气体,至气体不再溶解;
②小心加热溶液1~2min(充分逸出,未发生化学反应);
③在得到的溶液中加入另一半25mL 溶液,使溶液充分混合。
制备过程中涉及到的化学反应用离子方程式分别表示为_________、___________。
(5)用溶液(溶液显碱性)和溶液发生复分解反应制备,在烧杯中制备沉淀时,应选用的加料方式是_________(填字母),原因是避免生成_________(填物质的化学式)沉淀。
A.将溶液缓慢加入到盛有溶液的烧杯中
B.将溶液缓慢加入到盛有溶液的烧杯中
(6)某碳酸钠固体样品中含有少量杂质。小组同学用不同的方案测定样品中碳酸钠的纯度。
①方案1:已知:碳酸钠的纯度
操作的名称是___________。
②方案2:称量样品,并使其充分加热,冷却至室温,再称量固体质量为。则样品中碳酸钠纯度___________(用代数式表示)。
(7)①金属镁在氮气中燃烧的产物与水反应,生成白色沉淀和一种气体(该气体可作为联合制碱法的原料),该反应的化学方程式为___________。
②过氧化钙()是一种新型水产养殖增氧剂,常用于鲜活水产品的运输。实验室可用钙盐制取,再经脱水制得不溶于水,在0℃时稳定,加热至130℃时变为无水,其制备如图:
Ⅰ.“沉淀”时反应温度不能过高的原因:①防止氨水挥发;②___________;
Ⅱ.“沉淀”时发生的反应用化学方程式表示为:___________。
(8)取一定浓度的溶液,通入一定量的气体,随后取溶液,加水稀释到。向稀释后的溶液中逐滴加入的盐酸,产生气体的体积(标准状况)与所加入的盐酸的体积之间的关系如图所示。回答下列问题:
Ⅰ.通入一定量的气体后溶液溶质为___________(写化学式),其物质的量之比是___________;
Ⅱ.V(HCl)=75mL时生成(标准状况下)气体的体积为___________;
Ⅲ.原溶液的物质的量浓度为___________。
(9)工业上“侯氏制碱法”以、、及水等为原料制备纯碱,其反应原理为:。生产纯碱的工艺流程如图:
若制得的纯碱中只含有杂质。测定该纯碱的纯度,下列方案中可行的是_________(填字母)。
A.向克纯碱样品中加入足量溶液,沉淀经过滤、洗涤、干燥,称其质量为
B.向克纯碱样品中加入足量稀盐酸,用碱石灰吸收产生的气体,碱石灰增重
C.向克纯碱样品中加入足量溶液,产生沉淀经过滤、洗涤、干燥,称其质量为
(10)为确定某和混合物样品的组成,称取3份该样品溶于水后分别逐滴加入相同浓度盐酸,充分反应,产生的体积如下表(已折算成标准状况下的体积,不考虑在水中的溶解),请回答下列问题:
①实验溶液蒸干灼烧后所得固体为___________(填化学式)。
②样品中物质的量之比___________。
③盐酸的物质的量浓度是___________。
17. 高中化学学科核心素养要求进行科学探究。现对二氧化硫的性质进行深入探究。
I.实验、类比、推理是化学学习的重要方法。某课外活动小组根据与的反应,用如图所示装置探究与的反应,并探究其产物成分。(已知:与水蒸气在加热时会发生反应)
(1)装置B的作用之一是观察的生成速率,为保证实验的严谨性其中的液体最好选择___________(填序号)
a.饱和溶液 b.饱和溶液
c.饱和溶液 d.浓硫酸
(2)依据与的反应,三位同学对与反应的产物提出不同假设,并将装置中玻璃管内固体产物加入如下图所示的装置中大试管,进一步设计实验探究与反应的产物,若固体产物只有两种,依据充分反应后的现象,完成下列表格:
为进一步验证假设③中存在,可将中试剂换成___________。(填试剂的化学式)
II.某兴趣小组欲探究与的反应。
(3)甲为了确认现象II中白色沉淀的成分,进行如下探究。查阅资料:
并进行如下实验:
①试剂是___________。
②现象II中生成白色沉淀的离子方程式是___________。
(4)乙认为实验存在干扰,欲探究纯净的悬浊液与的反应。
①乙过滤I中的蓝色沉淀,洗涤,取最后一次洗涤液于试管中,___________(填操作和现象),证明已洗涤干净。再进行如下实验:
②乙预测产物是,取砖红色沉淀,洗涤后,___________(填操作和现象),证明产物是。
(5)纯净的悬浊液与发生反应的化学方程式是___________。选项
实验操作和现象
实验结论
A
用计分别测量和溶液的
较大的是溶液
B
将浓硫酸加入到蔗糖中,并不断搅拌,固体由白色变为黑色海绵状,并有刺激性气味气体放出
浓硫酸具有脱水性、强氧化性
C
向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成
该溶液中一定含有
D
取久置的粉末,向其中滴加过量的稀盐酸,产生无色气体
没有变质
实验序号
A
B
C
[盐酸]
100.0
100.0
100.0
(样品)
3.80
7.60
11.40
896
1344
896
假设
中现象
中现象
①___________和
固体不完全溶解,无气泡产生
溶液不褪色
②___________和
固体不完全溶解,且有气泡产生
溶液褪色
③和
固体完全溶解,且有气泡产生
___________
实验步骤
现象
步骤1:打开分液漏斗,向烧瓶中加入溶液
I.有蓝色絮状沉淀,静置后分层。
步骤2:从左侧导管通入气体
II.静置后分层,底部有白色沉淀
物质
溶解性
不溶于水,浅黄色沉淀
不溶于水,白色沉淀
不溶于水,砖红色沉淀
性质
与酸反应
能溶于浓盐酸
酸性体系中不稳定,进一步反应生成Cu和
实验
实验步骤
现象
纯净的悬浊液
从左侧导管通入气体
III.静置后分层,上层溶液为蓝色,底部有砖红色沉淀
江苏省常熟中学2022-2023学年高一下学期6月学业质量阳光指标调研化学试卷: 这是一份江苏省常熟中学2022-2023学年高一下学期6月学业质量阳光指标调研化学试卷,共8页。
江苏省苏州市2022-2023学年高一下学期期末学业质量阳光指标调研卷化学试题(原卷版+解析版): 这是一份江苏省苏州市2022-2023学年高一下学期期末学业质量阳光指标调研卷化学试题(原卷版+解析版),共33页。试卷主要包含了5 Fe-56等内容,欢迎下载使用。
江苏苏州2022-2023学年高一下学期学业质量阳光指标调研卷化学试题(解析版): 这是一份江苏苏州2022-2023学年高一下学期学业质量阳光指标调研卷化学试题(解析版),共19页。












