

福建省厦门第一中学2023-2024学年高二上学期12月月考化学试卷(Word版附答案)
展开高二年化学试卷
命题:钱微达、陈辉明、潘书恒 审核:谢琼、武衍杰 2023.12
说明:1.完成时间75分钟
2.可能用到的相对原子质量:H-1 C-12 O-16 Na-23 S-32 C-59
一.单项选择题(共10题,每题4分,共40分.每题只有一个选项符合题意)
1.下列图示及描述都正确的是( )
2.下列化学用语正确的是( )
A.溶液呈碱性因为:
B.过量通入饱和溶液中:
C.饱和溶液与饱和溶液混合:
D.通入溶液中:
3.为阿伏加德罗常数的值,下列说法正确的是( )
A.12g中含有阳离子数目为
B.1L的盐酸含有阴离子数目为
C.室温下1L的浓氨水中的数目为
D.向1L溶液通至中性,数目为
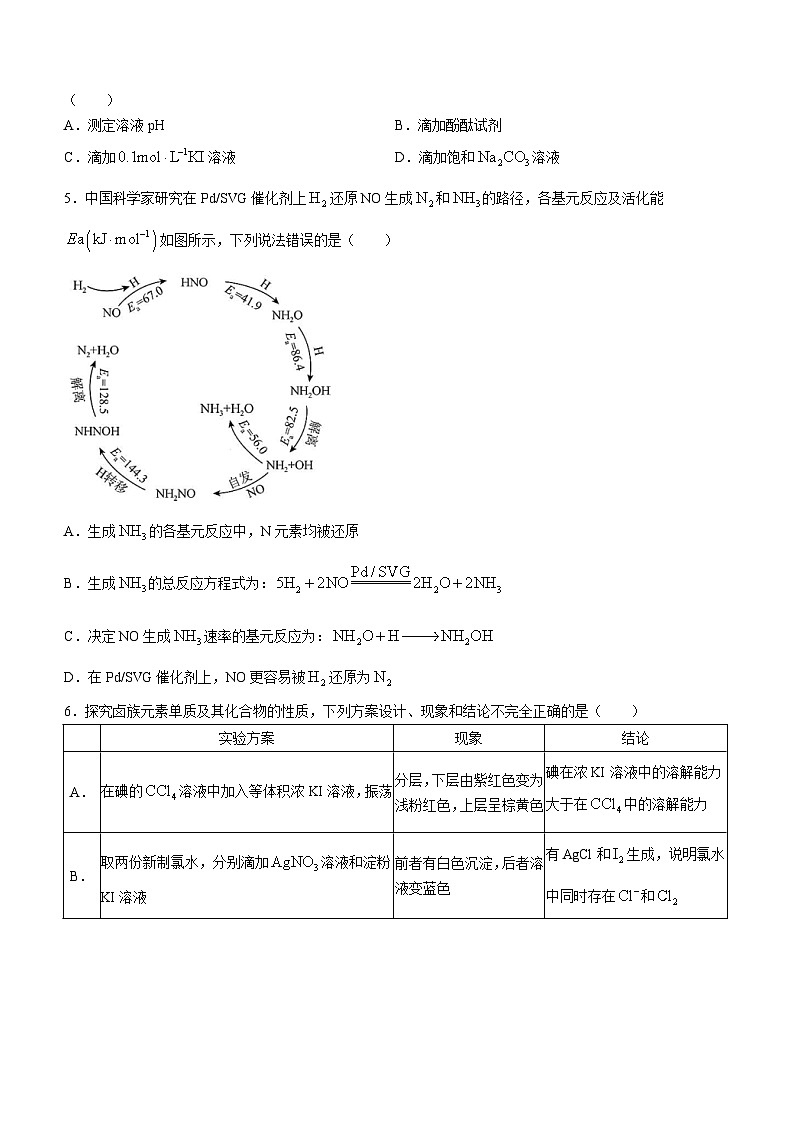
4.鉴别浓度均为的NaClO、、三种溶液,仅用下列一种方法不可行的是( )
A.测定溶液pHB.滴加酚酞试剂
C.滴加溶液D.滴加饱和溶液
5.中国科学家研究在Pd/SVG催化剂上还原NO生成和的路径,各基元反应及活化能如图所示,下列说法错误的是( )
A.生成的各基元反应中,N元素均被还原
B.生成的总反应方程式为:
C.决定NO生成速率的基元反应为:
D.在Pd/SVG催化剂上,NO更容易被还原为
6.探究卤族元素单质及其化合物的性质,下列方案设计、现象和结论不完全正确的是( )
7.25℃时,苯酚()的,下列说法正确的是( )
A.相同温度下,等pH的和溶液中,
B.将浓度均为的和NaOH溶液加热,两种溶液的pH均变大
C.25℃时,溶液与NaOH溶液混合,测得,则此时溶液中
D.25℃时,的溶液中加少量固体,水的电离程度变小
8.一种捕集烟气中的过程如图所示.室温下以KOH溶液吸收,若通入所引起的溶液体积变化和挥发可忽略,溶液中含碳物种的浓度.电离常数分别为、.下列说法正确的是( )
A.KOH吸收所得到的溶液中:
B.KOH完全转化为时,溶液中:
C.KOH溶液吸收,溶液中:
D.如图所示的“吸收”“转化”过程中,溶液的温度下降
9.设计如图装置回收金属钴.保持细菌所在环境pH稳定,借助其降解乙酸盐生成,将废旧锂离子电池的正极材料转化为,工作时保持厌氧环境,并定时将乙室溶液转移至甲室.已知电极材料均为石墨材质,右侧装置为原电池.下列说法正确的是( )
A.装置工作一段时间后,乙室应补充盐酸
B.装置工作时,甲室溶液pH逐渐增大
C.乙室电极反应式为
D.若甲室减少200mg,乙室增加400mg,则此时已进行过溶液转移
10.常温下,将浓度为的NaOH溶液滴入浓度均为的HCl和的混合溶液,溶液的pH随的变化曲线如图所示.下列说法错误的是( )
A.约为
B.点a:
C.点b:
D.水的电离程度:
二.填空题(共4题,共60分)
11.(12分)
(1)当水的离子积时,的溶液呈______性.
(2)pH相等的盐酸和醋酸溶液等体积混合,混合液中______.(填“>”“<”或“=”)
(3)体积和浓度均相等的NaOH溶液和氨水,分别稀释m倍和n倍,至pH均为9,则m______n.(填“>”“<”或“=”)
(4)一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图,醋酸电离程度最大的是______点;用湿润的pH试纸测量a处溶液的pH,测量结果______.(填“偏大”“偏小”或“无影响”)
(5)室温下的和NaOH两种溶液中,由水电离出的的比值为______.
(6)已知.某废水处理过程中始终保持饱和,即,通过调节pH使和形成硫化物而分离,体系中pH与关系如下,c为、、和的浓度,单位为.则______.
12.(15分)
某化学小组对溶液与溶液的反应进行探究.
(一)配制溶液
(1)配制溶液前需检验固体是否变质,其操作方法为:取少量样品于试管中,加适量蒸馏水溶解,再加入______,若无白色沉淀生成,则未变质.
(2)用离子方程式结合适当文字解释:配制氯化铁溶液时,先将氯化铁固体溶于稀盐酸,再稀释到所需浓度的原因______.
(二)预测实验
(3)该小组同学预测溶液与溶液混合时,溶液颜色由棕黄色变成浅绿色,他们预测的依据为(用离子方程式表示):______.
(三)实施实验
向2mL溶液中逐滴加入0.5mL溶液
(4)查阅资料:溶液中、、三种微粒会形成红色物质并存在如下转化:
①用离子方程式解释0~1min的实验现象______.
②从反应速率和化学平衡两个角度解释1~30min的实验现象______.
(5)小组同学认为没有观察到预期的实验现象,是因为混合产生气体的反应干扰了氧化还原反应的发生,该同学通过如下实验证明了猜想的正确性.已知铁氰化钾溶液可与反应生成蓝色沉淀.
①分析实验Ⅰ中电流计指针不偏转(没有形成原电池)的原因是______.
②实验Ⅱ中右侧烧杯发生的电极反应式为______.
13.(16分)
某空间站利用萨巴蒂尔反应:,配合水的电解实现氧气再生的流程简图如下.
(1)已知:电解液态水制备1ml,电解反应的.
由此计算的摩尔燃烧焓______.
(2)已知:萨巴蒂尔反应的平衡常数(K)与反应温度(t)之间的关系如图.
①萨巴蒂尔反应在______(选填“高温”或“低温”)下能自发进行.
②某研究小组模拟该反应,温度t下,向容积为10L的密闭容器中通入0.1ml和0.4ml,反应平衡后测得容器中.则的转化率为______,反应温度t约为______℃.
(3)在相同条件下,与还会发生不利于氧循环的副反应:
,在反应器中按通入反应物
在不同温度、不同催化剂条件下,反应进行到2min时,测得反应器中、浓度如表.
若选用催化剂Ⅰ,在350℃条件下反应,0~2min生成的平均反应速率为______;结合表格信息分析,从提高循环系统制氧效率的角度,
反应器的最佳反应条件应选择催化剂______(填“Ⅰ”或“Ⅱ”)和______.
(4)令代替萨巴蒂尔反应,虽可实现氢、氧元素完全循环利用,但使用一段时间后催化剂的催化效果会明显下降,其原因是______.
(5)“富集装置”可利用电化学法富集空间站内“空气”中的作为萨巴蒂尔反应器的原料气之一,装置如右图.a极为______极(填“正”或“负”),b电极上发生的电极反应为______.
14.(17分)
以银锰精矿(主分、MnS、)和氧化锰矿(主分)为原料联合提取银和锰的某流程如图.
已知:酸性条件下,的氧化性强于.
(1)“浸锰”过程利用溶液浸出矿石中的锰元素,同时去除,使银元素以的形式残留于浸锰渣中,以利于后续银的浸出.
①浸锰液中主要的金属阳离子有______.
②能浸出矿石中的锰元素,发生反应的平衡常数K值为______,不能溶解于残留于浸锰渣中,可推断:______(填“>”或“>”).
常温下,和MnS相应的平衡常数如表.
(2)“浸银”时,使用过量、HCl和的混合液作为浸出剂,将中的银以形式浸出.
①将“浸银”反应的离子方程式补充完整:
②结合平衡移动原理,解释浸出剂中、的作用.
:______,
:______.
(3)“沉银”过程中需要过量的铁粉作为还原剂.
①该步反应的离子方程式有______、______.
②一定温度下,Ag的沉淀率随反应时间的变化如图所示.
解释t分钟后Ag的沉淀率逐渐减小的原因:______.
(4)结合“浸锰”过程,从两种矿石中各物质利用的角度,分析联合提取银和锰的优势有:
①可将两种矿石中的锰元素同时提取到浸锰液中,得到,同时将银元素和锰元素分离开;
②______.
化学12月考参考答案
1~5.ABCCD6~10.BCCAD
11.(12分)
(1)碱(2分) (2)=(2分) (3)>(2分) (4)c(1分) 偏小(1分)
(5)(2分) (6)(2分)
12.(15分)
(1)过量盐酸酸化的氯化钡溶液(1分)
(2),稀盐酸抑制铁离子的水解(3分)
(3)(2分)
(4)①(2分)
②生成红色物质的反应速率快,红色物质生成橙色物质的速率较慢;在的作用下,橙色的浓度下降,平衡不断正向移动,最终溶液几乎无色(3分)
(5)①浓度低,氧化性不足,该条件下无法与溶液发生氧化还原反应(2分)
②(2分)
13.(16分)
(1)―286(2分)
(2)①低温(1分) ②50%或0.5(2分) 660.2(或660.1或660.3,其他答案酌情给分)(2分)
(3)5.4(2分) Ⅱ(1分) 400℃(1分)
(4)生成的碳颗粒附着在催化剂表面,使反应位点减少(或生成的碳颗粒使催化剂中毒)(2分)
(5)正极(1分) (2分)
14.(17分)
(1)①、(2分) ②(2分) <(1分)
(2)①(2分)
②与电离出的结合生成,使平衡正向移动,提高的浸出率;(1分)
抑制水解,防止生成沉淀.(1分)
(3)①(2分)
或(2分)
②被氧气氧化为,把Ag氧化为(2分)
(4)“浸锰”生成的可以用于浸银,节约氧化剂(2分)A.牺牲阳极的阴极保护法
B.纯碱溶液的保存
C.颜色加深说明平衡逆移
D.去除壶中的水垢
实验方案
现象
结论
A.
在碘的溶液中加入等体积浓KI溶液,振荡
分层,下层由紫红色变为浅粉红色,上层呈棕黄色
碘在浓KI溶液中的溶解能力大于在中的溶解能力
B.
取两份新制氯水,分别滴加溶液和淀粉KI溶液
前者有白色沉淀,后者溶液变蓝色
有AgCl和生成,说明氯水中同时存在和
C
向2mLNaCl溶液中加入2滴溶液,振荡后加入4滴KI溶液
先产生的白色沉淀,
再产生黄色沉淀
AgCl转化为AgI,该实验条件下,AgI溶解度小于AgCl
D.
向2mLKI溶液中加入1mL溶液,充分反应.取样于试管I,加入几滴KSCN溶液;另取样于试管Ⅱ,加入几滴淀粉溶液.
试管Ⅰ溶液变红,
试管Ⅱ溶液变蓝
和的氧化还原反应存在限度
装置
反应时间
实验现象
0~1min
产生红褐色沉淀,有刺激性气味气体逸出
1~30min
沉淀迅速溶解形成红色溶液,随后溶液逐渐变为橙色,之后几乎无色
30min后
与空气接触部分的上层溶液又变为浅红色,随后逐渐变为浅橙色
装置
实验步骤
操作
实验现象
Ⅰ
向烧杯中装好溶液、连接好装置、闭合开关
灵敏电流表指针未发生偏转
Ⅱ
向左侧烧杯中滴加少量饱和溶液
灵敏电流表指针向左侧偏转
Ⅲ
向左侧烧杯中再滴加少量铁氰化钾溶液
左侧烧杯中产生蓝色沉淀,灵敏电流表指针向左侧偏转幅度更大
催化剂
催化剂Ⅰ
10.8
12722
345.2
42780
催化剂Ⅱ
9.2
10775
34
38932
MnS
;
福建省厦门第一中学2023-2024学年高一上学期12月月考化学试题(Word版附解析): 这是一份福建省厦门第一中学2023-2024学年高一上学期12月月考化学试题(Word版附解析),共19页。试卷主要包含了5 Fe-56, 某酸性废水中含有大量的、、、, 下列实验操作能达到实验目的是等内容,欢迎下载使用。
福建省厦门大学附属实验中学2023-2024学年高一上学期第二次月考化学试卷(Word版附答案): 这是一份福建省厦门大学附属实验中学2023-2024学年高一上学期第二次月考化学试卷(Word版附答案),共9页。试卷主要包含了金属钠制取氧化钠通常利用反应等内容,欢迎下载使用。
福建省厦门市第一中学2023-2024学年高三上学期第二次月考化学试卷(Word版附答案): 这是一份福建省厦门市第一中学2023-2024学年高三上学期第二次月考化学试卷(Word版附答案),共10页。试卷主要包含了可能用到的相对原子质量,为阿伏加德罗常数的值,配合物等内容,欢迎下载使用。












