




第37讲 物质的分离和提纯-备战2024年高考化学一轮复习精品课件(全国通用)
展开考点 1 物质分离、提纯常用的物理方法
1.物质分离、提纯的区别(1)物质的分离。 将混合物的各组分分离开来,获得几种纯净物的过程。(2)物质的提纯。 将混合物中的杂质除去而得到纯净物的过程,又叫物质的净化或除杂。
2.物质分离、提纯的物理方法
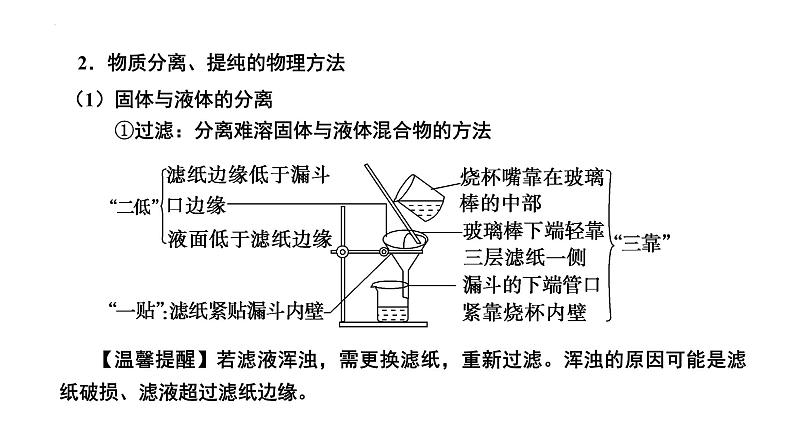
(1)固体与液体的分离 ①过滤:分离难溶固体与液体混合物的方法
【温馨提醒】若滤液浑浊,需更换滤纸,重新过滤。浑浊的原因可能是滤纸破损、滤液超过滤纸边缘。
过滤操作中的常考热点案例
在过滤操作后,有时需要滤渣,舍弃滤液;有时需要滤液,舍弃滤渣。 (1)需要滤液时,如何提取母液中的成分 【案例1】在粗盐的提纯实验中,过滤,舍去不溶性杂质(滤渣)后,怎样从母液中获取NaCl固体? 【提示】加热蒸发,当析出大量NaCl晶体时,停止加热,利用余热蒸干。 【案例2】若母液是CuSO4饱和溶液,怎样获得CuSO4·5H2O晶体? 【提示】蒸发浓缩,冷却结晶,过滤。
(2)需要滤渣时,如何得到纯净的滤渣 【案例3】在测定Na2SO4和NaCl的混合物中Na2SO4的质量分数时,可以在混合物中加入过量BaCl2溶液,沉淀SO42-,然后过滤、洗涤、烘干、称量得到BaSO4的质量,试问: ①怎样判断SO42-是否沉淀完全? 【提示】取上层清液少许于试管中,再加入BaCl2溶液,若产生白色沉淀,说明SO42-未沉淀完全,反之则沉淀完全。 ②过滤完毕后,为什么要洗涤沉淀(即洗涤沉淀的目的)? 【提示】洗去可溶性杂质(Na+、Cl-等)。 ③沉淀的洗涤方法? 【提示】沿玻璃棒向漏斗中加蒸馏水至浸没沉淀,待水自然流下后,再重复2~3次。 ④怎样判断沉淀是否洗净? 【提示】取最后一次洗涤液少许于试管中,滴加稀HNO3酸化的AgNO3溶液,若产生白色沉淀,说明沉淀未洗净,反之已洗净。
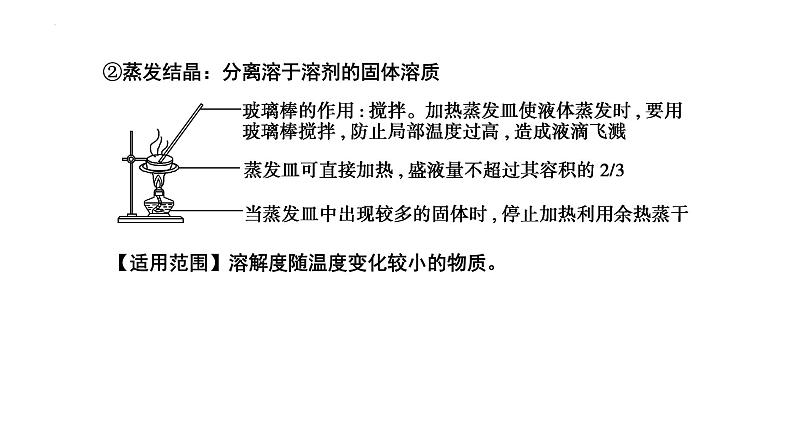
②蒸发结晶:分离溶于溶剂的固体溶质
【适用范围】溶解度随温度变化较小的物质。
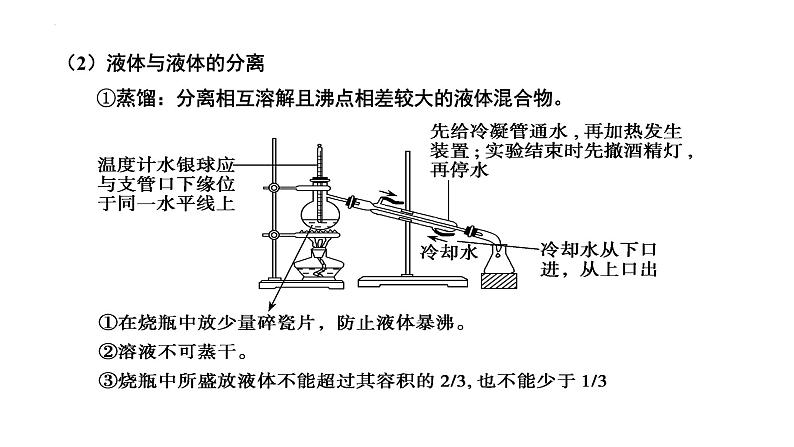
(2)液体与液体的分离 ①蒸馏:分离相互溶解且沸点相差较大的液体混合物。
②萃取(分液):利用物质在互不相溶的溶剂里溶解度的不同,用一种溶剂把物质从它与另一种溶剂所组成的溶液里提取出来的方法。 *萃取剂的选择原则: a.与原溶剂互不相溶,更不能与溶质和原溶剂反应; b.溶质在萃取剂中的溶解度远大于在原溶剂中的溶解度。
【注意事项】 a.将要萃取的溶液和萃取剂依次从上口倒入分液漏斗,其量不能超过漏斗容积的2/3,塞好塞子进行振荡。 b.振荡时右手捏住漏斗上口的颈部,并用食指根部压紧塞子,用左手握住旋塞,同时用手指控制活塞,将漏斗倒转过来用力振荡。 c.分液时下层液体从下口放出,上层液体从上口倒出。
(3)固体与固体的分离
(3)液体与液体的分离洗气:除去气体中的杂质气体。注意事项:长管进气短管出气。
物质分离提纯操作要领简答——规范答题 (1)从含有少量KNO3杂质的氯化钠溶液中分离出氯化钠固体的操作:____________________、洗涤、干燥。 (2)从MgSO4溶液中得到MgSO4固体的实验操作包括__________、冷却结晶、_______、洗涤、干燥等一系列操作,在此过程中玻璃棒的作用是________(填序号)。 ①引流;②搅拌加速溶解;③搅拌使溶液受热均匀,防止暴沸 (3)分液时,分液漏斗中的液体很难滴下,可能的原因是______________________________________________________________________________________________________________________。
没有打开分液漏斗颈上的玻璃塞(或玻璃塞上的凹槽没有与漏斗上的小孔对齐)
1.判断正误(正确的打“√”,错误的打“×”)
(1)分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 ( )(2)蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 ( )(3)蒸馏中,冷却水应从冷凝管的下口通入,上口流出 ( )(4)蒸发操作时,应使混合物中的水分完全蒸干后,再停止加热 ( )(5)用乙醇萃取出溴水中的溴,再用蒸馏的方法分离溴与乙醇 ( )(6)分液时先打开分液漏斗上口的塞子,再将下层液体缓缓放入下面的烧杯中( )(7)制取无水乙醇可向乙醇中加入CaO之后过滤 ( )
2.下列实验中,所选装置不合理的是( )
A.分离Na2CO3溶液和CH3COOC2H5,选④B.用CCl4提取碘水中的碘,选③C.用FeCl2溶液吸收Cl2,选⑤D.粗盐提纯,选①和②
考点 2 物质分离、提纯的化学方法
除去下列常见物质中的杂质。请完成表格:
(1)SO2中混有少量SO3,可以将混合气体通过浓硫酸除去 ( )(2)通过灼热的CuO除去H2中的CO ( )(3)乙烯中混有的SO2可以通过溴水除去 ( )(4)除去BaCO3固体中混有的BaSO4:加过量盐酸后,过滤洗涤 ( )(5)向MgCl2溶液中加入CaCO3粉末,充分搅拌后过滤可除去杂质FeCl3 ( )(6)除去NaCl溶液中少量的Na2S:加入AgCl后再过滤 ( )
2.下列除杂方案正确的是( )
【归纳整合】除杂的原则和注意事项(1)除杂“四原则” ①不增,不得引入新杂质; ②不减,尽量不减少被提纯和分离的物质; ③易分离,应使被提纯或分离的物质与其他物质易分离; ④易复原,被提纯物质转化后要易被复原。(2)除杂操作“四注意” ①除杂试剂要过量; ②过量试剂需除去; ③选择的途径要最佳; ④除去多种杂质时要考虑加入试剂的先后顺序。
1.(2020·新高考山东卷)实验室分离Fe3+和Al3+的流程如下: 已知Fe3+在浓盐酸中生成黄色配离子[FeCl4]-,该配离子在乙醚(Et2O,沸点34.6 ℃)中生成缔合物Et2O·H+·[FeCl4]-。下列说法错误的是( ) A.萃取振荡时,分液漏斗下口应倾斜向下 B.分液时,应先将下层液体由分液漏斗下口放出 C.分液后水相为无色,说明已达到分离目的 D.蒸馏时选用直形冷凝管
2.(2018·高考全国卷Ⅰ)在生成和纯化乙酸乙酯的实验过程中,下列操作未涉及的是( )
3.(2019·高考全国卷Ⅱ)咖啡因是一种生物碱(易溶于水及乙醇,熔点234.5 ℃,100 ℃以上开始升华),有兴奋大脑神经和利尿等作用。茶叶中含咖啡因约1%~5%、单宁酸(Ka约为10-6,易溶于水及乙醇)约3%~10%,还含有色素、纤维素等。实验室从茶叶中提取咖啡因的流程如图所示。
索氏提取装置如图所示。实验时烧瓶中溶剂受热蒸发,蒸汽沿蒸汽导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,与茶叶末接触,进行萃取。萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现对茶叶末的连续萃取。回答下列问题:
第44讲 烃和卤代烃-备战2024年高考化学一轮复习精品课件(全国通用): 这是一份第44讲 烃和卤代烃-备战2024年高考化学一轮复习精品课件(全国通用),共29页。PPT课件主要包含了CnH2nn≥2,1通式,2结构,烯烃的顺反异构,强碱强氧化剂,2烯烃-乙烯,酸性KMnO4溶液,溴水褪色,2加成,4加成等内容,欢迎下载使用。
第39讲 化学实验热点(一)-备战2024年高考化学一轮复习精品课件(全国通用): 这是一份第39讲 化学实验热点(一)-备战2024年高考化学一轮复习精品课件(全国通用),共25页。PPT课件主要包含了物质制备流程,实验操作流程,操作先后流程,浓H2SO4,排尽装置中的空气,思维流程,浓硫酸,碱石灰,80%,把握制备过程等内容,欢迎下载使用。
第23讲 电解原理-备战2024年高考化学一轮复习精品课件(全国通用): 这是一份第23讲 电解原理-备战2024年高考化学一轮复习精品课件(全国通用),共17页。PPT课件主要包含了考点1电解原理,还原反应,氧化反应,阳离子,阴离子,OH->SO42ˉ,H+<Cu2+,电极反应式的书写,2电解电解质型,加CuCl2固体等内容,欢迎下载使用。












