
高中化学人教版 (2019)选择性必修2第一节 共价键精品课时训练
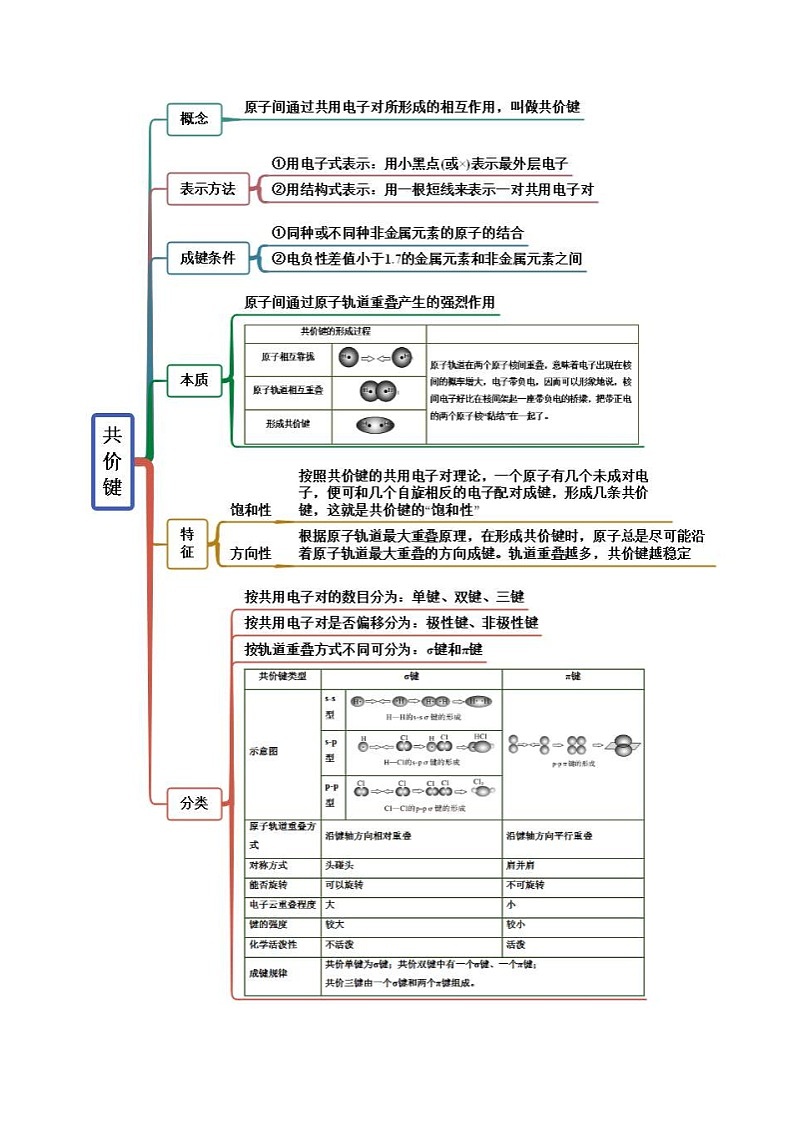
展开考点一 共价键的形成与特征
【例1-1】(2021·全国·高一课时练习)在共价化合物中,化合价有正负的原因是
A.有金属元素存在
B.有电子得失
C.有共用电子对偏移
D.既有电子得失,又有共用电子对偏移
【答案】C
【解析】共价化合物中,以共用电子对形成化学键,但原子吸引电子对的能力不同,共用电子对发生偏移,则元素的化合价有正负,而不存在电子得失及金属元素的问题。故选C。
【例1-2】(2022陕西)下列说法正确的是
①共价键的特征是具有饱和性和方向性
②共价化合物中一定含共价键,一定不含离子键
③ SKIPIF 1 < 0 的非直线结构是由共价键的饱和性决定的
④分子中不一定存在共价键
⑤烯烃比烷烃的化学性质活泼是由于烷烃中的 SKIPIF 1 < 0 键比烯烃中的 SKIPIF 1 < 0 键稳定
A.①②④B.④⑤C.②③④D.①③⑤
【答案】A
【解析】①因为原子的未成对电子一旦配对成键,就不再与其他原子的未成对电子配对成键了,这是共价键的饱和性,形成共价键时,原子轨道重叠的程度越大越稳定,为了达到原子轨道的最大重叠程度,成键的方向与原子轨道的伸展方向一致,这是共价键的方向性,则共价键的特征是具有饱和性和方向性,故①正确;
②含有离子键的化合物为离子化合物,所以共价化合物中不含离子键,一定含共价键,故②正确;
③ SKIPIF 1 < 0 的非直线结构是由共价键的方向性决定的,故③错误;
④稀有气体分子是单原子分子,稀有气体分子中没有共价键,故④正确;
⑤烯烃比烷烃活泼是因为烯烃中的π键键能小,容易断裂,比较活泼,故⑤错误;
由上分析,①②④正确;答案为A。
【一隅三反】
1.(2022江苏)下列关于化合物的说法正确的是
A.只含有共价键的物质一定是共价化合物
B.由两种原子组成的纯净物一定是化合物
C.共价化合物熔化时破坏共价键
D.熔融状态下不导电的化合物一定是共价化合物
【答案】D
【解析】A.只含有共价键的物质也可能是单质,A错误;
B.由两种原子组成的纯净物也可能是单质,如HD,B错误;
C.大部分共价化合物熔化时不破坏共价键,如冰融化破坏分子间作用力,C错误;
D.熔融状态下不导电的化合物一定是共价化合物,D正确;故选D。
2.(2022重庆)下列关于共价键的叙述中,不正确的是
A.由不同元素的原子形成的共价键一定是极性键
B.由同种元素的两个原子形成的双原子分子中的共价键一定是非极性键
C.化合物中不可能含有非极性键
D.当氧原子与氟原子形成共价键时,共用电子偏向氟原子一方
【答案】C
【解析】A.不同元素的原子吸引电子的能力不同,形成极性键,A正确;
B.同种元素的原子形成的双原子分子中,两原子吸引电子的能力相同,形成非极性键,B正确;
C.某些化合物中,如 SKIPIF 1 < 0 中均含有非极性键,C错误;
D.氟原子吸引电子的能力强于氧原子,二者成键时共用电子偏向氟原子,D正确;答案选C。
3(2021·全国·高二课时练习)共价键具有饱和性和方向性,下列有关叙述中,不正确的是
A.共价键的饱和性是由成键原子的未成对电子数决定的
B.共价键的方向性是由成键原子轨道的方向性决定的
C.共价键的方向性决定了分子的空间结构
D.所有共价键都具有方向性
【答案】D
【解析】A.一般地,原子的未成对电子一旦配对成键,就不再与其他原子的未成对电子配对成键,故成键原子的未成对电子数决定了该原子形成的共价键数量,即饱和性,A项正确;
B.形成共价键时,为了达到原子轨道的最大重叠程度,成键的方向与原子轨道的伸展方向就存在着必然的联系,则共价键的方向性是由成键原子轨道的方向性决定的,B项正确;
C.共价键的方向性决定了所形成分子的空间结构,C项正确;
D.由于s轨道是球形对称的,故两个s轨道重叠形成的共价键无方向性,D项错误;故本题选D。
考点二 共价键的类型
【例2-1】(2023吉林)下列有关σ键和π键的说法错误的是
A.在某些分子中,化学键可能只有π键而没有σ键
B.当原子形成分子时,首先形成σ键,可能形成π键
C.σ键的特征是轴对称,π键的特征是镜面对称
D.含有π键的分子在反应时,π键是化学反应的积极参与者
【答案】A
【解析】A.共价键中一定含σ键,则在分子中,化学键可能只有σ键,而没有π键,A错误;
B.原子形成分子,优先头碰头重叠,则先形成σ键,可能形成π键,B正确;
C.σ键是“头碰头”重叠形成,可沿键轴自由旋转,为轴对称;而π键是由两个p电子“肩并肩”重叠形成,重叠程度小,为镜像对称,C正确;
D.π键不稳定,易断裂,则含有π键的分子在反应时,π键是化学反应的积极参与者,D正确;
故选A。
【例2-2】(2022秋·广东广州·高二执信中学校考期中)下列分子中含π键的是
A.CH4B.C2H4C.C2H5ClD.CH3CH2OH
【答案】B
【解析】A.甲烷只含C﹣H键,均为σ键,选项A错误;
B.乙烯含碳碳双键,含1个σ键和1个π键,选项B正确;
C.氯乙烷中含C﹣C键、C﹣H键、C﹣Cl键,均为σ键,选项C错误;
D.乙醇中含C﹣C键、C﹣H键、C﹣O键、O﹣H键,均为σ键,选项D错误;
答案选B。
【一隅三反】
1.(2023·天津南开·高二天津市天津中学校考期末)下列分子中既含有 SKIPIF 1 < 0 键又含有 SKIPIF 1 < 0 键的是
① SKIPIF 1 < 0 ② SKIPIF 1 < 0 ③ SKIPIF 1 < 0 ④ SKIPIF 1 < 0 ⑤ SKIPIF 1 < 0
A.①②③B.④⑤C.③⑤D.①③⑤
【答案】C
【解析】①H2中只有1个σ键;②H2O中只有2个σ键;③N2的结构式为N SKIPIF 1 < 0 N,含1个σ键和2个π键;④CH2Cl2是二氯甲烷,可以看做是甲烷中的两个氢原子被两个氯原子取代,只有单键,则只有σ键;⑤C2H2的结构式为H-C SKIPIF 1 < 0 C-H,含有单键和三键,则既有σ键,又有π键,所以③⑤中既有σ 键又含有 π 键,故答案选C。
2.(2023河北邢台·高二邢台市第二中学校考期末)下列关于σ键和π键的说法中错误的是
A.s -sσ键与s-pσ键的电子云形状的对称性相同
B.所有的σ键的强度都比π键的大
C.H原子只能形成σ键而O原子可以形成σ键和π键
D.在 H2O2 中只有σ键没有π键
【答案】B
【解析】A.s能级电子云是球形,p能级电子云是哑铃形,但s -sσ键与s-pσ键的对称性相同,均为轴对称,A正确;
B.在N2中,σ键的强度比π键的小,B错误;
C.氢原子的s轨道只能形成头碰头的σ键,氧原子的p轨道可以形成头碰头的σ键和肩并肩的π键,C正确;
D.H2O2分子中只有单键,则只有σ键没有π键,D正确;
故选B。
3.(2021·高二课时练习)下列分子中存在 SKIPIF 1 < 0 键的是
A. SKIPIF 1 < 0 B. SKIPIF 1 < 0 C. SKIPIF 1 < 0 D. SKIPIF 1 < 0
【答案】C
【解析】根据单键均为σ键,双键为一个σ键一个π键,三键为一个σ键2个π键,据此分析解题:
A.H2中只存在H-H单键,故不存在π键,A不符合题意;
B.NH3中只存在N-H单键,故不存在π键,B不符合题意;
C.N2中只存在N≡N三键,为一个σ键2个π键,C符合题意;
D.HCl中只存在H-Cl单键,故不存在π键,D不符合题意;
故选C。
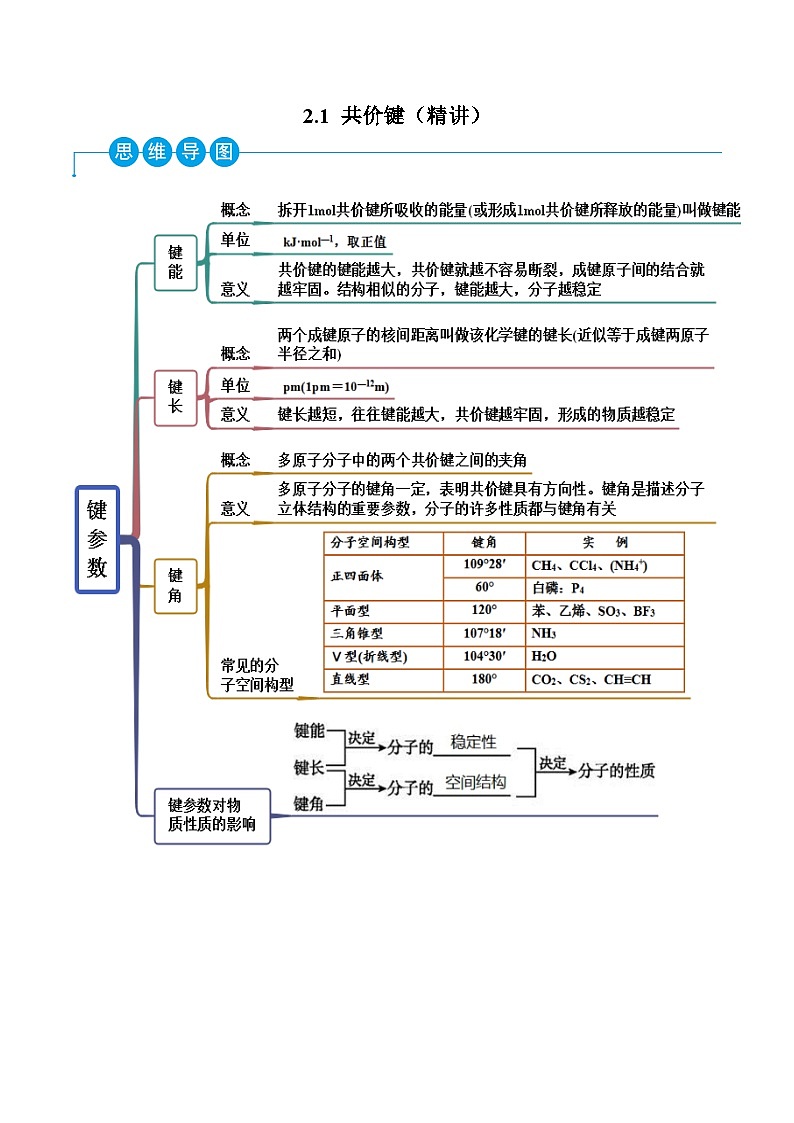
考点三 键参数及其应用
【例3-1】(2022天津)下列关于键长、键角和键能的说法中,不正确的是
A.键角是描述分子立体结构的重要参数
B.键长的大小与成键原子的半径和成键数目有关
C.键能越大,键长越长,共价化合物越稳定
D.键角的大小与键长、键能的大小无关
【答案】C
【解析】A.键角是描述分子立体结构的重要参数,如CO2中的2个C=O键的夹角为180 SKIPIF 1 < 0 ,故分子为直线形分子,A正确;
B.键长的大小与成键原子的半径有关,如Cl原子半径小于I原子半径,Cl-Cl键的键长小于I-I键的键长,此外,键长还和成键数目有关,成键数目越多,键长越短,B正确;
C.键能越大,键长越短,共价键越强,共价化合物越稳定,C错误;
D.键角的大小取决于成键原子轨道的夹角,与键长、键能的大小无关,D正确;
答案选C。
【例3-2】(2022山西)关于键长、键能和键角,下列说法中不正确的是
A.键角是描述分子立体结构的重要参数
B.键长的大小与成键原子的半径和成键数目有关
C.因为O-H键的键能小于H-F键的键能,所以O2、F2与H2反应的能力逐渐增强
D.C =C键的键能等于C-C键键能的2倍
【答案】D
【解析】A.键角分子中两个共价键之间的夹角,是描述分子立体结构的重要参数,故A正确;
B.影响键长的因素有:参与成键的原子半径、成键原子的周围环境,与成键原子的半径和成键数目有关,故B正确;
C.H-O键的键能小于H-F键的键能,则稳定性:HF>H2O,所以O2、F2与H2反应的能力逐渐增强,故C正确;
D.碳碳双键中一个是π键,一个是σ键,碳碳单键是σ键,C=C的键能小于C-C的键能的2倍,故D错误。
答案选D。
【例3-3】(2022秋·重庆沙坪坝·高二重庆一中校考期中)下列与键参数有关的说法中错误的是
A.键角: SKIPIF 1 < 0
B.键长: SKIPIF 1 < 0
C.键能: SKIPIF 1 < 0
D.结构相似的分子,共价键的键能越大,分子通常越稳定
【答案】A
【解析】A.CO2为直线型,键角为180°,CH4为正四面体型,键角为109°28’,H2O的中心原子形成2个σ键,O原子上的孤电子对数= SKIPIF 1 < 0 ,VSEPR模型为四面体型,NH3的中心原子形成3个键,N原子上的孤电子对数= SKIPIF 1 < 0 ,VSEPR模型为四面体型,因排斥力:孤电子对-孤电子对>孤电子对-成键电子对>成键电子对-成键电子对,因此键角 SKIPIF 1 < 0 ,故A项错误;
B.同周期元素从左至右原子半径逐渐减小,因此键长: SKIPIF 1 < 0 ,故B项正确;
C.同主族元素从上至下原子半径逐渐增大,因此键长: SKIPIF 1 < 0 ,而键长越短,键能越大,因此键能: SKIPIF 1 < 0 ,故C项正确;
D.结构相似的分子,共价键的键能越大,共价键越难断裂,分子通常越稳定,故D项正确;
综上所述,错误的是A项。
【一隅三反】
1.(2022春·陕西西安·高二统考期末)关于键长、键能和键角,下列说法不正确的是
A.键长越长,键能越大,共价化合物越稳定
B.通过反应物和生成物分子中键能数据可以粗略预测反应热的大小
C.键角是确定多分子立体结构的重要参数
D.同种原子间形成的共价键键长:三键<双键<单键
【答案】A
【解析】A.键长越长,键能越小,共价化合物越不稳定,键能越大,键长越短,共价化合物越稳定,故A错误;
B.反应热=反应物的总键能-生成物的总键能,则通过反应物和生成物分子中键能数据可以粗略预测反应热的大小,故B正确;
C.键长和键角常被用来描述分子的空间构型,键角是描述分子立体结构的重要参数,故C正确;
D.原子间键能越大,核间距越小,键长越短,键能的一般关系为:三键>双键>单键,则键长:三键<双键<单键,故D正确;
故答案选 A。
2.(2022·全国·高三专题练习)关于键长、键能和键角,下列说法中错误的是
A.C=C键等于C-C键键能的2倍
B.键长的大小与成键原子的半径和成键数目有关
C.键角是描述分子立体结构的重要参数
D.因为O-H键的键能小于H-F键的键能,所以O2、F2与H2反应的能力逐渐增强
【答案】A
【解析】A.碳碳双键中一个是π键,一个是σ键,碳碳单键是σ键,π键的强度一般小于σ键,所以C=C键小于C-C键键能的2倍,A错误;
B.影响键长的因素有:参与成键的原子半径、成键原子的周围环境,即与成键原子的半径和成键数目有关,B正确;
C.键角是描述分子立体结构的重要参数,是描述分子立体结构的重要参数,C正确;
D.H-O键的键能小于H-F键的键能,则稳定性:HF>H2O,则F2与H2更容易反应,即O2、F2与H2反应的能力逐渐增强,D正确;
综上所述答案为A。
3.(2022春·甘肃兰州·高二兰州一中校考阶段练习)键长、键角和键能是描述共价键的三个重要参数,下列叙述错误的是
A.键能是衡量化学键稳定性的参数之一,键能越大,则化学键就越牢固
B.键长与共价键的稳定性没有关系
C.键角是描述分子空间结构的重要参数
D.一般来说,原子半径越小的原子形成的共价键键长越短
【答案】B
【解析】A.键能指气态基态原子形成1ml化学键释放的最低能量,键能越大,意味着化学键越稳定,越不容易被打断,A正确;
B.键长是形成共价键的两个原子之间的核间距,键长越短,往往键能越大,共价键越稳定,B错误;
C.当物质分子内有多个化学键时,化学键之间的夹角叫键角,它反映了分子内原子的空间分布情况,因此键角是描述分子空间结构的重要参数,C正确;
D.共价键的键长是指成键原子之间的核间距,一般来说, 原子半径越小的原子形成的共价键键长越短,D正确;
故选B。
4.(2022春·河南平顶山·高二校考期中)下列有关共价键的键参数的说法不正确的是
A. SKIPIF 1 < 0 、 SKIPIF 1 < 0 、 SKIPIF 1 < 0 分子中的键角依次增大
B.HF、HCl、HBr分子中的键长依次增长
C. SKIPIF 1 < 0 、 SKIPIF 1 < 0 、 SKIPIF 1 < 0 分子中的键能依次减小
D.分子中共价键的键能越大,分子稳定性越差
【答案】D
【解析】A. SKIPIF 1 < 0 、 SKIPIF 1 < 0 、 SKIPIF 1 < 0 分子的立体构型分别为正四面体、平面形和直线形,所以键角分别为109.5。、120。、180。,A正确;
B.卤族元素原子半径从上到下依次增大,所以与H原子形成的键长依次增大,B正确;
C.同族元素中原子半径从上到下依次增大,氢化物的键长依次增大,键能依次减弱,稳定性依次降低,C正确;
D.分子中共价键的键能越大,越稳定,即分子稳定性越好,D错误;
故选D。
考点四 综合运用
【例4】(2022秋·四川绵阳·高二四川省绵阳第一中学校考阶段练习)化学键的键能是指气态基态原子间形成 SKIPIF 1 < 0 化学键时释放的最低能量。如: SKIPIF 1 < 0 ,即 SKIPIF 1 < 0 键的键能为 SKIPIF 1 < 0 ,也可以理解为破坏 SKIPIF 1 < 0 键需要吸收 SKIPIF 1 < 0 的热量。化学反应的发生可以看成旧化学键的破坏和新化学键的形成。
下表是一些键能数据(单位: SKIPIF 1 < 0 ):
阅读上述信息,回答下列问题:
(1)根据表中数据判断 SKIPIF 1 < 0 的稳定性(填“大于”或“小于”) SKIPIF 1 < 0 的稳定性_______。试预测 SKIPIF 1 < 0 键的键能范围:_______ SKIPIF 1 < 0 键键能<_______
(2)结合表中数据和热化学方程式 SKIPIF 1 < 0 ,该反应是_______反应(填“放热”或者“吸热”)则热化学方程式中 SKIPIF 1 < 0 的值为_______。
(3)由表中数据能否得出这样的结论:半径越小的原子形成的共价键越牢固(即键能越大)_______(填“能”或“不能”)。
【答案】(1) 小于 SKIPIF 1 < 0 SKIPIF 1 < 0
(2) 放热 -185
(3)能
【解析】(1)化学键键能越强,断开化学键所要吸收的能量越大,该化合物稳定性越高,由表中数据可得CCl4稳定性弱于CF4。原子半径越小,生成的共价键键能越大,卤族元素F、Cl、Br、I电子层数依次增加,半径依次增大,Br的半径介于Cl与I之间,则C-Br键能也介于C-Cl和C-I之间;
(2)反应物断裂化学键吸收能量,生成物生成化学键放出能量,可得 SKIPIF 1 < 0 ;ΔH<0,则该反应为放热反应;
(3)由表中数据可得,半径越小的原子生成的化学键键能越大。
【一隅三反】
1.(2022·高二课时练习)已知键能、键长部分数据如下表:
(1)下列推断正确的是___________(填字母)。A.稳定性: SKIPIF 1 < 0
B.氧化性: SKIPIF 1 < 0
C.沸点: SKIPIF 1 < 0
D.还原性: SKIPIF 1 < 0
(2)下列有关推断正确的是___________(填字母)。
A.同种元素形成的共价键,稳定性:三键>双键>单键
B.同种元素形成双键键能一定小于单键的2倍
C.键长越短,键能一定越大
(3)在表中所给 SKIPIF 1 < 0 (X为卤族元素)分子中,键长最短的是___________,最长的是___________; SKIPIF 1 < 0 键的键长___________(填“大于”“小于”或“等于”) SKIPIF 1 < 0 键的键长。
【答案】(1)ACD
(2)A
(3) HF HI 大于
【解析】(1)A.根据表中数据,同主族元素气态氢化物的键能从上至下逐渐减小,稳定性逐渐减弱,A正确;
B.由原子结构知,氯气、溴单质、碘单质的氧化性逐渐减弱,B错误;
C.影响水和氨气沸点的主要因素是分子间存在氢键,由于水分子间氢键比氨分子间氢键作用较强,导致沸点: SKIPIF 1 < 0 ,C正确;
D.还原性与失电子能力有关,还原性: SKIPIF 1 < 0 ,D正确;
故选ACD。
(2)A.由碳碳键的数据知,键能 SKIPIF 1 < 0 < SKIPIF 1 < 0 < SKIPIF 1 < 0 ,键能越大越稳定,A正确;
B.由 SKIPIF 1 < 0 键、 SKIPIF 1 < 0 键的键能知,同种元素形成双键键能不一定小于单键的2倍,B错误;
C. SKIPIF 1 < 0 键的键长大于 SKIPIF 1 < 0 键的键长,但是 SKIPIF 1 < 0 键的键能反而较小,C错误;
故选A。
(3)键能越大,键长越短,所以 SKIPIF 1 < 0 分子中,键长最短的是HF,最长的是HI;相同原子形成的共价键,共用电子对越多,键长越短,故 SKIPIF 1 < 0 键的键长大于 SKIPIF 1 < 0 键的键长,故答案为:HF;HI;大于。
2.(2021秋·山东潍坊·高二校考阶段练习)1932年美国化学家鲍林首先提出了电负性(用x表示)的概念。表中是某些短周期元素的x值:
(1)表格元素中,第一电离能最小的元素的基态原子电子排布式为____。
(2)通过分析x值变化规律,确定N元素x值范围:____<x(N)<____。____
(3)第一电离能大小:Mg____Al(填“大于”“小于”)。
(4)S元素和Cl元素基态原子核外未成对电子数之比为____。
(5)某有机化合物结构中含S-N键,其共用电子对偏向____(写原子名称)。
(6)经验规律告诉我们:当成键的两原子相应元素的x差值△x>1.7时,一般为离子键,当△x<1.7时,一般为共价键。试推断AlBr3中化学键类型是____。
【答案】(1)1s22s22p63s1(或[Ne]3s1)
(2)2.55<x(N)<3.44
(3)大于
(4)2:1
(5)氮原子
(6)共价键
【解析】(1)元素的金属性越强,其电负性越小,第一电离能也越小。在上述表格中元素的电负性最小的元素是Na元素,故Na元素的第一电离能最小。根据构造原理可知11号Na元素的原子核外电子排布式是1s22s22p63s1(或[Ne]3s1);
(2)根据表格数据可知:同一周期元素从左到右,元素的电负性逐渐增大,同一主族元素随原子核外电子层数的增多,元素的电负性逐渐减小,则N元素的电负性大小介于2.55-3.44之间,即2.55<x(N)<3.44;
(3)一般情况下同一周期元素的第一电离能呈增大趋势。但当元素处于第IIA、第VA的全充满、半充满的稳定状态时,其第一电离能大于同一周期相邻元素。所以第一电离能大小关系为:Mg>Al;
(4)S是16号元素,原子核外电子排布式是1s22s22p63s22p4,未成对电子式是2个;Cl是17号元素,原子核外电子排布式是1s22s22p63s22p5,未成对电子式是1个,则S元素和Cl元素基态原子核外未成对电子数之比为2:1;
(5)元素的非金属性越强,其形成共价键时吸引电子能力就越强。某有机化合物结构中含S-N键,其共用电子对偏向吸引电子能力强的氮原子;
(6)经验规律告诉我们:当成键的两原子相应元素的电负性x差值△x>1.7时,一般为离子键;当△x<1.7时,一般为共价键。由于Al元素的电负性x=1.61,Br元素的电负性小于Cl元素的电负性x<3.16,则AlBr3中△x<3.16-1.61=1.45,1.45<1.7,所以AlBr3中化学键类型是共价键。
H-H
S-S
C-Cl
C-O
Cl-Cl
H-S
C-I
H-O
H-Cl
C-F
H-F
键能
436
255
330
351
243
339
218
463
432
427
568
共价键
键能( SKIPIF 1 < 0 )
键长( SKIPIF 1 < 0 )
SKIPIF 1 < 0
242.7
198
SKIPIF 1 < 0
193.7
228
SKIPIF 1 < 0
152.7
267
SKIPIF 1 < 0
568
SKIPIF 1 < 0
431.8
SKIPIF 1 < 0
366
SKIPIF 1 < 0
298.7
SKIPIF 1 < 0
462.8
96
SKIPIF 1 < 0
347.7
154
SKIPIF 1 < 0
615
133
SKIPIF 1 < 0
812
120
SKIPIF 1 < 0
413.4
109
SKIPIF 1 < 0
390.8
101
SKIPIF 1 < 0
607
SKIPIF 1 < 0
142
SKIPIF 1 < 0
497.3
元素符号
Li
Be
B
C
O
F
Na
Al
Si
P
S
Cl
x值
0.98
1.57
2.04
2.55
3.44
3.98
0.93
1.61
1.90
2.19
2.58
3.16
化学人教版 (2019)第二节 氮及其化合物练习: 这是一份化学人教版 (2019)第二节 氮及其化合物练习,文件包含三角函数及解三角形大题专题练习卷参考答案doc、三角函数及解三角形专题卷docx等2份试卷配套教学资源,其中试卷共21页, 欢迎下载使用。
高中化学人教版 (2019)选择性必修3第一节 烷烃优秀同步训练题: 这是一份高中化学人教版 (2019)选择性必修3第一节 烷烃优秀同步训练题,共13页。试卷主要包含了甲烷,烷烃结构和性质,烷烃的命名,烷烃的同分异构体,烷烃的综合运用等内容,欢迎下载使用。
人教版 (2019)选择性必修2第四节 配合物与超分子精品同步练习题: 这是一份人教版 (2019)选择性必修2第四节 配合物与超分子精品同步练习题,共14页。试卷主要包含了配位键,配合物,超分子,综合运用等内容,欢迎下载使用。













