




人教版 (2019)必修 第一册第一节 原子结构与元素周期表评课ppt课件
展开丰富多彩的物质世界是由一百多种元素组成。那么这些元素之间有什么内在联系吗?它们是如何相互结合形成多种多样的物质呢?原子结构与元素周期表之间有什么样的关系呢?
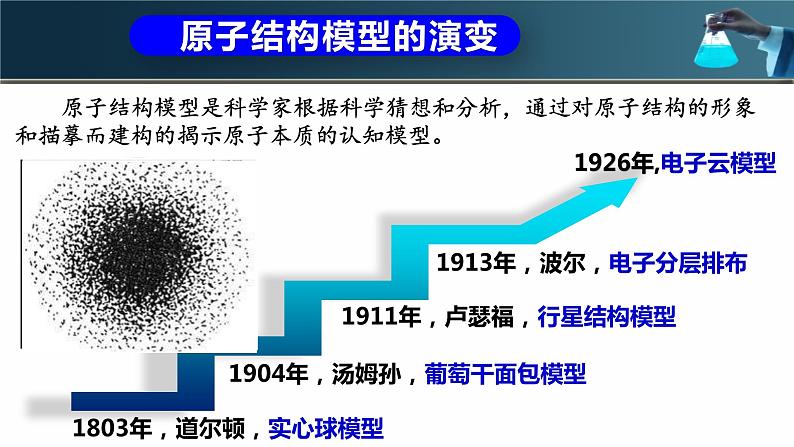
原子结构模型是科学家根据科学猜想和分析,通过对原子结构的形象和描摹而建构的揭示原子本质的认知模型。
原子结构模型的演变
1803年,道尔顿,实心球模型
1904年,汤姆孙,葡萄干面包模型
1911年,卢瑟福,行星结构模型
1913年,波尔,电子分层排布
1926年,电子云模型
人类对原子的认识在不断的深化
化学的发展也是艰难而充满挑战的
根据初中的化学知识,同学们描述一下原子的结构
原子的质量=质子的质量+中子的质量+电子的质量(可忽略)
原子的质量≈质子的质量+中子的质量
相对原子质量≈质子的相对质量+中子的相对质量
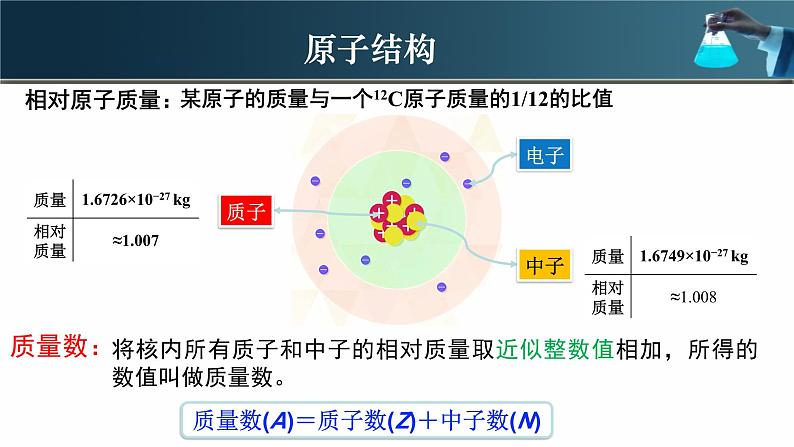
将核内所有质子和中子的相对质量取近似整数值相加,所得的数值叫做质量数。
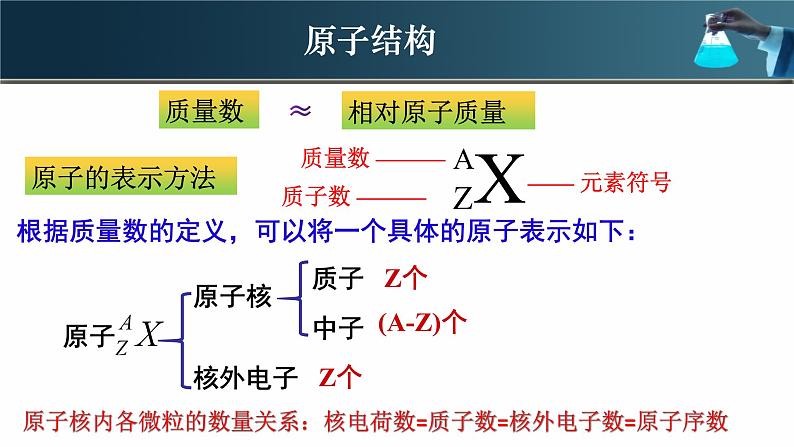
质量数(A)=质子数(Z)+中子数(N)
某原子的质量与一个12C原子质量的1/12的比值
根据质量数的定义,可以将一个具体的原子表示如下:
原子核内各微粒的数量关系:核电荷数=质子数=核外电子数=原子序数
1、原子的质量主要由原子核决定。已知质量数为A的某阳离子Rn+,核外有X个电子,则核内中子数为A.A-X B.A-X-n C.A-X+n D.A+X-n
2、已知R2+核内共有N个中子,R的质量数为A,确定m g R2+中含有电子的物质的量为
K L M N O P Q
电子分层运动,离核越远,能量越高。
通过科学研究发现,每一层能填充的电子数是有一定的规律的。
钠原子的结构示意图如下,请注明其意义:
原子结构示意图中,核内质子数 = 核外电子数
电子一般总是先从内层排起,当一层充满后再填充下一层。那么每个电子层最多可以排布多少个电子呢?
从表中稀有气体的电子排布,你发现什么规律?(1) 当K为最外层,最多能容纳多少电子?除了K层,其他各层为最外层时,最多能容纳的电子数是多少?(2)次外层最多容纳电子数是多少?(3)你能归纳出第n层最多能容纳的电子数吗?
核外电子排布的规律特点:(1)_____________________;(2)_____________________;(3)_____________________;(4)_____________________等。
K层最多容纳电子数为2
最外层电子数不超过8个
每层最多容纳2n2个电子。最外层电子数目不超过8个,次外层电子数目不超过18个。核外电子排布的规律是互相联系的,不能孤立地理解。
(4) 请你根据所归纳的规律,用原子结构示意图表示核电核数为1-20号元素原子的核外电子排布。
1、下面关于多电子原子的核外电子的运动规律的叙述正确的是①核外电子是分层运动的 ②所有电子在同一区域里运动 ③能量高的电子在离核近的区域内运动 ④能量低的电子在离核近的区域内运动A.①④ B.②③ C.①③ D.②④2、在第n电子层中,当它作为原子的最外电子层时,最多容纳的电子数与(n-1)层相同,当它作为原子的次外层时,其电子数比(n+1)层最多能多10个,则此电子层是A.K层 B.L层 C.M层 D.N层
3、根据原子核外电子排布规律,写出33号元素的原子结构示意图
4、已知A、B、C三种元素的原子中,质子数为A
NaClO=Na++ClO-
7.观察下列A、B、C、D、E五种粒子(原子或离子)的结构示意图,回答有关问题:(1)属于阴离子结构示意图的是________(填字母编号)。(2)性质最稳定的原子是_________(填字母编号)。(3)元素D的单质在B2中燃烧,该产物的化学式________。(4)在核电荷数1-18的元素内,列举一个与C原子的电子层结构相同的离子,写出离子的符号_________。(5)写出化合物DAB在水溶液中的电离方程式________________。
每个电子层最多能容纳的电子数为2n2
最外层最多能容纳8个电子(K层为2个)
次外层最多容纳18个电子(L层为8个)
⇒1869年,俄国化学家门捷列夫编制出第一张元素周期表。↓ ⇒按照相对原子质量由小到大的顺序依次排列,将化学性质相似的元 素放在同一纵行。↓ ⇒揭示了化学元素间的内在联系,成为化学发展史上的重要里程碑之一。↓ ⇒随着科学的发展,元素周期表中为未知元素留下的空位先后被填满。↓ ⇒当原子的组成及结构的奥秘被发现后,编排依据由相对原子质量改 为原子的核电荷数,形成现行的元素周期表。
元素周期表中元素的排列方式:将电子层数相同的元素按照原子序数递增的顺序由左向右排成横行,再把不同横行中最外层电子数相同的元素,按电子层数递增的顺序由上向下排成纵列。
每一个横行叫做一个周期
填写下表,并思考周期序数与元素的原子核外电子层数之间的关系
周期序数=原子核外电子层数
主族:由长周期元素和短周期元素共同组成的族 大写罗马数字加A
副族:完全由长周期元素组成的族 大写罗马数字加B(第Ⅷ族以外)
稀有气体元素化学性质不活泼,其化合价定为0,统称0族
练习:指出Si在周期表中的位置
Si在周期表中的位置为:第三周期第ⅣA族
(1)一个横行即是一个周期,一个纵列即是一个族( )(2)每一周期都是碱金属元素开始,稀有气体元素结束( )(3)同周期中元素电子层数一定相同( )(4)同族元素的最外层电子数一定等于族序数( )(5)0族元素的最外层电子数均为8( )(6)元素周期表已发展成一个稳定的形式,它不可能再有新的变化了( )
2、判断原子序数为13、34、53、96的元素在元素周期表中的位置。
3、根据短周期元素的信息回答问题。
2019人教版必修第一册
第四章 第一节 原子结构与元素周期表
【思考】比较三种原子结构的异同,它们是不是同一种元素?
元素:具有相同核电荷数(或质子数)的同一类原子的总称。
核素:具有一定数目质子和一定数目中子的一种原子。
【思考】它们是不是同一种原子?
(2)绝大多数元素都包含多种核素,一种核素就是一种原子(到2001年底已发现114种元素的3070种核素)。
(3)多数核素能在自然界中稳定存在,少数核素因其原子具有放射性不能在自然界中稳定存在
同位素:质子数相同而中子数不同的同一种元素的不同原子互称为同位素。
同一元素的不同核素之间互称为同位素。
两同两不同两同:质子数相同,元素相同;两不同:中子数不同,原子不同。
同一元素的各同位素虽然质量数不同,但它们的化学性质基本相同。但物理性质有所不同。
质子数、中子数都一定的原子
质子数相同、中子数不同的核素
同种元素形成的不同单质
O2、O3互为同素异形体
为什么H的相对原子质量1.008,这个数值是怎么来的?
天然存在的同位素,相互保持一定的比率。元素的相对原子质量,就是按照该元素各种核素所占的一定百分比(丰度)计算出来的平均值。
Ar=R1×a1%+R2×a2%+…R1、R2…为各核素的相对原子质量;a1%、a2%…为各核素的所占百分比
例:镁有三种天然同位素:24Mg占78.70 %,25Mg占10.13 %,26Mg占11.17 %,列式并计算镁元素的近似相对原子质量。
Ar = 24× 78.70% +25× 10.13% +26× 11.17% = 24.32
同位素中,有些具有放射性,称为放射性同位素。
4. 可用于指示反应的原理(同位素示踪法16O和18O)
5. 可用于射线育种、金属的探伤、诊断和治疗疾病等
人教版 (2019)必修 第一册第二节 金属材料备课ppt课件: 这是一份人教版 (2019)必修 第一册第二节 金属材料备课ppt课件,共25页。PPT课件主要包含了什么是合金,生铁和钢,碳素钢和合金钢,铝和铝合金,产生的气体是什么呢,小结氧化铝的性质,化学性质,新型合金,金属材料的分类,课堂练习等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第四章 物质结构 元素周期律第一节 原子结构与元素周期表背景图ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第四章 物质结构 元素周期律第一节 原子结构与元素周期表背景图ppt课件,共22页。PPT课件主要包含了元素周期表,原子结构,自主练习,短周期,长周期等内容,欢迎下载使用。
人教版 (2019)第一节 原子结构与元素周期表说课ppt课件: 这是一份人教版 (2019)第一节 原子结构与元素周期表说课ppt课件,共21页。PPT课件主要包含了新课讲授,自主练习,核素同位素,同位素的特点,碱金属元素,思考讨论,卤素元素,卤素元素物理性质等内容,欢迎下载使用。














