
化学选择性必修2第1章 原子结构与元素性质第3节 元素性质及其变化规律习题
展开1.3元素性质及其变化规律同步练习-鲁科版高中化学选择性必修2
学校:___________姓名:___________班级:___________考号:___________
一、单选题
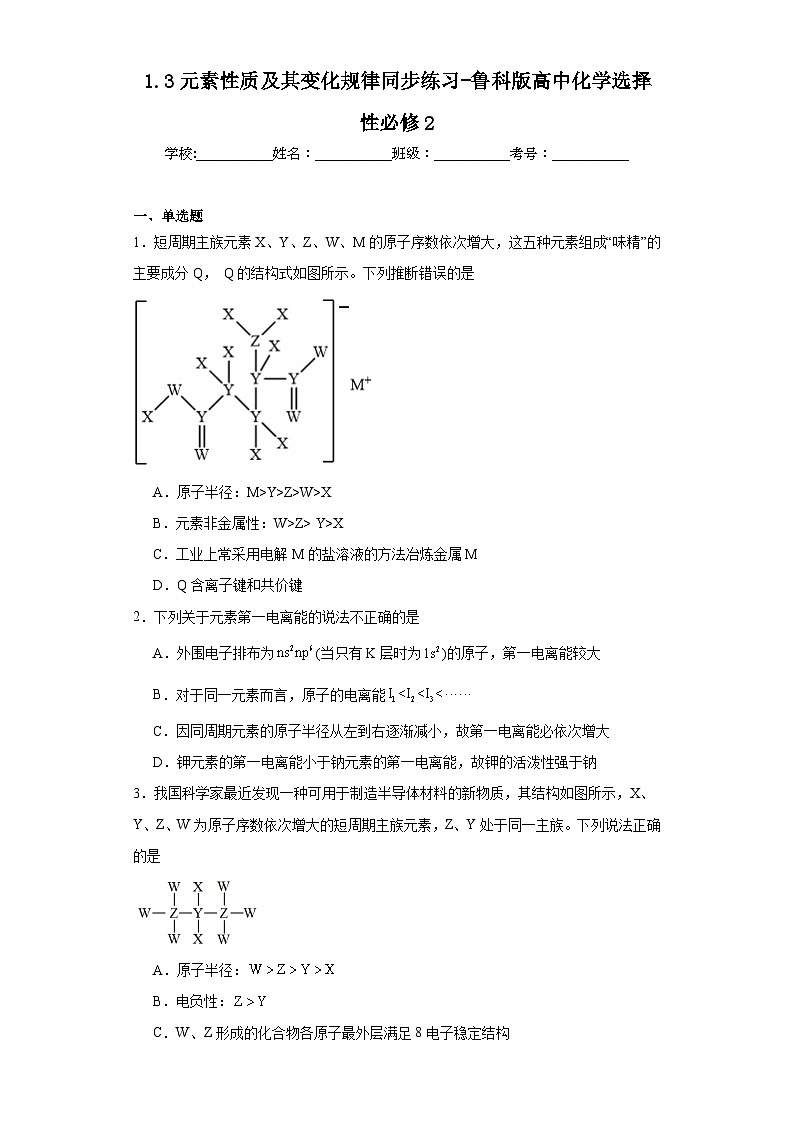
1.短周期主族元素X、Y、Z、W、M的原子序数依次增大,这五种元素组成“味精”的主要成分Q, Q的结构式如图所示。下列推断错误的是
A.原子半径:M>Y>Z>W>X
B.元素非金属性:W>Z> Y>X
C.工业上常采用电解M的盐溶液的方法冶炼金属M
D.Q含离子键和共价键
2.下列关于元素第一电离能的说法不正确的是
A.外围电子排布为(当只有K层时为)的原子,第一电离能较大
B.对于同一元素而言,原子的电离能
C.因同周期元素的原子半径从左到右逐渐减小,故第一电离能必依次增大
D.钾元素的第一电离能小于钠元素的第一电离能,故钾的活泼性强于钠
3.我国科学家最近发现一种可用于制造半导体材料的新物质,其结构如图所示,X、Y、Z、W为原子序数依次增大的短周期主族元素,Z、Y处于同一主族。下列说法正确的是
A.原子半径:
B.电负性:
C.W、Z形成的化合物各原子最外层满足8电子稳定结构
D.W的氧化物对应的水化物为强电解质
4.1919年,英国物理学家卢瑟福用粒子(即氦核)轰击非金属原子发现了质子:。其中元素原子X、Q的常见单质均为双原子无色气体。下列说法正确的是( )
A.原子核内中子数与质子数之比为 B.X、Q的简单氢化物稳定性:
C.Q最高化合价比X的最高化合价高 D.X的氧化物对应的水化物均为强酸
5.W、X、Y、Z为原子序数依次递增的短周期主族元素,W与X、Y与Z分别位于同一周期,化合物WX为常见的大气污染物,Y与Ⅹ同主族。下列说法正确的是
A.电负性: B.简单氢化物的键角:
C.原子半径: D.最高价氧化物对应的水化物的酸性:
6.下列事实能说明元素的金属性或者非金属性相对强弱的是
序号
事实
结论
A
HF的沸点高于HCl
非金属性: F>Cl
B
H2SO3的酸性强于H2CO3
非金属性: S>C
C
Mg与Al在以NaOH为电解质溶液的原电池中,Al为负极
金属性:Al>Mg
D
NaOH碱性强于Mg(OH)2
金属性:Na>Mg
A.A B.B C.C D.D
7.X、Y、Z、W为原子序数依次增大的前四周期元素,X原子为元素周期表中半径最小的原子,Z原子最外层电子数为次外层电子数的三倍,W位于第IB族,X、Y、Z、W形成的阳离子为狭长的八面体结构如图所示,下列说法不正确的是
A.X、Y、Z元素第一电离能最大的是Z
B.两种配体分子中的键角:X2Z<YX3
C.由图可知该阳离子中心原子的配位数为6
D.加热时该离子首先失去的组分是X2Z
8.1934年,约里奥·居里夫妇用粒子(即氦核)轰击某金属原子得到,具有放射性,可衰变为,。基态Y原子3p能级半充满。下列说法错误的是
A.X原子核内中子数与质子数之比为14∶13
B.X和Y的氧化物分别为碱性氧化物、酸性氧化物
C.第一电离能:X
9.下列有关说法正确的是
A.7.8g苯含有0.6NA个σ键
B.基态F原子核外有9种能量不同的电子
C.第一电离能:Ga>Zn
D.每个面心立方晶胞中八面体空隙与四面体空隙个数比为1:2
10.下列各组元素的性质叙述正确的是
A.原子半径: B.第一电离能:
C.电负性: D.最高正化合价:
二、填空题
11.根据信息回答下列问题:不同元素的原子在分子内吸引键合电子的能力大小可用数值表示,该数值称为电负性。一般认为:如果两个成键原子间的电负性差值大于1.7,原子之间通常形成离子键;如果两个成键原子间的电负性差值小于1.7通常形成共价键。下表是某些元素的电负性值:
元素符号
Li
Be
B
C
O
F
Na
Al
Si
P
S
Cl
电负性值
1.0
1.5
2.0
2.5
3.5
4.0
0.9
1.5
1.8
2.1
2.5
3.0
(1)通过分析电负性值的变化规律,确定Mg元素的电负性值的最小范围: 。
(2)请归纳元素的电负性和金属性、非金属性的关系是 。
(3)推测AlF3、AlCl3、AlBr3是离子化合物还是共价化合物:AlF3 ,AlCl3 , AlBr3 。
12.神舟十二号飞船携带3名航天员返回地球时,为了减弱返回舱着陆的速度,反推发动机的燃料是高氯酸铵(NH4ClO4)和铝粉混合物。
完成下列填空:
(1)上述燃料涉及的元素所形成的简单离子中,核外电子数相同的离子半径由大到小顺序为 (离子符号表示),上述元素的原子中,未成对电子数最多的核外电子排布式为 。
(2)写出NH的电子式 ,其空间构型与甲烷空间构型相同,为 型。
(3)氮气性质比较稳定,从分子结构的角度说明理由。
(4)配平以下方程式:
_____Al+_____NH4ClO4→______Al2O3+_____AlCl3+_____N2↑+____ H2O 。
上述反应中被氧化的元素是 ,若产生42g氮气,过程中氮元素转移电子为 mol。
(5)若回收地点附近的水中Al3+浓度超标,加入碳酸氢钠,可有效降低Al3+浓度,减少了水污染,请说明理由
13.元素周期表是学习、研究和应用化学的一种重要工具。如图为元素周期表前四周期的一部分,R、W、X、Y、Z代表五种元素,回答下列问题。
X
W
Y
R
Z
(1)基态R原子的电子排布式为 。
(2)W、X、Y三种元素的基态原子中,p能级未成对电子最多的是 (填元素符号)。
(3)X、Z两种元素气态氢化物的稳定性: > (填化学式)。
(4)Y的第一电离能小于W的,结合价层电子排布式解释其原因 。
(5)元素的电负性是元素的一种基本性质,下面给出10种元素的电负性。
元素
Al
Be
Mg
C
Cl
Na
Li
N
Si
O
H
电负性
1.5
1.5
2.5
3.0
0.9
1.0
3.0
1.8
3.5
2.1
已知:
i.通常两成键元素间电负性差值大于1.7时,形成离子键;两成键元素间电负性差值小于1.7时,形成共价键。
ii.在水等强极性溶剂中,成键原子电负性的差异是影响化学键断裂难易程度的原因之一。水化物M-O-H(M代表某种元素)结构中,成键原子电负性差异越大,所成化学键越容易断裂,电离出OH-或H+。
①通过分析电负性的变化规律,确定Mg元素电负性的最小范围 。
②下列物质属于离子化合物的是 (填字母)。
a.BeCl2 b.Li3N c.HCl d.CCl4
③请设计实验方案证明②中你选出物质为离子化合物 。
④结合电负性数据,解释HClO水溶液显酸性而不显碱性的依据是 。
14.下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
试回答下列问题:
(1)写出基态原子的电子排布式: ,的原子序数: ,的简化电子排布式: 。
(2)下列关于元素在元素周期表中的位置的叙述正确的是 (填选项字母)。
A.位于元素周期表中第四周期第ⅡB族,属于区元素
B.位于元素周期表中第四周期第ⅣB族,属于区元素
C.位于元素周期表中第三周期第ⅡA族,属于区元素
D.位于元素周期表中第三周期第ⅦA族,属于区元素
(3)下列有关说法正确的是 (填选项字母)。
A.第一电离能:G>F>E B.电负性:D>C C.原子半径:B>E D.最高价含氧酸的酸性:I>H
15.如图是元素周期表的一部分。
①
②
③
④
⑤
⑥
⑦
⑧
⑨
⑩
回答下列问题:
(1)元素⑨基态原子的外围电子排布图为 ,元素⑩的原子结构示意图为 。
(2)元素③④⑤的电负性由大到小的顺序为 (填化学符号,下同),其第一电离能由大到小的顺序为 ,其简单离子半径由大到小的顺序为 。
16.百余种不同的元素,是构成大千世界中所有物质的“基石”。科学家们根据元素的性质递变规律、电子排布规律等对元素进行编排设计元素周期表。请根据所学内容回答下列问题:
(1)地壳中含量最多的元素的基态原子的轨道表示式是 ,能量最高的电子所在的轨道呈 形。
(2)、是工业生产中重要的两种金属,将乙醇蒸气通过赤热的氧化铜粉末,发生的反应的化学方程式是 。
(3)研究发现,正离子的颜色与未成对电子数有关。例如:、、等。呈无色,其原因是 。
(4)当原子、分子或离子内有单电子存在时,能被外磁场吸引,表现出顺磁性。则铬元素的基态原子是否具有磁性?填 (填“有”或“无”)该元素在元素周期表中的位置:第 周期,第 族,该周期共有 种元素。
(5)随着科技的不断发展,人类对原子结构的认识不断深入,新型材料层出不穷。下表中列出了第三周期的几种元素的部分性质:
元素编号
a
b
c
d
e
电负性
3.0
2.5
X
1.5
0.9
主要化合价
,
,
,
预测X值的区间: ;上表中五种元素的第一电离能由大到小的顺序是 。(写元素符号)
(6)Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂、钛酸锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。基态原子的外围电子排布式为 ;位于周期表中 区,基态、离子中未成对的电子数之比为 。
(7)和的第一电离能:,原因是 。
(8)一种由短周期主族元素组成的化合物(如图所示),具有良好的储氢性能,其中元素W、X、Y、Z的原子序数依次增大、且总和为24。下列有关叙述错误的是___________。
A.该化合物中,W、X、Y之间均为共价键
B.Z的单质既能与水反应,也可与甲醇反应
C.Y的最高化合价氧化物的水化物为强酸
D.X的氟化物中原子均为8电子稳定结构
17.电离能是指1 mol气态基态原子(或阳离子)失去1 mol电子形成1 mol气态阳离子(或更高价阳离子)所吸收的能量。现有核电荷数小于18的元素A,其电离能(单位为eV·mol-1)数据如下。
I1
I2
I3
I4
I5
I6
I7
I8
I9
I10
I11
电离能
7.64
15.03
80.12
109.3
141.2
186.5
224.9
226.0
327.9
367.4
1761
(1)外层电子离核越远,能量越高,电离能越 (填“大”或“小”);阳离子电荷数越高,再失去电子时,电离能越 (填“大”或“小”)。
(2)上述失去的11个电子分属 个电子层。
(3)失去11个电子后,该元素原子核外还有 个电子。
(4)该元素的最高价氧化物对应的水化物的化学式是 。
18.已知A、B、C、D为第三周期元素,其第一至第四电离能如表所示(单位:)。
元素代号
I1
I2
I3
I4
A
1521
2666
3931
5771
B
496
4562
6912
9543
C
738
1451
7733
10540
D
578
1817
2745
11575
试回答下列各题:
(1)A是 (填元素符号,下同),B是 ,C是 ,D是 。
(2)B在化合物中通常显 价,B的电负性 (填“>”“<”或“=”)C的电负性。
(3)下列元素形成的单质中,化学性质与A形成的单质最相似的是 (填序号)。
A.氦 B.铍 C.锂 D.氢
(4)大部分元素都会出现相邻两个电离能的数据相差较大的情况,请预测B的第2次电离能数据飞跃将是在失去第 个电子时。
19.过渡金属元素铬(Cr)是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:对于基态Cr原子,下列叙述正确的是 (填标号)。
A.轨道处于半充满时体系总能量低,核外电子排布应为[Ar]3d54s1
B.4s电子能量较高,总是在比3s电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
20.A、B、M、D、E为短周期主族元素,且原子序数依次增大,质子数之和为39,B、M同周期,A、D同主族,A为短周期原子半径最小的元素,M原子最外层电子数为次外层的3倍,A、M常温下能形成两种液态化合物A2M和A2M2,E元素的周期数与主族序数相等。请用化学用语回答下列问题:
(1)B元素在周期表中的位置为 ;由A、M、D三种元素组成的化合物中含有的化学键为 ;A2M分子的空间结构为 ;
(2)用电子式表示D2M的形成过程
(3)D、E、M形成的简单离子半径从大到小的顺序为 (用离子符号表示)
(4)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2M2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出该反应的离子方程式 。
(5)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,DA能与水反应放出氢气,且反应后的溶液呈碱性。若将0.1mol的DA和0.1mol的E单质混合后加入足量的水,充分反应后生成的气体在标准状况下的体积是 L。
三、实验题
21.从钒铬锰矿渣(主要成分为)中提铬的一种工艺流程如下:
已知:较大时,二价锰在空气中易被氧化。回答下列问题:
(1)元素位于元素周期表第 周期 族。
(2)用溶液制备胶体的化学方程式为 。
(3)常温下,各种形态五价钒粒子总浓度的对数与关系如图1,已知钒铬锰矿渣硫酸浸液中,“沉钒”过程控制,则与胶体共沉降的五价钒粒子的存在形态为 (填化学式)。
(4)某温度下,(III)、(II)的沉淀率与关系如图2,“沉铬”过程最佳为 (填标号);
a.4.0 b.5.0 c.6.0
在该条件下滤液B中 [近似为,的近似为]。
(5)“转化”过程中生成的离子方程式为 。
(6)“提纯”过程中的作用为 。
22.某学习小组同学为探究同周期或同主族元素性质的递变规律,设计了如下系列实验:
Ⅰ.(1)将等质量的钾、钠、镁、铝分别投入到足量的同浓度的盐酸中,试预测实验结果:上述金属中 与盐酸反应最剧烈, 与盐酸反应生成的气体最多。
(2)向Na2S溶液中通入氯气出现淡黄色浑浊,可证明Cl的非金属性比S强。反应的离子方程式为 。
Ⅱ.利用下图装置来验证同主族元素非金属性的变化规律:
(1)要证明非金属性:Cl>I,在A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液 的现象,即可证明。干燥管D的作用是 。从环境保护的角度考虑,此装置尚缺少尾气处理装置,可用 溶液吸收尾气。
(2)要证明非金属性:C>Si,在A中加盐酸,B中加CaCO3,C中加Na2SiO3溶液,将观察到C中 的现象。但老师认为,该现象不足以证明酸性强弱关系为碳酸>硅酸,请用文字叙述理由 。因此应在B、D之间增加一个盛有足量 (选填下列字母:A.浓盐酸 B.浓NaOH溶液C.饱和Na2CO3溶液 D.饱和NaHCO3溶液)的洗气装置。改进后C中发生反应的化学方程式是 。
23.氯化氰(CNCl),又名氯甲氰,是重要的化工中间体,在农药、医药、化工助剂等方面有着广泛的应用。某小组制备氯化氰并探究其性质,装置如图所示。回答下列问题:
已知部分信息如下:
①CNCl的熔点为-6.5℃,沸点为13.1℃,可溶于水并与水反应;具有较强的还原性。
②合成原理:在℃条件下,。
(1)所含元素中第一电离能最大的是 (填元素符号)
(2)F中干冰和丙酮的作用是降低温度,此时干冰 (填“升华”或“凝华”)。
(3)实验中,先向D中通入 (填“”或“”)。
(4)D中温度高于-5℃时,与反应只生成和气体X(纯净物,其结构中不含环状结构),X的结构式为 。(结构式:用一条短线代表一对共用电子对)
(5)向盛有溶液的试管中通入少量,然后滴加一滴溶液,溶液立即变为红色,和反应的离子方程式为 。
参考答案:
1.C
2.C
3.C
4.B
5.A
6.D
7.A
8.B
9.D
10.C
11.(1)0.9~1.5
(2)非金属性越强,电负性越大;金属性越强,电负性越小
(3) 离子化合物 共价化合物 共价化合物
12.(1) N3−>O2−>Al3+ 1s22s22p3
(2) 正四面体
(3)氮氮叁键键能更大,很难断开,更稳定
(4) 10Al+6NH4ClO4→4Al2O3+2AlCl3+3N2↑+12H2O 0价的Al,-3价的N 9
(5)Al3+水解(结合水中的OH−使溶液)显酸性,HCO水解(结合水中的H+使溶液)显碱性;彼此互相促进,直至产生白色沉淀和气体,有效降低了Al3+浓度。(或Al3+与HCO双水解, Al3++3HCO→Al(OH)3↓+3CO2↑,有效降低了Al3+浓度)
13.(1)1s22s22p63s23p6
(2)P
(3) HF HBr
(4)P原子2p能级半充满,结构稳定,第一电离能大于同周期相邻元素
(5) 0.9~1.5 b 加热使Li3N熔化,做导电性实验,熔融的Li3N能导电,说明Li3N是离子化合物 HClO的结构式为H-O-Cl,H、O的电负性差为1.4, Cl、O的电负性差为O.5,H-O键易断裂
14. 56 C BD
15.
16.(1) 哑铃
(2)CH3CH2OH+CuOCH3CHO+Cu+H2O
(3)Cu+的核外电子排布为[Ar]3d10,没有未成对电子
(4) 有 四 ⅥB 18
(5) (1.5,2.5) Cl>P>S>Al>Na
(6) 3d24s2 d
5:4
(7)Na与Li同主族,但Na电子层多,原子半径大,原子核对核外电子吸引力减弱,更容易失去电子
(8)D
17.(1) 小 大
(2)3
(3)1
(4)Mg(OH)2
18. Ar Na Mg Al +1 < A 10
19.AC
20.(1) 第二周期第IVA族 离子键、(极性)共价键 V形(或写角形)
(2)
(3)O2-> Na+> Al3+
(4)Cu + 2H++ H2O2=Cu2++ 2H2O
(5)5.6
21.(1) 四 ⅥB
(2)
(3)
(4) c
(5)
(6)较大时,二价锰在空气中易被氧化为高价锰离子附在固体表面引入杂质,加入 可以防止二价锰被氧化并还原已经被氧化的二价锰离子,易与分离,提高产品纯度
22. 钾(或K) 铝(或Al) Cl2+S2- = S↓+2Cl- 变蓝 防止溶液倒吸 NaOH 有白色沉淀生成 从B中挥发出的HCl也会和硅酸钠溶液反应生成硅酸 D Na2SiO3+CO2+H2O =H2SiO3↓+Na2CO3(或Na2SiO3+2CO2+2H2O =H2SiO3↓+2NaHCO3)
23.(1)N
(2)升华
(3)
(4)
(5)
化学选择性必修2第3节 元素性质及其变化规律第2课时综合训练题: 这是一份化学选择性必修2第3节 元素性质及其变化规律第2课时综合训练题,共14页。试卷主要包含了下列有关电负性的说法不正确的是,1,Y为3,0-1等内容,欢迎下载使用。
鲁科版 (2019)选择性必修2第3节 元素性质及其变化规律课时作业: 这是一份鲁科版 (2019)选择性必修2第3节 元素性质及其变化规律课时作业,共38页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
鲁科版 (2019)选择性必修2第3节 元素性质及其变化规律达标测试: 这是一份鲁科版 (2019)选择性必修2第3节 元素性质及其变化规律达标测试,共11页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。













