
2024届高三新高考化学大一轮专题练习--化学反应的速率
展开2024届高三新高考化学大一轮专题练习--化学反应的速率
一、单选题
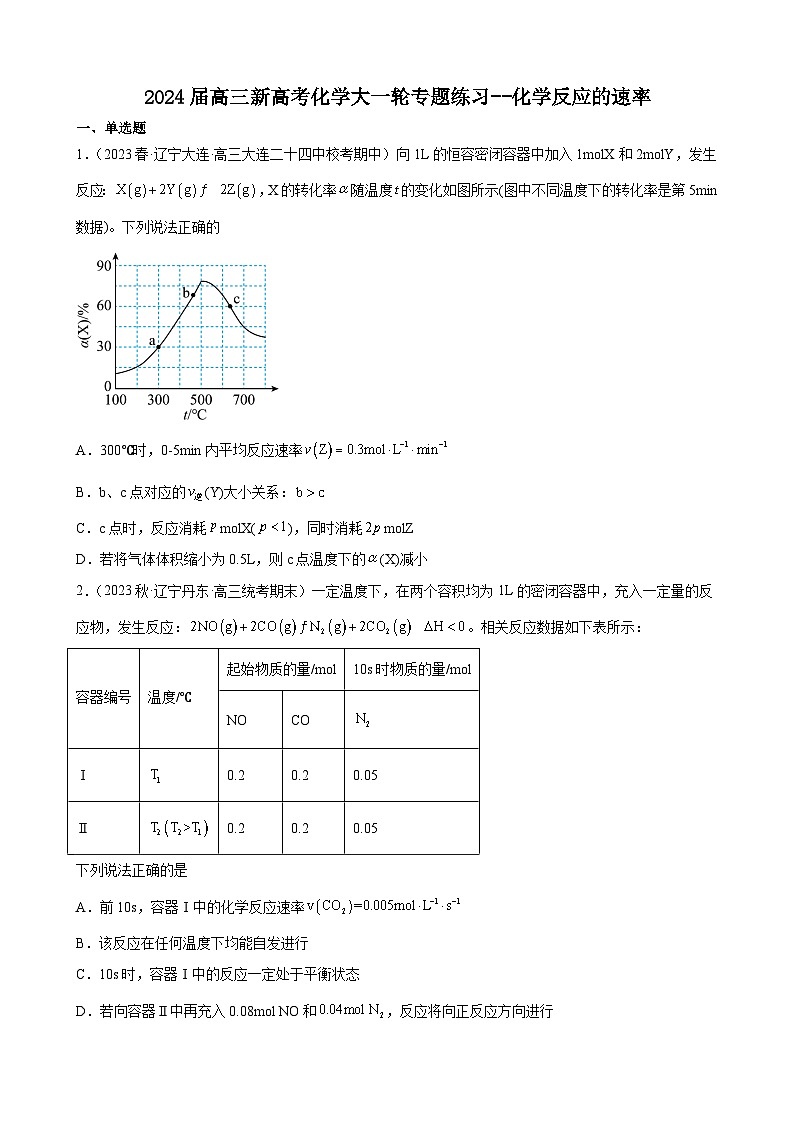
1.(2023春·辽宁大连·高三大连二十四中校考期中)向1L的恒容密闭容器中加入1molX和2molY,发生反应:,X的转化率随温度的变化如图所示(图中不同温度下的转化率是第5min数据)。下列说法正确的
A.300℃时,0-5min内平均反应速率
B.b、c点对应的(Y)大小关系:
C.c点时,反应消耗molX(),同时消耗molZ
D.若将气体体积缩小为0.5L,则c点温度下的(X)减小
2.(2023秋·辽宁丹东·高三统考期末)一定温度下,在两个容积均为1L的密闭容器中,充入一定量的反应物,发生反应: 。相关反应数据如下表所示:
容器编号
温度/℃
起始物质的量/mol
10s时物质的量/mol
NO
CO
Ⅰ
0.2
0.2
0.05
Ⅱ
0.2
0.2
0.05
下列说法正确的是
A.前10s,容器Ⅰ中的化学反应速率
B.该反应在任何温度下均能自发进行
C.10s时,容器Ⅰ中的反应一定处于平衡状态
D.若向容器Ⅱ中再充入0.08mol NO和,反应将向正反应方向进行
3.(2023春·上海·高三期末)往一定容积的反应容器中充入2molNO和,发生化学反应,在其他条件相同时,测得实验数据如下表:
压强
温度/℃
NO达到所列转化率需要时间/s
50%
90%
98%
1.0
30
12
250
2830
90
25
510
5760
8.0
30
0.2
3.9
36
90
0.6
7.9
74
根据表中数据,下列说法正确的是
A.升高温度,反应速率加快
B.增大压强,反应速率变慢
C.在、90℃条件下,当转化率为98%时反应已达平衡
D.若反应速率以表示,在、30℃条件下,转化率0~50%时段NO的反应速率为5mol/s
4.(2023春·江西九江·高三德安县第一中学校考期中)对利用甲烷消除污染进行研究,。在2 L密闭容器中,控制不同温度,分别加入和。测得随时间变化的有关实验数据见下表。下列说法正确的是
组别
温度
时间/min(n/mol)
0
10
20
40
50
①
0.50
0.35
0.25
0.10
0.10
②
0.50
0.30
0.18
0.15
A.组别①中,0~20min内,的降解速率为
B.由实验数据可知实验控制的温度
C.0~10min内,的降解速率①>②
D.40min时,表格中对应反应已经达到平衡状态
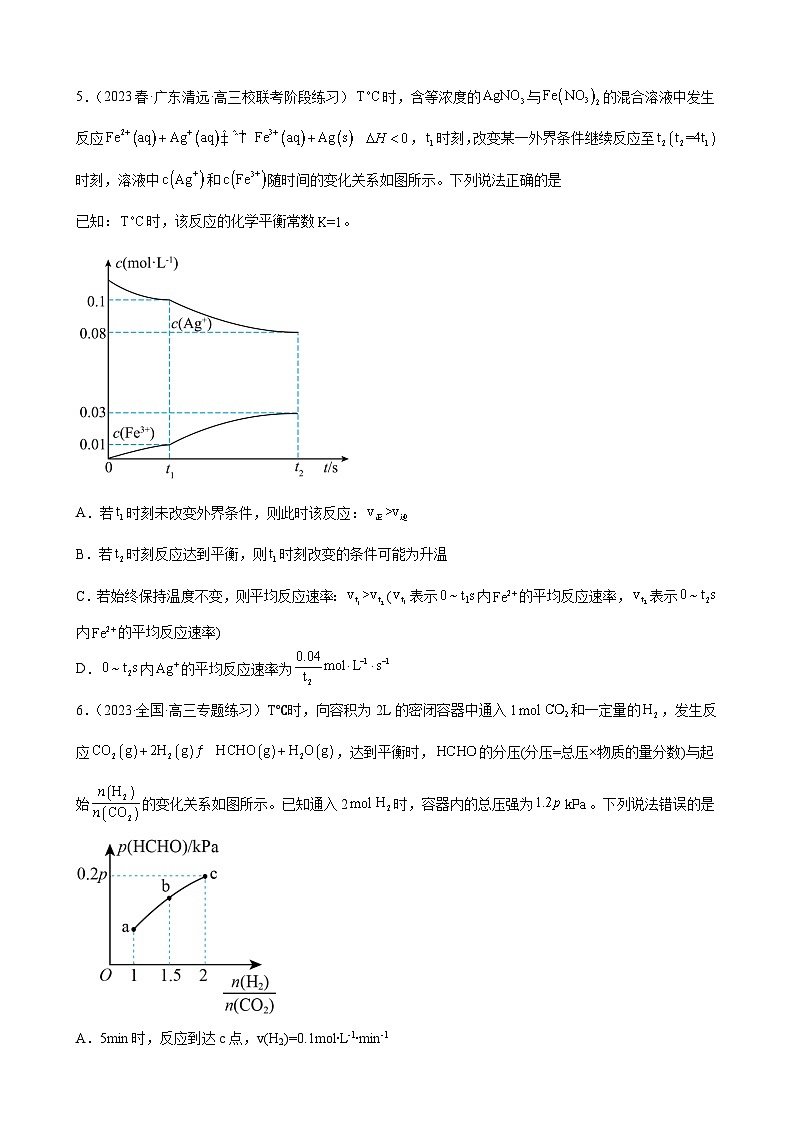
5.(2023春·广东清远·高三校联考阶段练习)时,含等浓度的与的混合溶液中发生反应 ,时刻,改变某一外界条件继续反应至时刻,溶液中和随时间的变化关系如图所示。下列说法正确的是
已知:时,该反应的化学平衡常数。
A.若时刻未改变外界条件,则此时该反应:
B.若时刻反应达到平衡,则时刻改变的条件可能为升温
C.若始终保持温度不变,则平均反应速率:(表示内的平均反应速率,表示内的平均反应速率)
D.内的平均反应速率为
6.(2023·全国·高三专题练习)T℃时,向容积为2L的密闭容器中通入1和一定量的,发生反应,达到平衡时,的分压(分压=总压×物质的量分数)与起始的变化关系如图所示。已知通入2时,容器内的总压强为。下列说法错误的是
A.5min时,反应到达c点,v(H2)=0.1mol∙L-1∙min-1
B.b点时,反应的平衡常数
C.容器内的体积分数保持不变,说明反应达到平衡状态
D.c点时,再通入和,使二者的分压均增大,平衡正向移动
7.(2023·全国·高三专题练习)芬顿试剂是以和组成的水溶液体系,具有极强的氧化能力,其机理如图所示。下列说法错误的是
A.起到催化作用
B.基元反应1的方程式为:
C.基元反应1的活化能比基元反应2的高
D.图示过程中,会发生变化
8.(2023·全国·高三专题练习)向两个锥形瓶中各加入镁条,塞紧橡胶塞,然后用注射器分别注入盐酸、醋酸,测得瓶内气体压强随时间变化如图,下列说法错误的是
A.镁条与醋酸反应的离子方程式为:
B.一段时间内瓶内压强的变化,可以体现化学反应速率的大小
C.镁条与盐酸反应过程中,有一段时间速率较快,可能是因为反应放热
D.反应结束时瓶内压强基本相等,说明产生基本相同
9.(2023春·云南昆明·高三北大附中云南实验学校校考期中)一定温度下,在2L密闭容器中,A、B、C三种气体的物质的量随时间变化的曲线如图所示,下列说法正确的是
A.a点时,v(A)=v(B)
B.5min时,反应停止
C.反应的化学方程式为3A(g)⇌2B(g)+C(g)
D.反应开始到5min,v(C)=0.04mol/(L·min)
10.(2023·全国·高三专题练习)3I-+S2O=I+2SO的反应速率可以用I与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如表:
实验编号
①
②
③
④
⑤
c(I-)/mol•L-1
0.040
0.080
0.080
0.160
0.160
c(S2O)/mol•L-1
0.040
0.040
0.080
c1
0.080
t/s
88.0
44.0
22.0
22.0
t2
下列说法不正确的是
A.该实验的目的是探究I-与S2O浓度对反应速率的影响
B.若在40℃下进行编号③对应浓度的实验,显色时间的范围为<22.0s
C.实验④c1=0.020mol•L-1
D.实验⑤显色时间t2=11s
11.(2023·全国·高三专题练习)某探究小组研究3S2O+2Cr3++7H2OCr2O+6SO+14H+的反应速率与浓度的关系。反应速率v(Cr3+)可通过测定c(Cr3+)减半所需时间来确定。在一定温度下,获得如表实验数据:
实验编号
c(S2O)/mmol•L-1
c(Cr3+)/mmol•L-1
c(Ag+)/mmol•L-1
时间/min
①
0.10
10.0
5.0
10
②
0.10
10.0
2.5
20
③
0.20
10.0
5.0
5
④
0.10
5.0
5.0
5
分析以上数据所得出的结论不正确的是
A.增大c(Ag+),v(Cr3+)增大
B.同时增大c(S2O)和c(Cr3+),v(Cr3+)不变
C.增大c(S2O),v(Cr3+)增大
D.实验②的v(Cr3+)为0.5mmol•L-1•min-1
12.(2023·全国·高三专题练习)SiHCl3在催化剂作用下主要发生反应:2SiHCl3(g)SiH2Cl2(g)+SiCl4(g) ΔH=+48kJ•mol-1。已知:反应速率v=v正-v逆=k正x2SiHCl3-k逆xSiH2Cl2xSiCl4,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。
下列说法正确的是
A.343K时反应物的平衡转化率为21%
B.a点的反应速率小于b点的反应速率
C.343K时=
D.由323K的平衡转化率数据,不能计算323K的平衡常数K
13.(2022·浙江·高三期中)CO2捕获和转化可减少CO2排放并实现资源利用,原理如图1所示。反应①完成之后,以N2为载气,以恒定组成的N2、CH4混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到CO2,在催化剂上检测到有积碳。
下列说法不正确的是
A.t3之后,反应②不再发生,随后副反应也逐渐停止
B.t2时刻,反应②生成H2速率小于副反应生成H2的速率
C.反应①为CaO+CO2=CaCO3:反应②为CaCO3+CH4CaO+2CO+2H2
D.t1~t3,n(H2)比n(CO)多,且生成H2速率不变,可能有副反应CH4C+2H2
二、多选题
14.(2023春·山东青岛·高三统考期末)向体积均为的两恒容密闭容器中分别充入发生反应,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。下列说法正确的是
A.平衡常数:
B.a、c两点时X的转化率相等
C.甲容器中温度不再改变时说明反应已达平衡
D.内,乙容器反应的平均速率为
三、非选择题
15.(2023春·上海松江·高三上海市松江二中校考期中)工业上合成氮气:,其原料之一的氢气可通过如下反应得到:,1mol甲烷和1mol水蒸气的总能量小于1mol一氧化碳和3mol氢气的总能量。
(1)下列表示合成氨反应的速率中,反应最快的是 。
A. B.
C. D.
(2)在一个恒温恒容的密闭容器中进行合成氨反应,下列证据能判断反应已达平衡状态的是 。
A. B.气体密度不再变化
C.每消耗就同时消耗 D.混合气体的平均摩尔质量不再变化
(3)已知断开键需吸热,断开键需吸热,断开键需吸热。则氮气与氢气反应,每生成需要 。
A.吸热 B.吸热 C.放热 D.放热
(4)在一个密闭容器中进行的合成氨反应,达到平衡后改变一个条件,一段时间又达到平衡,此时测得氨气的浓度增大。下列可能的原因是 。
A.升高温度 B.降低温度 C.增大容器体积 D.缩小容器体积
(5)在体积不变的密闭容器中进行反应,测得的物质的量浓度随反应时间的变化如图所示,反应进行到时,生成的的物质的量为_________,以表示的平均反应速率为__________。此时,若再加入,则化学平衡将向___________反应方向移动,过程中正反应速率的变化为_______________。
(6)如图所示,上述反应进行到10min时,改变外界条件导致如图所示的变化,则所改变的条件可能是_________________。
16.(2023春·山西大同·高三大同一中校考阶段练习)回答下列问题:
(1)将一定量纯净的氨基甲酸铵置于恒容密闭真空容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:H2NCOONH4(s)2NH3(g)+CO2(g)。能判断该反应已经达到化学平衡的是______。
①v(NH3)正=2v(CO2)逆
②密闭容器中总压强不变
③密闭容器中混合气体的密度不变
④密闭容器中混合气体的平均相对分子质量不变
⑤密闭容器混合气体的总物质的量不变
⑥密闭容器中CO2的体积分数不变
⑦混合气体总质量不变
(2)一定条件下,在5L密闭容器内,反应2NO2(g)N2O4(g),NO2的物质的量随时间变化如表:
时间/s
0
1
2
3
4
5
n(NO2)/mol
0.040
0.020
0.010
0.005
0.005
0.005
①用N2O4表示0~2s内该反应的平均速率为_______mol/(L•s)。在第5s时,NO2的转化率为_______。在第2s时N2O4的体积分数为_______。
②为加快反应速率,可以采取的措施是_______。
a.升高温度 b.恒容时充入He(g) c.恒压时充入He(g) d.恒容时充入NO2
(3)已知:2N2O=2N2+O2,不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1______T2(填“>”、“=”或“<”)。当温度为T1、起始压强为p0,反应至t1min时,此时体系压强p=_______(用p0表示)。
17.(2023春·湖北宜昌·高三校联考期中)某温度下,在2 L恒容密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。回答下列问题:
(1)2min内,气体Z的平均反应速率为_______;平衡时,气体Y的体积分数为_______%。
(2)该反应的化学方程式可以表示为_______。
(3)1 min时,_______(填“>”或“<”或“=”,下同);2 min时,_______。
(4)反应达到平衡状态后,向容器中通入氩气,气体X的化学反应速率不变的原因是_______。
(5)若X、Y、Z均为气体(容器体积不变),下列能说明反应已达平衡的是_______(填字母)。
a.X、Y、Z三种气体的物质的量相等 b.混合气体的密度不随时间变化
c.容器内气体压强不变 d.反应速率
18.(2023春·福建福州·高三福建省福州屏东中学校考期中)按要求回答以下问题。
(1)已知1molNO2和1molCO反应生成CO2和NO过程中能量变化如图所示。
请写出NO2和CO反应的热化学方程式_____。
(2)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
该反应的化学方程式是_____。
(3)在某容积为2L的密闭容器中充入0.5molNO2和1molCO,在一定条件下发生反应:NO2+COCO2+NO,2min时,测得容器中NO的物质的量为0.2mol,则:
①该段时间内,用CO2表示的平均反应速率为_____。
②下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是_____(填字母序号)。
A.容器内气体的质量保持不变
B.NO2的物质的量浓度不再改变
C.NO2的消耗速率与CO2的消耗速率相等
D.容器内气体的物质的量保持不变
E.容器内气体压强保持不变
参考答案:
1.C
【详解】A.a点时,转化率为30%,此时生成的Z为0.6mol,Z的平均反应速率为,A错误;
B.温度越高反应速率越快,则b点的反应速率小于c点的速率,但5min时b点的转化率却大于c点,说明b点未达平衡,c点达平衡,Y的浓度:b>c,温度:b<c,故无法判断b、c两点(Y)大小关系,B错误;
C.c点达平衡,反应消耗,同时消耗molZ,C正确;
D.c点温度下,压缩体积,即增大压强,平衡正向移动,(X)增大,D错误;
故选C。
2.D
【详解】A.根据反应方程式,该时间段内,生成二氧化碳物质的量为2×0.05mol=0.1mol,依据反应速率,v(CO2)==0.01mol/(L·s),故A错误;
B.该反应为放热反应,根据反应方程式,该反应为气体物质的量减少的反应,即ΔS<0,根据ΔG=ΔH-TΔS,自发进行,需要ΔG<0,即低温下能自发进行,故B错误;
C.假设容器Ⅰ达到平衡,因为容器Ⅱ的温度高于容器Ⅰ,因此升高温度,平衡向逆反应方向进行,氮气物质的量小于0.05mol,现在是等于0.05mol,说明容器Ⅰ没有达到平衡,故C错误;
D.容器Ⅱ中平衡时氮气的物质的量为0.05mol,则二氧化碳的生成量为0.1mol,CO、NO的物质的量均为0.2mol-0.05mol×2=0.1mol,容积为1L,则平衡常数K=,若起始时,向容器Ⅱ中充入0.08mol NO、0.04molN2,2.8<5=K,反应将向正反应方向进行,故D正确;
故答案为D。
3.D
【详解】A.根据题表信息可知,当压强相同时,升高温度,NO达到相同转化率需要的时间长,故升高温度,反应速率变慢,A项错误;
B.根据题表信息可知,当温度相同时,增大压强,NO达到相同转化率需要的时间缩短,故增大压强,化学反应速率加快,B项错误;
C.根据题表信息,无法判断此时反应是否已经达到平衡,C项错误;
D.往一定容积的反应容器中充入2molNO和,在、30℃条件下,NO转化率达到50%所用时间为0.2s,若反应速率以表示,NO的反应速率为=5 mol/s,D项正确;
故选D。
4.D
【详解】A.①中0~20min内,v(CH4)=(0.5mol-0.25mol)/(2L×20min)=0.00625mol•L-1•min-1,NO2的降解速率为v(NO2)=2v(CH4)=0.0125mol•L-1•min-1,故A错误;
B.温度越高反应速率越大,实验数据可知0~20min内,实验①中CH4物质的量的变化量为0.25mol,实验②中CH4的变化量0.32mol,则实验②温度高,由实验数据可知实验控制的温度T1<T2,故B错误;
C.温度越高,反应速率越快,则0~10min内,CH4的降解速率①<②,故C错误;
D.T1、40min时,反应达到平衡,因T2温度较高,平衡时用时更少,所以表格中40min时T2对应反应已经达到平衡状态,故D正确;
故选D。
5.C
【详解】A.因为混合溶液中与等浓度,因此Ag+与Fe2+浓度相等,根据反应式可知,Ag+、Fe2+、Fe3+三者系数比为1:1:1,即三者变化量相等。若时刻未改变外界条件,则浓度商,因此此时该反应处于平衡状态, ,A错误;
B.该反应为放热反应,升温会导致平衡逆向移动,根据图像可知,时刻改变条件后,平衡正向移动,因此时刻改变的条件不是升温,B错误;
C.因为Ag+、Fe2+系数比为1:1,因此v(Fe2+)=v(Ag+),且,根据图像,=,=,因此,C正确;
D.根据图像,内的平均反应速率为,D错误。
故选C。
6.D
【分析】根据c点的三段式分析: 则平衡时容器气体的压强为:p(平衡)=×1.2pkPa,故有:p(HCHO)=×p(平衡)=××1.2pkPa=0.2pkPa,解得:x=0.5mol,故p(平衡)=pkPa,据此分析解题。
【详解】A.起始时容器内气体总压强为1.2pkPa,若5min时反应到达c点,由分析可知,则(H2)==0.1mol/(Lmin),A正确;
B.温度不变,化学平衡常数不变,故b点时反应的化学平衡常数与c点对应的平衡常数相等,由分析可知,c点平衡下,p(CO2)=×pkPa=0.2pkPa,同理:p(H2)=0.4pkPa,p(HCHO)=p(H2O)=0.2pkPa,故Kp== (kPa)-1==,B正确;
C.由题意可知,在恒温恒容的密闭容器中,若H2O的体积分数保持不变,则各物质的浓度保持不变,反应达到平衡状态,C正确;
D.c点时,,再通入和H2O,使二者的分压均增大,此时,平衡不移动,D错误;
故答案为:D。
7.C
【详解】A.参与基元反应1,在基元反应2生成,起到催化作用,A正确;
B.由图可知,基元反应1的方程式为:,B正确;
C.基元反应1为快反应,而基元反应2为慢反应,则基元反应1的活化能比基元反应2的低,C错误;
D.由图可知,基元反应1的方程式为:,基元反应2的方程式为:,基元反应1为快反应,而基元反应2为慢反应,则图示过程中,会发生变化,D正确;
故选C。
8.A
【详解】A.镁与醋酸溶液反应生成醋酸镁和氢气,反应的离子方程式为Mg+2CH3COOH=Mg2++2CH3COO—+H2↑,故A错误;
B.一段时间内瓶内压强的变化可以代表反应生成氢气的多少,从而体现化学反应速率的大小,故B正确;
C.镁条与盐酸的反应为放热反应,反应放出的热量使反应温度升高,使反应速率加快,所以镁条与盐酸反应过程中,有一段时间速率较快可能是因为反应放热,故C正确;
D.由图可知,反应结束时瓶内压强基本相等说明镁条与等体积等浓度的盐酸和醋酸溶液反应生成的氢气的量基本相同,故D正确;
故选A。
9.C
【详解】A. 由图可知,a点时,A、B两物质计量系数不同,反应速率不相等,选项A错误;
B. 5min时,反应达平衡,是动态平衡,不是反应停止,选项B错误;
C. 反应达到平衡时,A的物质的量由0.8 mol减少为0.2 mol,变化量为0.6 mol,A为反应物,B的物质的量由0增加到0.4 mol,变化量为0.4 mol,C的物质的量由0增加到0.2 mol,变化量为0.2 mol,B、C为生成物,化学反应计量系数之比等于反应体系中物质变化量之比,∆n(A):∆n(B) :∆n(C) =0.6 mol:0.4 mol:0.2 mol=3:2:1,则反应的化学方程式为:3A(g)⇌2B(g)+C(g),选项C正确;
D. 反应开始到5min,∆n(C)= 0.2 mol,υ(C) ==0.02 mol/(L·min),选项D错误;
答案选C。
10.C
【详解】A.由题目中表格数据可分析出c(I-)、c()浓度越大,反应速率越快,显蓝色所需时间越少,故实验目的应是研究反应物I-与的浓度对反应速率的影响,故A正确;
B.升高温度反应速率加快,所以显蓝色所需时间减少,40℃下进行编号③对应浓度的实验,显色时间t2的范围为<22.0s,故B正确;
C.对比数据组①和④,可以看到,(I-)增大到4倍时,反应时间为原反应时间的四分之一,即反应速率加快了4倍,所以c1=0.040mol•L-1,故C错误;
D.对比数据组①和②,可以看到,c()不变,c(I-)增大到2倍时,反应时间缩短了一半,即反应速率加快了一倍;对比数据组②和③,可以看到,c(I-)不变,c()增大到2倍时,反应时间缩短了一半,即反应速率也加快了一倍;对比数据组①和③,可以看到,c(I-)和c()均增大到2倍时,反应时间为原反应时间的四分之一,即反应速率加快了4倍。可见两个反应物的浓度和反应速率之间的数学关系是:反应物浓度每增加一倍,反应时间就减少一倍,对于两个反应物来说都是如此,可得出结论:反应速率与反应物起始浓度乘积成正比。对比实验①和⑤,实验⑤的c(I-)为实验①的4倍,而c()为实验①的2倍,则由此可计算实验⑤的反应时间应为实验①反应时间的,即t1=88s×=11s,故D正确;
故选:C。
11.D
【详解】A.对比①②组数据,可以判断出增大c(Ag+),v(Cr3+)增大,故A正确;
B.对比实验③和④,可知c()和c(Cr3+)加倍,时间不变,则反应速率v(Cr3+)不变,故B正确;
C.比较①③数据可以判断出,增大c(),时间减半,v(Cr3+)增大,故C正确;
D.实验②的v(Cr3+)==0.25mmol•L-1•min-1,故D错误;
故选:D。
12.C
【详解】A.该可逆反应为气体分子数不变且吸热的反应。则对于该可逆反应来说,温度升高,反应向正反应方向进行。根据题中t-SiHCl3%图,可知曲线a为343K时SiHCl3的转化率-时间曲线,曲线b为323K时SiHCl3的转化率-时间曲线。由分析可知,曲线a为343K时的变化曲线,由图可知,343K时反应物的平衡转化率为22%,A项错误;
B.由图可知,a、b两点的转化率相等,可认为各物质的浓度对应相等,而a点的温度更高,所以速率更快,即a点的反应速率大于b点的反应速率,B项错误;
C.由图可知,343K时SiHCl3的转化率为22%,设起始时SiHCl3的浓度为1mol/L,则根据反应方程式有:
平衡时v正=v逆,则k正x2SiHCl3=k逆xSiH2Cl2xSiCl4,则==,C项正确;
D.由图可知,323K时SiHCl3的转化率为21%,设起始时SiHCl3的浓度为1mol/L,由反应方程式可知:
该可逆反应的平衡常数K==0.0136,故由323K的平衡转化率数据,可以计算323K的平衡常数K,D项错误。
13.B
【详解】A.t3之后,CO的生成速率为0、氢气的生成速率逐渐减小,可知反应②不再发生,随后副反应也逐渐停止,故A正确;
B.反应②生成CO和氢气的速率相等,由图像可知,t2时刻,氢气的流速为2mol/min,CO的流速为1~2mol/min,则反应②生成H2速率大于副反应生成H2的速率,故B错误;
C.由题干信息可知,反应①为CaO+CO2=CaCO3:反应②为CaCO3+CH4CaO+2CO+2H2,故C正确;
D.t1~t3,n(H2)比n(CO)多,且生成H2速率不变,在催化剂上检测到有积碳,所以可能有副反应CH4C+2H2,故D正确;
选B。
14.CD
【详解】A.甲容器在绝热条件下随着反应的进行,压强先增大后减小,刚开始压强增大的原因是因为容器温度升高,说明上述反应过程为放热反应,所以甲温度高于乙,温度升高,平衡逆向移动,平衡常数减小,因此,A错误;
B.由A可知,上述密闭容器中的反应为放热反应,图中a点和c点压强相等,甲容器为绝热过程,乙容器为恒温过程,若两者气体物质的量相等,则甲容器压强大于乙容器压强,则说明甲容器中气体的总物质的量相比乙容器在减小,所以甲中c点气体的转化率大于乙中a点,B错误;
C.甲为绝热过程,可知甲容器中温度不再改变时说明反应已达平衡,C正确;
D.内,,乙容器中压强之比等于物质的量之比,,解得,,,D正确;
故选CD。
15.(1)A
(2)D
(3)C
(4)BD
(5) 1.0mol 0.30mol·L-1·min-1 正 突然增大,然后慢慢减小至不变
(6)升高温度或者及时分离出H2O蒸气
【详解】(1)根据反应速率之比等于化学计量系数比可知:
A.==, B.当==时,,C.当时,, D.==,故A表示的反应速率最快,故答案为:A;
(2)A.题干未告知N2和H2的反应速率正、逆反应,且N2和H2的系数不相等,当不能说明反应达到化学平衡,A不合题意;
B.反应过程中,容器体积不变,气体的质量不变,即气体的密度一直不变,故气体密度不再变化不能说明反应达到化学平衡,B不合题意;
C.消耗N2为正反应,消耗NH3为逆反应,根据系数可知,平衡时应该每消耗就同时消耗,C不合题意;
D.反应过程中气体的质量不变,气体的总物质的量在改变,即混合气体的平均摩尔质量一直在变,故混合气体的平均摩尔质量不再变化,说明反应达到化学平衡状态,D符合题意;
故答案为:D;
(3)已知断开键需吸热,断开键需吸热,断开键需吸热,则氮气与氢气反应,每生成时断键需要吸收的能量为:=1125kJ,形成化学键能够放出的能量为:=1173kJ,故每生成需要释放的能量为:1173kJ-1125kJ=48kJ,故答案为:C;
(4)在一个密闭容器中进行的合成氨反应,达到平衡后改变一个条件,一段时间又达到平衡,此时测得氨气的浓度增大。
A.由(3)分析可知,合成氨是一个放热反应,升高温度 平衡逆向移动,则NH3的浓度减小,A不合题意;
B.由(3)分析可知,合成氨是一个放热反应,降低温度平衡正向移动,则NH3的浓度增大,B符合题意;
C.合成氨是气体体积减小的方向,故增大容器体积即减小压强平衡逆向移动,NH3的浓度减小,C不合题意;
D.合成氨是气体体积减小的方向,缩小容器体积即增大压强平衡正向移动,且容器体积减小,则NH3的浓度增大,D符合题意;
故答案为:BD;
(5)由题干图像信息可知,反应进行到5min时,CH4浓度减小了1.00-0.50=0.50mol/L,根据反应方程式可知,CO的浓度增加了0.50mol/L,故生成的的物质的量为0.50mol/L×2L=1.0mol,生成的H2的浓度为1.50mol/L,则以H2表示的平均反应速率为=0.30mol·L-1·min-1,此时若再加入,即增大反应物浓度,则化学平衡将向正反应方向移动,过程中正反应速率的变化为突然增大,然后慢慢减小至不变,故答案为:1mol;0.3mol·L-1·min-1;正;突然增大,然后慢慢减小至不变;
(6)由题干图示信息可知,上述反应进行到10min时,改变外界条件后CH4的物质的量浓度慢慢减小后再不变,即平衡正向移动,结合题干信息:1mol甲烷和1mol水蒸气的总能量小于1mol一氧化碳和3mol氢气的总能量,即该反应正反应是一个吸热反应,则所改变的条件可能是升高温度或者及时分离出H2O蒸气,故答案为:升高温度或者及时分离出H2O蒸气。
16.(1)①②③⑤⑦
(2) 87.5% 60% ad
(3) > 1.25 p0
【详解】(1)①v(NH3)正=2v(CO2)逆时正逆反应速率相等,可以判断达到平衡状态;②容器体积恒定,当密闭容器中总压强不变时,可以判断达到平衡状态;③该反应固体分解产生气体,在恒容条件下反应,当密闭容器中混合气体的质量不变时,密度不变,可以判断达到平衡状态;④该反应固体分解产生气体,氨气和二氧化碳的物质的量之比始终为2:1,密闭容器中混合气体的平均相对分子质量一直不变,不能判断达到平衡状态;⑤密闭容器混合气体的总物质的量不变时,可以判断达到平衡状态;⑥该反应固体分解产生气体,氨气和二氧化碳的物质的量之比始终为2:1,密闭容器中CO2的体积分数始终不变,不能判断达到平衡状态;⑦该反应固体分解产生气体,混合气体总质量不变时,可以判断达到平衡状态;故选①②③⑤⑦;
(2)①用NO2表示0~2s内该反应的平均速率为:,;在第5s时,NO2的物质的量为0.005mol,转化率为:;在第2s时NO2的物质的量为0.010mol,转化的NO2的物质的量为(0.040-0.010)mol=0.030mol,生成的N2O4的物质的量为0.015mol,体积分数为:;
②a.升高温度可以加快反应速率;
b.恒容时充入He(g),不影响各物质浓度,反应速率不变;
c.恒压时充入He(g),各物质浓度降低,反应速减慢;
d.恒容时充入NO2,反应物浓度增大,反应速率加快;
故选ad;
(3)压强为p0时,T2温度下半衰期长,故反应温度低,故T1>T2;当温度为T1、起始压强为p0,反应至t1min时, N2O转化了一半,故可列出三段式:,体系压强p=0.5p0+0.5 p0+0.25p0=1.25 p0。
17.(1) 0.05 50
(2)
(3) > <
(4)向容器中充入氩气,反应物浓度未发生改变
(5)cd
【详解】(1)2min内,Z增加了0.2mol,则;平衡时气体的总物质的量为0.9mol+0.7mol+0.2mol=1.8mol,则气体Y的体积分数为,故答案为:0.05;50;
(2)X、Y在减小,Z从0开始增加,则X、Y是反应物,Z是生成物,Δn(X)=0.2mol,Δn(Y)=0.3mol,Δn(Z)=0.1mol,化学计量数之比等于物质的量变化之比,则该反应的化学方程式为,故答案为:;
(3)1 min时,反应正向进行,>;2min时反应达到平衡状态,正逆反应速率相等,且化学反应速率之比等于化学计量数之比,则<,故答案为:>;<;
(4)反应达到平衡状态后,向容器中通入氩气,增大体系压强,但反应物和生成物浓度不变,则气体X的化学反应速率不变,故答案为:向容器中充入氩气,反应物浓度未发生改变;
(5)可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变;
a.X、Y、Z三种气体的物质的量相等时,正逆反应速率不一定相等,该反应不一定达到平衡状态,故a不符合题意;
b.气体的质量和容器体积恒定,则该反应的密度始终不变,因此当混合气体的密度不随时间变化时,不能说明反应达到平衡状态,故b不符合题意;
c.该反应是气体体积减小的反应,随着反应的进行压强发生变化,因此当容器内气体压强不变时,反应达到平衡状态,故c符合题意;
d. 时,正逆反应速率相等,反应达到平衡状态,故d符合题意;
故答案为:cd。
18.(1)NO2(g)+CO(g)=CO2(g)和NO(g) ΔH=-234kJ/mol
(2)3X+Y2Z
(3) 0.05mol/(L·min) BC
【详解】(1)已知1molNO2和1molCO反应生成CO2和NO过程中能量变化如图所示,根据图像可知反应热为134kJ/mol-368kJ/mol=-234kJ/mol,所以NO2和CO反应的热化学方程式为NO2(g)+CO(g)=CO2(g)和NO(g) ΔH=-234kJ/mol。
(2)根据图像可知反应进行到5min时,X和Y的物质的量减少,是反应物,分别减少1mol-0.4mol=0.6mol、1mol-0.8mol=0.2mol,Z增加了0.5mol-0.1mol=0.4mol,Z是生成物,化学变化量之比是化学计量数之比,则X、Y、Z的化学计量数分别是3、1、2,所以该反应的化学方程式是3X+Y2Z。
(3)①2min时,测得容器中NO的物质的量为0.2mol,根据方程式可判断生成CO2的物质的量为0.2mol,该段时间内,用CO2表示的平均反应速率为=0.05mol/(L·min)。
②A.根据2可知容器内气体的质量始终保持不变,A不选;
B.NO2的物质的量浓度不再改变,说明正逆反应速率相等,达到平衡状态,B选;
C.NO2的消耗速率与CO2的消耗速率相等,即正逆反应速率相等,达到平衡状态,C选;
D.反应前后气体分子的化学计量数之和相等,因此容器内气体的物质的量始终保持不变,D不选;
E.反应前后气体分子的化学计量数之和相等,因此容器内气体压强始终保持不变,E不选;
答案选BC。
2024届高三新高考化学大一轮专题练习—化学反应的速率: 这是一份2024届高三新高考化学大一轮专题练习—化学反应的速率,共20页。试卷主要包含了单选题,非选择题等内容,欢迎下载使用。
2024届高三新高考化学大一轮专题练习-化学反应的速率: 这是一份2024届高三新高考化学大一轮专题练习-化学反应的速率,共20页。试卷主要包含了单选题,多选题,非选择题等内容,欢迎下载使用。
2024届高三新高考化学大一轮专题训练-化学反应的速率: 这是一份2024届高三新高考化学大一轮专题训练-化学反应的速率,共23页。试卷主要包含了单选题,非选择题等内容,欢迎下载使用。












