



化学必修第一册摩尔质量 气体摩尔体积优秀同步训练题
展开物质存在的状态有固态、液态、气态,它们都有一定的体积,本节课,我们聚集气体的体积。
请观察下面的图1—4,从宏观上分析,影响气体体积的因素有哪些?
请继续观察图5—8,从微观上分析,影响气体体积的因素有哪些?
学习聚焦
知识精讲
知识点01 影响物质体积的微观因素
从微观来角度看,物质体积的大小取决于构成这种物质的粒子的数目、粒子的大小和粒子之间的距离。
1. 固态、液态物质粒子之间的距离是非常小的,因此决定固体或液体体积的主要因素是构成物质的粒子的数目和粒子的大小。
2. 气态分子之间的距离远远大于分子本身的大小,因此决定气体体积的主要因素则是构成气体的分子的数目和分子之间的距离。
【即学即练1】已知阿伏加德罗常数、物质的摩尔质量及摩尔体积,下列物理量中,尚不能全部计算出其近似值的是
A.固体物质分子的大小和质量 B.液体物质分子的大小和质量
C.气体物质分子的大小和质量 D.气体物质分子的质量
知识点02 气体摩尔体积
1. 定义:单位物质的量的气体所占有的体积,叫做气体摩尔体积。
2. 符号:Vm
3. 单位:L·ml-1(或L/ml)
4. 数值:在标准状况(温度为0℃,压强为101 kPa)下,气体摩尔体积为22.4L/ml
5. 计算公式:V=n·Vm
说明:①气体摩尔体积只适用于气体,不适用于固体和液体;②22.4 L/ml指的是标准状况下的气体摩尔体积,是气体摩尔体积的一个特例;③在非标准状况下不能使用22.4 L/ml,但同时改变温度和压强,气体摩尔体积也有可能是22.4 L/ml。
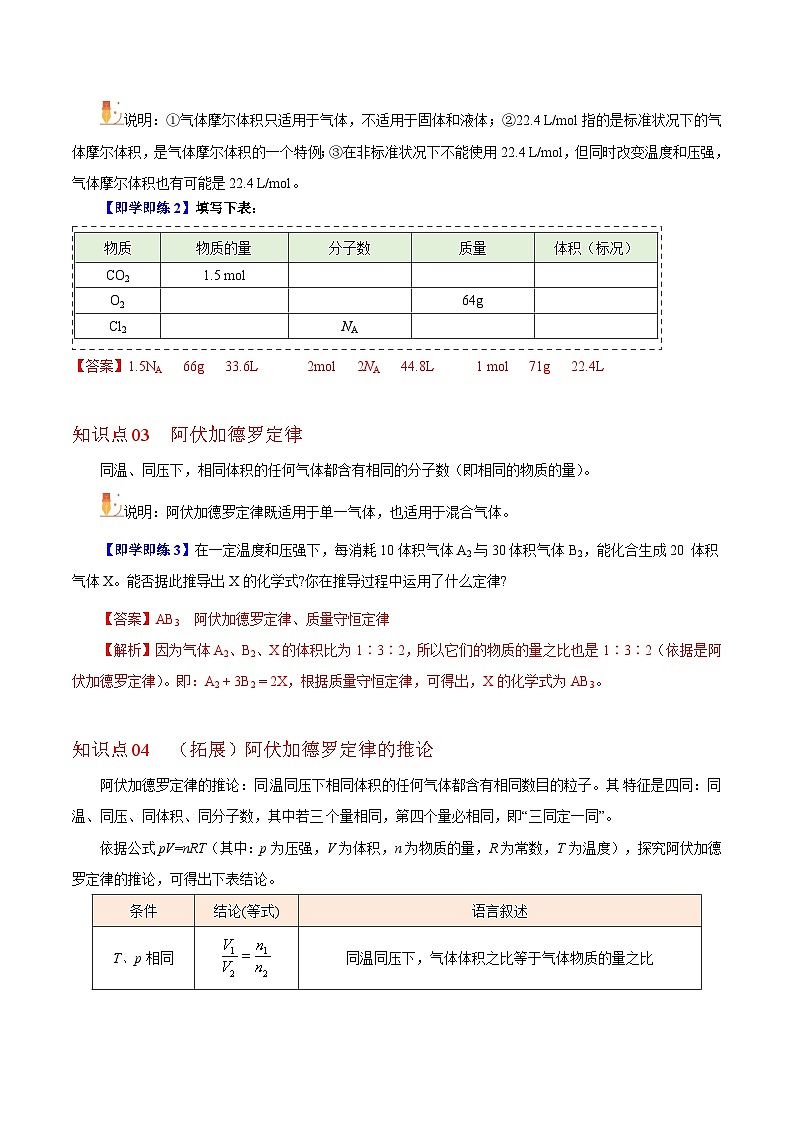
【即学即练2】填写下表:
物质
物质的量
分子数
质量
体积(标况)
CO2
1.5 ml
O2
64g
Cl2
NA
知识点03 阿伏加德罗定律
同温、同压下,相同体积的任何气体都含有相同的分子数(即相同的物质的量)。
说明:阿伏加德罗定律既适用于单一气体,也适用于混合气体。
【即学即练3】在一定温度和压强下,每消耗10体积气体A2与30体积气体B2,能化合生成20 体积气体X。能否据此推导出X的化学式?你在推导过程中运用了什么定律?
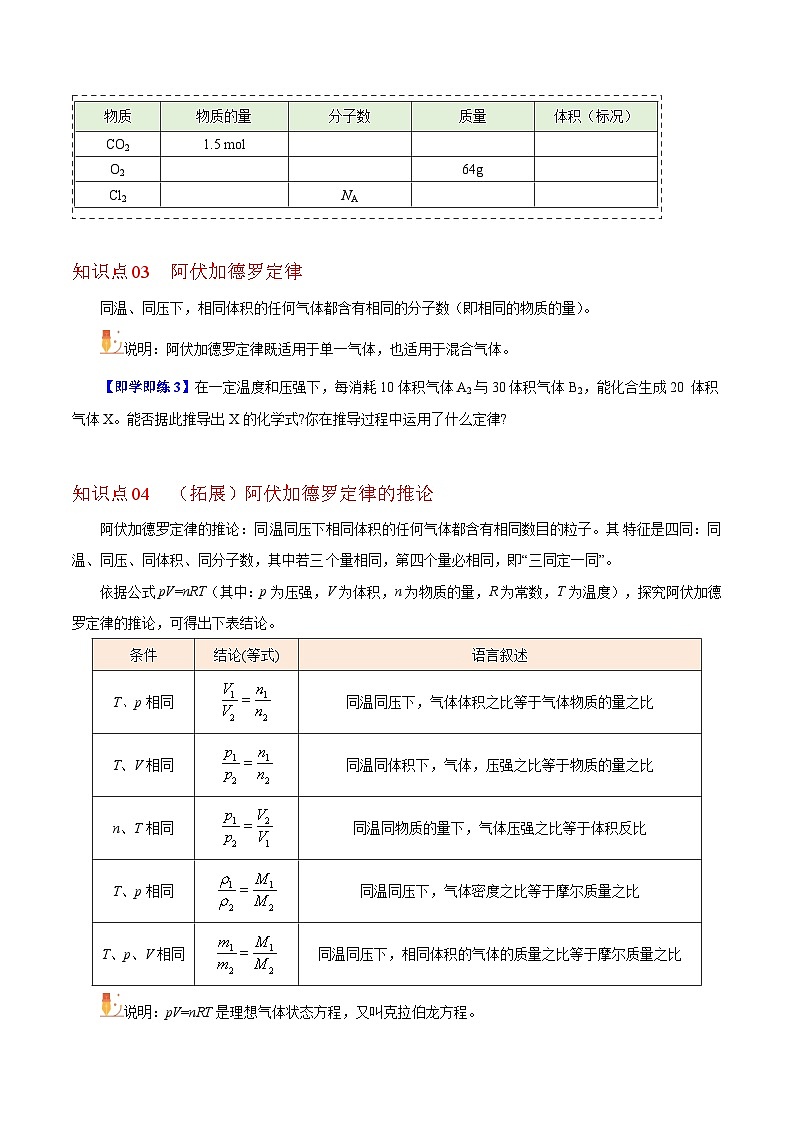
知识点04 (拓展)阿伏加德罗定律的推论
阿伏加德罗定律的推论:同温同压下相同体积的任何气体都含有相同数目的粒子。其特征是四同:同温、同压、同体积、同分子数,其中若三个量相同,第四个量必相同,即“三同定一同”。
依据公式pV=nRT(其中:p为压强,V为体积,n为物质的量,R为常数,T为温度),探究阿伏加德罗定律的推论,可得出下表结论。
说明:pV=nRT是理想气体状态方程,又叫克拉伯龙方程。
【即学即练4】在三个密闭容器中分别充入Ne、H2、O2 三种气体,当他们的温度和密度都相同时,这三种气体的压强(p)由大到小的顺序是
A.p(H2)>p(Ne)>p(O2) B.p(O2) >p(Ne)>p(H2)
C.p(H2)>p(O2) >p(Ne ) D.p(Ne)>p(H2) >p(O2)
常见考法
常见考法一 影响物质体积大小的因素
【例1】(上海市七宝鑫都期中)下列五种因素:①温度和压强;②微粒数目;③微粒本身大小;④微粒间的距离;⑤气体分子的相对分子质量,其中决定气态物质体积的主要因素有
A. ②③④ B. ②④⑤ C. ①③④ D. ①②④
必杀技
【同步练习1】相同物质的量的各固体或液体的体积并不相同,其主要原因是
A.粒子大小不同 B.粒子质量不同
C.粒子间距离不同 D.粒子的状态不同
常见考法二 气体摩尔体积
【例2】下列说法正确的是
A.气体的摩尔体积为22.4L·ml-1
B.1 ml H2的质量是2 g,它所占的体积是22.4 L
C.在标准状况下,22.4 L酒精的物质的量为1 ml
D.在标准状况下,1 ml空气的体积约为22.4 L
必杀技
标准状况下的气体摩尔体积:
【同步练习2】下列有关气体体积的叙述中,正确的是
A.在一定的温度和压强下,各种气态物质体积大小由构成气体分子大小决定
B.在一定的温度和压强下,各种气态物质体积的大小由物质的量多少决定
C.不同的气体,若体积不同,则它们所含的分子数一定不同
D.气体摩尔体积是指1 ml任何气体所占的体积约为22.4L
常见考法三 阿伏加德罗定律
【例3】(上海市市西中学期末)很多食品包装袋内填充有氮气或二氧化碳以延长食品的保质期。在相同体积的食品包装袋内分别填充同温、同压的N2和CO2,则其中的N2和CO2具有相同的
A.质量 B.原子数 C.密度 D.分子数
必杀技
阿伏加德罗定律可以简单理解为“三同定一同”
【同步练习3】温度和压强相同时,在体积相同的两个密闭容器甲和乙,甲中充满O2气体,乙中充满O2和O3的混合气体,下列说法正确的是
A.两容器中气体的质量相等 B.两容器中气体的分子数目相等
C.两容器中气体的氧原子数目相等 D.两容器中气体的密度相等
常见考法四 阿伏加德罗定律及推论
【例4】标准状况下,m g气体A与n g气体B所含分子数相同,下列说法不正确的是
A.A与B相对分子质量之比为m︰n
B.同质量的A与B所含分子数之比为n︰m
C.相同状况下,同体积的A与B的质量之比为m︰n
D.标准状况下,A与B的密度之比为n︰m
必杀技
1.对阿伏加德罗定律的“三点”理解
①适用于任何气体,包括混合气体,不适用于非气体。
②同温、同压、同体积、同分子数,共同存在,相互制约,且“三同定一同”。
③标准状况下的气体摩尔体积是阿伏加德罗定律的一个特例。
2.公式“pV=nRT”的应用
阿伏加德罗定律的推论可据公式pV=nRT或pV =RT进行推导,其中p为压强(单位Pa),V为体积(单位L),n为物质的量(单位ml),m为物质的质量(单位g),M为物质的摩尔质量(单位g·ml−1),R为常数,T为绝对温度(单位K)。
【同步练习4】同温同压下,a g甲气体和2a g乙气体所占体积之比为1∶2,根据阿伏加德罗定律判断,下列叙述不正确的是
A.同温同压下甲和乙的密度之比为1∶1
B.甲与乙的相对分子质量之比为1∶1
C.同温同体积下等质量的甲和乙的压强之比为1∶1
D.等质量的甲和乙中的原子数之比一定为1∶1
常见考法五 平均相对分子质量和相对密度
【例5】在标准状况下,8.96L的甲烷和一氧化碳的混合气体的质量为7.6g,则该混合气体的平均相对分子质量为 ,相对于H2的密度为 。将该混合气完全燃烧,需要相同条件下的O2 L。
必杀技
(1)气体密度(ρ)和相对密度(D)的计算:
①任何状况下,ρ = m/V;
②标准状况下,=;
③气体的相对密度:D ==。
(2)气体的相对分子质量的计算方法:
①已知标准状况下气体密度(ρ),M = 22.4ρ;
②已知两气体的相对密度(D),MA = D·MB;
③已知混合气体的总质量和总物质的量,=;
④已知各气体的体积分数,= MA·φA + MB·φB + ……(φA、φB为MA、MB的体积分数)
【同步练习5】在体积为1L的干燥容器中充入HCl气体后,测得容器中气体对氧气的相对密度为1.082。将此盛气体的容器倒扣在水中,进入容器中液体的体积为
A.0.25L B.0.5L C.0.75L D.1L
分层提分
题组A 基础过关练
1.(上海市金陵中学期中)“标准状况”是指
A.0℃,101.3kPaB.0℃,101.3Pa
C.20℃,101.3kPaD.20℃,101.3Pa
2.(上海市奉贤中学期中)标准状况下,2.8 L O2含有n个氧分子,则阿伏加德罗常数的值为
A.n/8 B. n/16 C. 16n D. 8n
3.(上海市市西中学期中)下列不是决定物质体积的因素
A.微粒类别 B.微粒大小 C.微粒间距 D.微粒多少
4.(上海市市西中学期中)下列有关气体摩尔体积的描述正确的是
A.单位物质的量的物质所占的体积就是气体摩尔体积
B.通常状况下,气体摩尔体积约为22.4 L·ml-1
C.标准状况下,气体摩尔体积约为22.4 L·ml-1
D.标准状况下,1摩尔水的体积约为22.4 L QUOTE
5.(上海市市西中学期中)常温常压下,下列体积最大的是
A.1ml H2SO4 B.6.02×1024个N2分子 C.36.5 g HCl D.30.0 g H2
6.(上海市曹杨中学期中)在同温同压下,10 mL气体A2和30 mL气体B2完全化合生成20 mL气体C,则气体C的化学式为
A.AB3 B.A2B C.A2B6 D.AB6
7.(上海市曹杨中学期中)在标准状况下,一氧化碳和二氧化碳的混合气体5.6 L,如果一氧化碳的质量为5.6 g,则二氧化碳的质量为
A.4.4g B.2.2g C.0.44g D.0.22g
8.(上海市曹杨中学期中)在同温同压下,等质量的二氧化硫和二氧化碳相比,下列叙述正确的是
A.体积之比: 11:16 B.密度之比:11:16
C.物质的量之比:1:1 D.分子数之比:1:1
9.(上海市曹杨中学期中)在标准状况下,下列物质中所含分子数最多的是
A.6.72 L H2O B.16 g SO2 C.4.4 g CO2 D.3.36 L O2
10. (上海市青浦一中期中)同温同压下,甲容器充满了H2,乙容器充满了NH3,如果两者氢原子个数相等,则这两个容器的体积比为
A. 3:2 B. 2:3 C. 1:1 D. 3:1
11.(上海市奉贤致远高中)在标准状况下,两个容积相同的储气瓶中分别盛有氧气和甲烷,则两瓶气体具有相同的
A. 质量 B. 原子总数 C. 密度 D. 分子数
12.下列叙述正确的是
A. 同温同压下,相同体积的物质,它们的物质的量必相等
B. 任何条件下,等物质的量的乙烯和一氧化碳所含的分子数必相等
C. 1 L一氧化碳气体一定比1 L氧气的质量小
D. 等体积、等物质的量浓度的强酸中所含的H+数一定相等
13.下列说法错误的是
A.1 g O2和1 g O3所含有的原子数相同
B.1 ml SO2在20 ℃时的体积比22.4 L大
C.标准状况下,22.4 L由N2和N2O组成的混合气体中含有的氮原子数约为2NA
D.任何状况下,1 ml CO2与1 ml H2O所含分子数和原子总数相等
14.在一定温度和压强下,1 L X气体和1 L Y气体完全反应后生成1 L水蒸气和1 L氮气。X、Y两种气体是
A.H2、N2O4 B.H2、N2O3
C.H2、N2O D.H2、NO2
15.在标准状况下,18 g CO与CO2的混合气体,体积为11.2 L。则:
(1)混合气体的密度是________;
(2)混合气体的平均摩尔质量是_______;
(3)CO与CO2的体积之比是_________;
(4)CO与CO2的质量之比是__________;
(5)混合气体中所含碳原子的物质的量是________。
题组B 能力提升练
16.(上海市曹杨中学期中)下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量可忽略不计)。其中能表示等质量的氢气与氦气的是
A. B. C. D.
17.(上海市进才中学期中)某气体物质经测定其蒸汽密度折合成STP下约为1.518 g/L,该物质可能是
A.HClB.SO2C.H2SD.O2
18.(上海市上师附外期中)在标准状况下,称量一个充满Cl2的容器质量为74.6g,若改充氮气其质量为66g,则容器的容积为
A.11.2L B.5.6L C.4.48L D.2.24L
19.(上海市静安七一期中)如图所示,甲、乙、丙常温下都为气体,2 ml甲反应生成1 ml丙和3 ml乙,下列判断不正确的是
A.1个乙分子中含有2个H原子
B.甲的摩尔质量为17 g·ml-1
C.同温同压下,生成丙和乙的体积比为1:3
D.化学反应中各物质的质量之比等于2:1:3
20.(上海市松江二中期中)某物质A在一定条件下加热完全分解,产物都是气体。分解方程式为2AB+2C+2D,测得生成的混合气体对氢气的相对密度为4d,则A的相对分子质量为
21.(上海市市西中学期中)A、B两元素的的双原子分子能相互化合成C。已知B2的式量是A2的两倍,反应时,A2与B2的质量之比为3∶2。符合此条件反应的化学方程式是
A.3A2 +B2 = 3A2B B.3A2+B2 = 2A3B
C.3A2+2B2 = 2A3B2 D.A2+ 3B2 = 2AB3
22. (上海市向明中学期中)(已知:H2+Cl2 eq \(\(\s\up6(_____),\s\up4(_____)),\s\up6(点燃))2HCl)由H2、Cl2、O2组成的混合气体,在一定条件下恰好完全反应生成盐酸(无气体剩余),则原混合气体中H2、Cl2、O2的物质的量之比可能是
A.3∶2∶1B.6∶1∶2C.5∶3∶1D.7∶4∶1
23.下列叙述中正确的是
A.相同条件下,N2和O3的混合气体与等体积的N2所含原子数相等
B.等物质的量的CHeq \\al(+,5)和OH-所含电子数相等
C.常温常压下,28 g CO与22.4 L O2所含分子数相等
D.16 g CH4与18 g NHeq \\al(+,4)所含质子数相等
24.(上海市市西中学期中)CO和CO2的混合气体18 g,完全燃烧后测得CO2体积为11.2 L(标准状况)。试回答:
(1)混合气体中CO的质量是 g
(2)混合气体中CO2在标准状况下的体积是多少 L
(3)等质量CO和CO2分子个数比是 ;原子个数比是 ;等温等压下体积比是 。
题组C 培优拔尖练
25.(上海市进才中学期中)某温度下,在体积一定的密闭容器中,适量氨气和氯气恰好完全反应。若反应产物只有氮气和氯化铵固体,则反应前后容器中压强比接近于
A.7:11 B.11:7 C.1:11 D.11:1
26.(上海市上师大闵行分校期中)同温同压下,不同体积的密闭容器中分别有相同质量的甲、乙两种气体,且ρ甲>ρ乙。下列分析正确的是
A.物质的量:甲<乙 B.分子数:甲>乙
C.摩尔体积:甲<乙 D.摩尔质量:甲<乙
27. (上海市松江一中期中)如图所示,气缸的总体积一定,内部被活塞隔成I、II两部分,活塞可以自由移动,也可以固定。25℃时向I中充入8 g SO2,II中充入8 g O2,则下列说法正确的是
A.当活塞不再移动时,I、II两部分体积比为1∶2
B.当活塞不再移动时,I、II两部分密度比为1∶1
C.当活塞固定在气缸中间,I、II两部分压强比为1∶1
D.当活塞固定在气缸中间,I、II两部分压强比为2∶1
28. (上海市静安七一期中)在一个恒温、恒容密闭容器中,有两个可左右自由滑动的密封隔板(a、b),将容器分成三部分,已知充入的三种气体质量相等,当隔板静止时,容器内气体所占体积如图所示,下列说法中错误的是
A. 若Y是O2 ,则X可能是CH4
B. 分子数目:X=Z=2Y
C. 若X是N2,则Z可能是CO
D. 气体密度:X=Z=2Y
29.一定质量的液态化合物XY2,在标准状况下的一定质量的O2中恰好完全燃烧,反应方程式为:
XY2(l) + 3O2(g) = XO2(g) + 2YO2(g),冷却后,在标准状况下测得生成物的体积是672 mL,密度是2.56 g·L-1,则:
(1)反应前O2的体积是 。
(2)化合物XY2的摩尔质量是 。
(3)若XY2分子中X、Y两元素的质量比是3∶16,则X、Y两元素分别为 和 (写元素符号)。
30.对一定量气体体积的探究。已知1ml气体在不同条件下的体积:
(1)从上表分析得出的结论:
①1ml任何气体,在标准状况下的体积都约为_______L。
②1ml不同的气体,在不同的条件下,体积_______(填“一定”“一定不”或“不一定”)相等。
(2)理论依据:相同条件下,1ml任何气体的体积几乎相等,原因是:
①气体分子数目_______(填“相等”或“不等”)
②相同条件下,气体分子间的平均距离_______(填“差距较大”“几乎相等”或“无法确定”)。
(3)应用:在标准状况下,4 g O2的体积为_______L(写出计算过程)。1
2
3
4
5
6
7
8
条件
结论(等式)
语言叙述
T、p相同
同温同压下,气体体积之比等于气体物质的量之比
T、V相同
同温同体积下,气体,压强之比等于物质的量之比
n、T相同
同温同物质的量下,气体压强之比等于体积反比
T、p相同
同温同压下,气体密度之比等于摩尔质量之比
T、p、V相同
同温同压下,相同体积的气体的质量之比等于摩尔质量之比
A.10d
B.2d
C.5d
D.20d
化学式
条件
1ml气体体积/L
H2
0℃,101kPa
22.4
O2
0℃,101kPa
22.4
CO
0℃,101kPa
22.4
H2
0℃,202kPa
11.2
CO2
0℃,202kPa
11.2
N2
273℃,202kPa
22.4
NH3
273℃,202kPa
22.4
高中化学沪科技版(2020)必修第一册摩尔质量 气体摩尔体积当堂检测题: 这是一份高中化学沪科技版(2020)必修第一册摩尔质量 气体摩尔体积当堂检测题,共9页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
高中沪科技版(2020)化学反应焓变的计算精品练习: 这是一份高中沪科技版(2020)化学反应焓变的计算精品练习,文件包含122化学反应焓变的计算学生版沪科版2020选择性必修第一册docx、122化学反应焓变的计算教师版沪科版2020选择性必修第一册docx等2份试卷配套教学资源,其中试卷共29页, 欢迎下载使用。
【同步讲义】高中化学(鲁科版2019)必修第一册--第05讲 气体摩尔体积 讲义: 这是一份【同步讲义】高中化学(鲁科版2019)必修第一册--第05讲 气体摩尔体积 讲义,文件包含同步讲义高中化学鲁科版2019必修第一册--第05讲气体摩尔体积学生版docx、同步讲义高中化学鲁科版2019必修第一册--第05讲气体摩尔体积教师版docx等2份试卷配套教学资源,其中试卷共17页, 欢迎下载使用。













