





第15讲 溶液的配制与物质的分离-2023-2024学年新八年级科学暑假精品课 试卷
展开第15讲 溶液的配制与物质的分离

- 溶液的配制
- 结晶分离
- 过滤与蒸馏

一.溶液的配制
1.溶质的质量分数
(1)定义:表示溶液中溶质质量与总溶液质量的比值,可用小数或百分数表示。
(2)溶质质量分数可以表示溶液中溶质的含量多少,符号P。
(3)有关计算公式 溶质的质量分数=![]() ×l00%=
×l00%=![]() ×l00%
×l00%
2.溶液的配制:
步骤:计算、称量或量取、溶解、装瓶贴标签
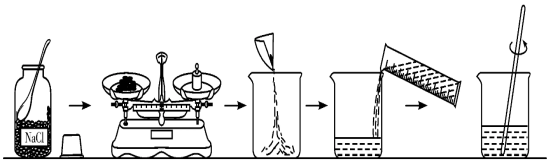
3.误差分析
(1)溶质质量分数偏小:
①天平使用不正确,使药品称量质量偏小。
②量取水的过程中仰视读数,使水量取多了。
③烧杯不干燥,原来内部就有一些水。
④固体药品中含有杂质等。
(2)溶质质量分数偏大:
①天平使用不正确,如称量前没有调平衡,指针偏右,导致药品称量偏多。
②砝码已生锈,导致药品称量偏多。
③量取水的过程中俯视读数,使水量取少了。
④将量筒中的水倒入烧杯中时,一部分洒在外面等。
二.溶液的基础计算
1.溶液的稀释:使用高浓度溶液配制低浓度溶液,稀释的过程中,溶质质量分数不变即P浓 × M浓= P稀×M稀
2.溶液质量:(1)溶液密度与体积乘积 (2)溶质质量除以溶质质量分数
3.溶解度与饱和溶液溶质质量分数的关系:P =![]() ×100%
×100%
三.物质的结晶
1.晶体和非晶体
(1)晶体有固定的熔点和凝固点,而非晶体则没有固定的熔点和凝固点;
(2)晶体有规则的几何外形,而非晶体则没有固定的几何外形。
2.晶体的形成
(1)蒸发结晶:一般适用于溶解度受温度影响较小的物质。
蒸发为了浓缩溶液,减少溶剂,溶质析出(剩余少量液体时关火,利用余温蒸干)
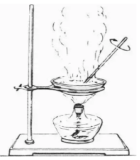
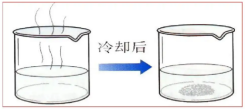
(2)冷却热饱和溶液:适用于溶解度受温度影响较大的物质。
温度降低溶解度降低,溶质析出
四.常见的分离方法
1.沉淀法:加入明矾或活性炭作凝聚剂吸附水中的悬浮杂质,使其凝聚成较大的固体颗粒而沉到水底。这种使水中的杂质沉淀到水底的方法称为沉淀法。
2.过滤:
(1)定义:利用装置把体积不同的物质分离(中学的过滤即为分离不溶的固体和液体)
(2)需要的仪器:玻璃棒、烧杯、漏斗、滤纸、铁架台。
(3)过滤器的制作:将圆形滤纸两次对折,成为 1/4 圆形,,然后一边一层另外一边三层从中间拉开成锥形。放入漏斗,使滤纸润湿,紧贴漏斗内壁,不残留气泡。

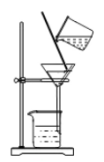
(4)过滤的操作要求:要做到“一贴、二低、三靠”
“一贴”指:滤纸紧贴漏斗内壁;
“二低”指:滤纸低于漏斗口、液体低于滤纸上沿;
“三靠”指:漏斗下端紧靠烧杯内壁、玻璃棒末端轻靠在有三层滤纸一侧、上面烧杯嘴紧靠玻璃棒中下部。
3.蒸馏:
(1)定义:利用液体沸点不同,先汽化,再液化之后液体分离
(2)装置:
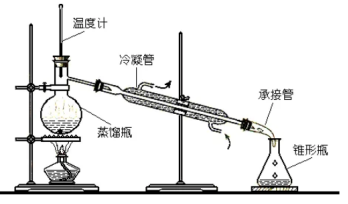
(3)注意:冷凝水从下向上流,温度计在支管口
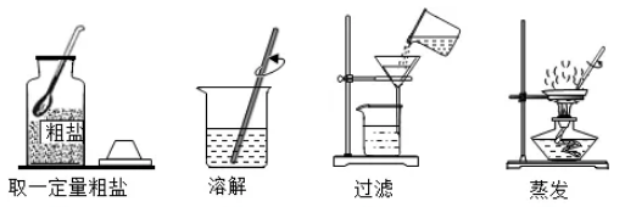
五.粗盐提纯
1.实验目的:除去粗盐中的不溶性固体
2.实验器材:烧杯、玻璃棒、蒸发皿、酒精灯、漏斗、药匙、量筒、铁架台(带铁圈)、滤纸、天平等
3.实验步骤:
(1)溶解:称取适量粗盐置于烧杯,加入蒸馏水,搅拌至固体不再溶解
(2)过滤:将溶解后的混合物进行过滤
(3)蒸发:滤液置于蒸发皿中,边加热边搅拌蒸发结晶(剩余少量液体停止加热)。
六.自来水的净化


![]() 考点一:溶液的配制
考点一:溶液的配制
【例1】农业上常用溶质质量分数为16%的![]() 溶液选种,如图所示为实验室配制
溶液选种,如图所示为实验室配制![]() 该溶液的过程。下列分析错误的是( )
该溶液的过程。下列分析错误的是( )

A.正确的实验操作顺序为④②①⑤③
B.③中玻璃棒的作用是搅拌,加快溶解
C.在称量![]() 的过程中,若天平指针左偏,应向右移游码
的过程中,若天平指针左偏,应向右移游码
D.再用量筒量取水时仰视读数,会使得溶液的质量分数偏小
【例2】如图是配制50g质量分数为5%的氯化钠溶液的操作过程示意图:
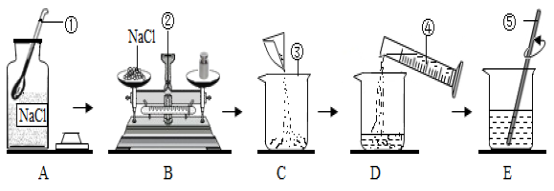
(1)B操作,在称量中发现指针偏向左边,接下来的操作是___________;
(2)E操作中玻璃棒的作用是___________。
(3)如果配制过程中出现以下情况,可能导致所配溶液的溶质质量分数偏小的是___________。
A.所用氯化钠药品不纯 B.配完后将溶液转移至试剂瓶时洒出了一些
C.量取水时仰视读数 D.将量好的水从量筒里倒入烧杯时,洒出一些水
![]() 考点二:结晶分离
考点二:结晶分离
【例1】如图是粗盐提纯的相关实验操作,以下说法不正确的是( )

A.正确实验操作步骤为①②③④ B.步骤②溶解应该在烧杯中进行
C.步骤②③④中玻璃棒的作用不完全相同 D.步骤④当水分全部蒸发之后再熄灭酒精灯
【例2】某学习小组开展了“制作棒棒糖"的项目化学习,过程如下:

(1)“快速晾干筷子,析出少量晶体”是通过___________的方法结晶的。
(2)制作棒棒糖时,小明将蔗糖加入热水中,用筷子稍作搅拌,观察到杯底还留有蔗糖固体,接着就进行过滤等后续操作,5天后却没有制得棒棒糖,杯中也没有晶体析出。棒棒糖制作失败的原因:最初配制的蔗糖溶液是___________溶液(选填“饱和”或“不饱和”)。
![]() 考点三:过滤与蒸馏
考点三:过滤与蒸馏
【例1】下图为自来水生产过程示意图。下列说法正确的是( )
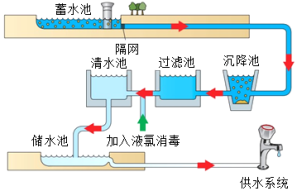
A.清水池中的清水是纯净物 B.供水系统流出的水可直接饮用
C.消毒过程中发生的主要是化学变化 D.水经过过滤池后可溶性杂质可以明显减少
【例2】如图是我们学过的蒸馏装置,关于蒸馏实验说法不正确的是( )
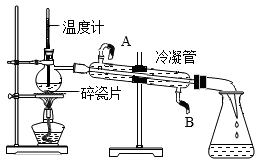
A.蒸馏是我们所学的净化水的最彻底方式 B.图中冷凝水的流动方向是A→B
C.温度计应该放在蒸馏烧瓶的支管口,测气体温度 D.烧瓶中碎瓷片的作用是防止液体暴沸

1.由太湖水生产自来水的部分处理过程如下。有关说法不正确的是( )
![]()
A.用细沙“过滤”可滤除水中的细小颗粒 B.用活性炭“吸附”可除去水中的色素和异味
C.上述处理过程应包含“蒸馏” D.经过处理获得的自来水仍是混合物
2.如图为过滤实验装置图,过滤时,对各项操作过程有明确的要求,若没有按要求操作,可能会导致得到的滤液比较浑浊。下列操作肯定不会导致滤液变浑浊的是( )
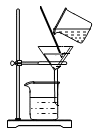
A.漏斗下端没有紧靠烧杯内壁 B.玻璃棒紧靠一层滤纸处
C.烧杯没有紧靠玻璃棒 D.漏斗中液面高于滤纸边缘
3.通过下列实验操作不能达到相应目的是( )
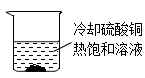
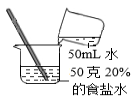

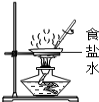
A.获取硫酸铜晶体 B.配制10%的食盐水 C.获取纯净水 D.获取氯化钠晶体
4.如图是茶水分离保温杯示意图,按压茶杯按钮,泡好的茶水便会从隔离层缝隙间流出,茶叶留在茶仓从而实现茶水分离,得到一杯清茶。这种功能类似于物质分离方法中的( )

A.沉淀法 B.过滤法 C.蒸发法 D.结晶法
5.下列关于结晶和晶体的说法,错误的是( )
A.饱和溶液降温析出晶体后的溶液仍然是饱和溶液
B.降低饱和溶液的温度不一定有晶体析出
C.结晶是溶液中无法再溶解的固体溶质以晶体的形式从溶液中析出的过程
D.把溶液的溶剂蒸发一些一定会有晶体析出
6.如图是利用海水提取粗盐的过程,下列说法中正确的是( )
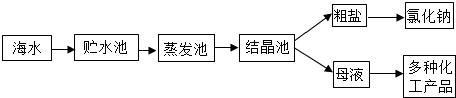
A.海水进入贮水池,海水中不含有杂质 B.在蒸发池中,海水中水的质量逐渐减少
C.析出晶体后的母液是氯化钠的不饱和溶液 D.在蒸发池中,海水中的氯化钠质量逐渐增加
7.如图是海水淡化的装置,下列有关海水淡化的说法,合理的是( )
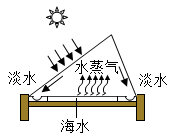
A.海水淡化过程中,水分子本身发生了改变
B.海水淡化的原理与实验室过滤操作相同
C.海水暴晒一段时间后,剩余海水中食盐的质量分数会变大
D.海水淡化获得的淡水属于溶液
8.下列实验操作中玻璃棒的作用与其他三组不同的是( )
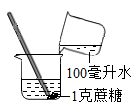
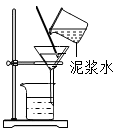
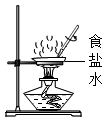

A.配制蔗糖溶液 B.过滤泥水 C.获取氯化钠晶体 D.配制 10%的食盐水
9.粗盐提纯需经过称量、溶解、过滤、蒸发等操作,下列图示对应的操作规范的是( )
A. 称量B.
称量B.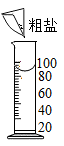 溶解C.
溶解C.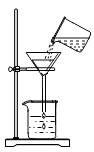 过滤 D.
过滤 D. 蒸发
蒸发
10.在淡水缺乏的海岛上,可利用图所示简易装置从海水中获取淡水。下列说法错误的是( )
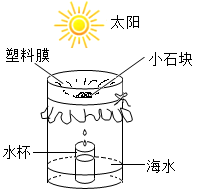
A.水杯中的水是淡水 B.从海水中获取淡水是物理变化
C.海水通过活性炭吸附也能获取淡水 D.获取淡水的快慢与温度有关
11.测定粗盐纯度,需经过称量、溶解、过滤、蒸发结晶下列操作规范的是( )
A. 称量B.
称量B. 溶解C.
溶解C. 过滤 D.
过滤 D.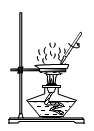 蒸发结晶
蒸发结晶
12.利用下列实验操作完成了两个实验。甲实验为去除粗盐中的难溶性杂质,乙实验为配制一定质量分数的氯化钠溶液。下列说法错误的是( )
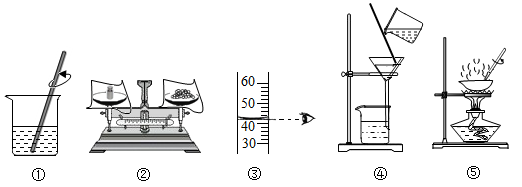
A.甲实验的步骤是:①—④—⑤ B.乙实验的步骤是:计算—②—③—①
C.步骤②的操作方法可以导致最后结果偏小 D.步骤⑤要等基本不含水分后停止加热
13.某小组开展自制净水器的项目化学习,如图是项目小组同学制作的净水器,用到小卵石、活性炭、石英砂三种材料,为获得较好的净水效果,则图中的a、b、c三处的材料依次是( )
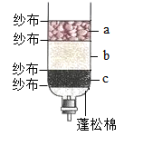
A.小卵石、活性炭、石英砂 B.活性炭、小卵石、石英砂
C.小卵石、石英砂、活性炭 D.活性炭、石英砂、小卵石
14.校园里的直饮水机中的水通过多级净化,师生可以放心直饮。水处理的主要步骤如图甲所示。步骤②中反渗透膜是直饮水机的核心技术,反渗透膜上的孔径只有0.001~0.001微米,相当于一根头发丝的百万分之一,能阻拦微生物通过。下列叙述中正确的是( )
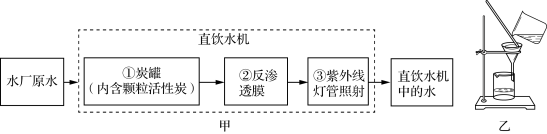
A.步骤①中活性炭具有杀菌作用 B.师生喝的直饮水是纯净物
C.步骤②的原理与图乙所示操作相似 D.图乙中玻璃棒可以省略
15.石墨烯之父海姆带领的科研团队研制出氧化石墨烯薄膜制成“筛子”,能够很好地筛掉海水中的盐类物质。当海水流过该膜时,钠离子和氯离子被水分子包裹而不能通过,独立的水分子却能通过(如下图)下列关于氧化石墨烯膜“筛掉”氯化钠的说法错误的是( )

A.“筛掉”氯化钠过程类似于过滤操作 B.该过程可应用于海水蒸馏
C.该过程属于物理变化 D.右侧海水的溶质的质量分数增大
16.小灵同学配制质量分数为10%的氯化钠(NaCl)溶液50g。其步骤如图所示,下列说法正确的是( )
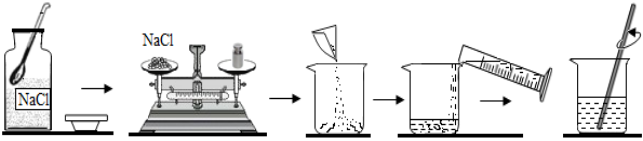
A.图中的实验步骤均操作无误
B.部分氯化钠固体从药匙中撒落,将会影响配制的溶液的溶质质量分数
C.用量筒量取所需的45ml的水时,如果仰视刻度线,会导致配制的溶液的溶质质量分数偏低
D.等氯化钠充分溶解后,如有液体从烧杯中溅出,将会影响配制的溶液的溶质质量分数
17.2021年3月12日温州市初中毕业生进行综合素质测评之实验操作考查,小科同学抽到的实验是配制50克5%的NaCl溶液,下列操作会导致所配溶液溶质质量分数大于5%的是( )
A.称取氯化钠 B.转移氯化钠时,有固体洒出 C.量取水 D.装瓶时,有液体洒出
18.下列混合物的分离方法不正确的是( )
A.泥沙和食盐(溶解和过滤) B.水和酒精的混合物(蒸馏)
C.食盐和硝酸钾(降温结晶) D.汽油和水(过滤)
19.为研究物质的溶解与结晶,在实验室某同学将100g硝酸钾固体放入60℃的100g水中,充分溶解后得溶液甲,然后对该溶液进行如下操作:
![]()
根据如图硝酸钾的溶解度曲线,请回答:
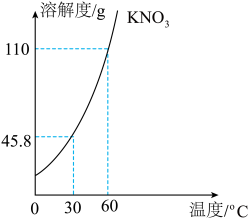
(1)60℃硝酸钾的溶解度为___________g。
(2)溶液乙的质量为___________g,丙、丁溶液溶质的质量分数关系是丙___________丁(填“<”、“>”或“=”)以上四种溶液属于不饱和溶液的是___________。
(3)通过以上实验可知,结晶的方法通常有___________。
20.实验是科学探究的重要途径,请根据如图回答相关问题。
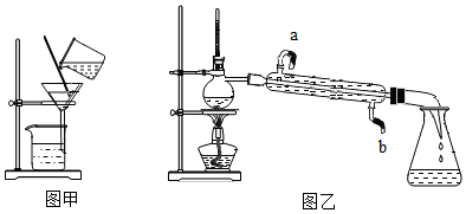
(1)图甲的操作中玻璃棒的作用是___________。如果处理后液体仍然浑浊,可能原因___________(答出一点即可)。
(2)图乙进行的是___________操作,烧瓶中放入一些碎瓷片的目的是___________,冷凝管中冷水应该是从___________进入(填“a”或“b”)。
21.某兴趣小组的同学做粗盐(含有难溶性杂质)提纯实验,并用所得的精盐配制50克20%的氯化钠溶液。请回答下列有关问题:
实验一:以下是同学们做粗盐提纯实验的操作示意图。
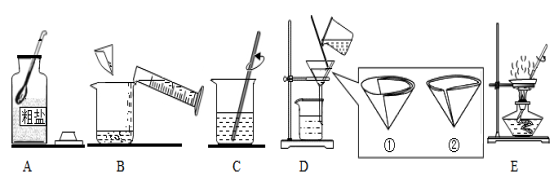
a.图C中玻璃棒的作用是___________。
b.图D为过滤装置,其漏斗中滤纸的放置方向应为___________(填序号)。
实验二:用提纯后得到的精盐配制了氯化钠溶液,经检测,溶质质量分数偏小,其原因可能有___________(填序号)。
A.氯化钠固体仍然不纯
B.用量筒量取水时,仰视读数
C.配制好的溶液装瓶时,有少量溶液洒出
22.某科学兴趣小组的同学进行粗盐提纯实验,请回答下列问题:
(1)为了除去粗盐中泥沙等不溶性杂质,小组同学设计了如图三个步骤。请给这些步骤排序___________。(填字母)
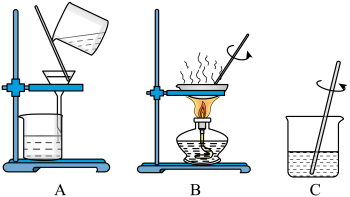
(2)玻璃棒在A操作中的作用是___________。
(3)经操作A后滤液仍浑浊,可能的原因是___________。(答出一点即可)
23.在实验室配制溶液时,常涉及以下过程:溶解,称量,计算,装瓶贴标签存放。请按要求回答问题。
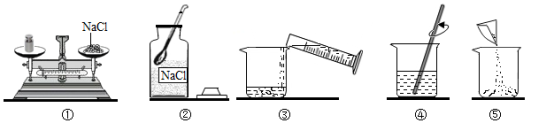
(1)现欲配制50g 0.9%的氯化钠溶液,配制溶液的正确操作顺序为___________(填序号),其中操作错误的是___________(填序号)。
(2)操作应选用量程为___________mL的量筒(从10mL、50mL、100mL中选择)。用正确操作称取氯化钠固体时,发现指针偏右,接下来的操作应该是___________。
(3)经检测,该同学配制的溶液溶质质量分数偏小,可能的原因是___________。(填字母)
A.氯化钠固体不纯 B.用生锈砝码称量 C.装瓶时有少量溶液洒出
D.溶解时烧杯内壁有水珠 E.量取水时仰视读数
24.科学兴趣小组的同学做粗盐(只含有难溶性杂质)提纯实验,并用所得的精盐配制6%的氯化钠溶液50g。回答下列问题:
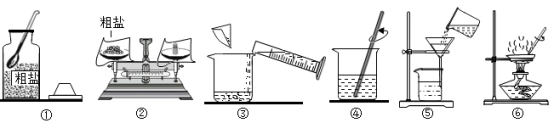
实验一:粗盐提纯
(1)如图中操作有错误的是___________(填数字序 号)。
(2)操作⑥中,当观察到蒸发皿中___________时,停止加热。
(3)海水晒盐采用如图操作⑥的原理,不采用冷却氯化钠浓溶液的方法,原因是氯化钠的溶解度___________。
实验二:用提纯得到的精盐配制6%的氯化钠溶液50g
(4)计算。计算出需要氯化钠质量和蒸馏水的体积。
(5)称量、量取。量取水的体积时,若仰视读数,所配溶液的溶质质量分数会___________6%(填“>”“<”或“=”)。
(6)溶解。
(7)装瓶、 贴标签。








