





第14讲 溶液与物质的溶解-2023-2024学年新八年级科学暑假精品课 试卷
展开第14讲 溶液与物质的溶解

- 溶液及其分类
- 物质的溶解性
- 溶质质量分数与溶解度

一.溶液:
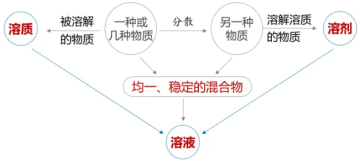
1.定义:一种或几种物质分散到另一种物质里形成的均一的、稳定的混合物,叫做溶液
(形成溶液的过程叫做溶解)
2.性质:
(1)均一性:指溶液中各部分的性质都相同;
(2)稳定性:指外界条件不变时,溶液长时间放置不会分层,也不会析出固体溶质
3.组成:
(1)溶质:被溶解的物质。可以是一种或几种,可以是固体,液体或气体。
(2)溶剂:能溶解其他物质的物质。
(3)溶剂和溶质的判断:
①固体或气体与液体混合形成的溶液,一般以液体作为溶剂
②两种液体混合之后,一般以质量大的做溶剂;
③混合的物质中有水,一般以水为溶剂;
④一般将溶液命名为“溶质的溶剂溶液”,当不指明溶剂时,溶剂为水。
4.溶液的质量与体积:
(1)M溶液 = M溶质 + M溶剂
(2)V溶液 ≠ V溶剂 + V溶质
5.溶液的理解:
(1)溶液一定是混合物,但混合物不一定是溶液
(2)溶液一定是均一、稳定的,但均一、稳定的液体不一定是溶液
(3)溶液不一定是无色的,但溶液一定是透明的,无色透明的液体也不一定是溶液
(4)溶液可以含多种溶质,不局限于一种
6.常见的溶液及成分:
溶液 | 溶质 | 溶剂 |
澄清的石灰水 | Ca(OH)2 | H2O |
稀/浓盐酸 | HCl | H2O |
稀/浓硫酸 | H2SO4 | H2O |
紫药水 | KMnO4 | H2O |
食盐水、生理盐水 | NaCl | H2O |
碘酒 | 碘 | 酒精 |
二.悬浊液、乳浊液
1.悬浊液:是固体小颗粒悬浮在液体里而形成的物质。
2.乳浊液:是小液滴分散到液体里形成的物质。
3.浊液:悬浊液和乳浊液合称,它们的特点是不均一、不稳定。
4.常见的悬浊液:面糊、泥水、石灰乳、血液
5.常见的乳浊液:牛奶,油水混合物
三.物质的溶解性
1.溶解的定义:一种物质均匀分散到另一种物质的过程。
2.溶解性:一种物质溶解在另一种物质里的能力。
3.物质溶解的能力:在一定条件下,物质能够溶解的数量是有限的。
4.影响物质溶解性的因素(实验注意控制变量)
①不同物质在同一溶剂中的溶解能力不同。
②同种物质在不同溶剂中的溶解能力不同。
③同种物质在同一溶剂中温度不同溶解能力不同。
5.固体物质溶解度的影响因素
①溶质种类 ②溶剂种类
③温度:a.绝大部分物质的溶解度随温度的升高而升高;如硝酸钾、硝酸铵
b.少部分物质的溶解度随温度的变化不大;如氯化钠(食盐)
极少部分物质的溶解度随温度的升高而降低;如氢氧化钙(熟石灰)
6.气体物质溶解度的影响因素
①溶质种类 ②溶剂种类
③温度:气体的溶解度随温度的升高而降低 ④压强:气体的溶解度随压强的增大而增大
- 物质溶解时的温度变化
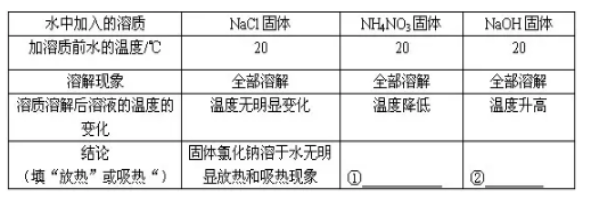
①有的物质溶解时,会放出热量,使溶液温度显著升高,如氢氧化钠、浓硫酸等。
②有的物质溶解时,会吸收热量,使溶液温度显著降低,如NH4NO3
③有许多物质溶解时,溶液的温度没有明显变化,如NaCl等。
二.饱和溶液与不饱和溶液:
(1)定义:一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时即为该溶质的饱和溶液。
(2)在描述饱和溶液和不饱和溶液的时候,一定要强调:
①一定温度; ②一定量的溶剂; ③某种溶质。
(3)判断方法:
①观察法:若溶液底部有剩余溶质存在,且溶质的量不再减少,则该溶质的饱和溶液;
②实验法:若底部无剩余,加入该溶质,溶解或溶解一部分,不饱和;不再溶解,饱和。
(4)转化:
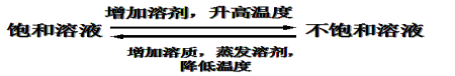
三.物质的溶解度
(1)定义:在一定温度下,某物质在 100g 溶剂中达到饱和状态时所溶解的溶质的质量,称为该物质在这种溶剂中的溶解度。
(2)四要素:①一定温度; ②100g 溶剂; ③达到饱和状态; ④溶质质量。
(3)符号是 S,单位是 g。
(4)物质的溶解性:根据物质的溶解度大小,我们将物质的溶解性分为以下四种:
溶解度 | 易溶 | 可溶 | 微溶 | 难溶 |
20℃溶解度 | >10g | 1g~10g | 0.01g~1g | <0.01g |
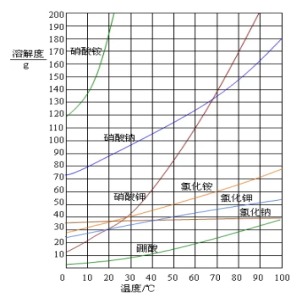
一.溶解度曲线及其意义
1.溶解度曲线:记录不同温度下物质的溶解度,用图像表示变化
2.溶解度曲线的意义:
(1)曲线上每个点表示某温度下某溶质的溶解度;
(2)溶解度曲线表示同一物质在不同温度时的不同溶解度数值;
(3)曲线表示不同物质在同一温度时的溶解度数值;
(4)曲线表示物质的溶解度受温度变化影响大小的情况;
(5)两条曲线的交点,表示在该温度下两种物质的溶解度相等;
(6)曲线上每个点所配制的溶液是该温度下这种溶质的饱和溶液,曲线下方的点表示对应温度下该溶质的不饱和溶液。


![]() 考点一:物质的溶解
考点一:物质的溶解
【例1】下列物质依次为溶液、悬浊液、乳浊液的一组是( )
A.石灰水、泥浆水、汽水 B.汽水、碘酒、肥皂水
C.矿泉水、泥浆水、肥皂水 D.酒精、牛奶、硫酸钡(钡餐)
【例2】如表是某同学做溶液形成的实验记录:下列说法正确的是( )
溶质 | 碘 | 高锰酸钾 | |||
溶剂 | 水 | 汽油 | 酒精 | 水 | 汽油 |
溶解性 | 不溶 | 易溶 | 可溶 | 易溶 | 不溶 |
A.汽油、酒精都不可以作溶剂 B.不同溶质在同一种溶剂中的溶解性不同
C.同一物质在不同溶剂中的溶解性相同 D.衣服上不慎沾上碘酒可用水擦洗
![]() 考点二:物质的溶解性
考点二:物质的溶解性
【例1】如图是某品牌“一摇冰”功能饮料,该饮料罐在夏天能制冷,罐底中的固体是( )
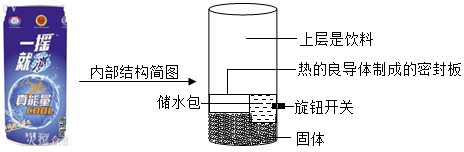
A.氢氧化钠 B.氯化钠 C.硝酸铵 D.蔗糖
【例2】概念图能清晰地反映概念之间的联系,如图表示溶液中部分概念的相互联系。下列说法错误的是( )
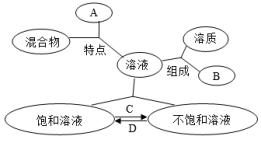
A.A表示均一、稳定 B.B表示溶剂 C.C方法可为蒸发溶剂 D.D方法可为增加溶质
![]() 考点三:质量分数与溶解度
考点三:质量分数与溶解度
【例1】向盛有等质量水的甲、乙、丙三个烧杯中分别加入15g、30g、30g蔗糖固体,充分搅拌后静置,现象如图所示。下列说法正确的是( )
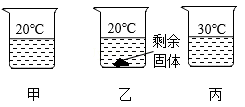
A.可采用升温的方法使乙烧杯中剩余的固体溶解 B.甲、丙烧杯中的溶液一定属于不饱和溶液
C.乙、丙烧杯中溶质的质量分数相等 D.蔗糖的溶解度随温度的升高而减小
【例2】甲、乙两种物质的溶解度曲线如图所示,下列叙述正确的是( )
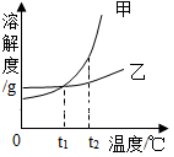
A.当甲中含有少量乙杂质时,可以通过蒸发结晶提纯甲
B.将甲、乙的饱和溶液从t1℃降到t2℃,析出甲的质量大
C.将t2℃时甲的饱和溶液变为不饱和溶液,可采用降温的方法
D.将t2℃时甲、乙饱和溶液降温到t1℃时,两种溶液的溶质质量分数相同

1.小宇将下列厨房中的物质放入足量的水中,充分搅拌,形成乳浊液的是( )
A.食用油 B.白醋 C.白糖 D.面粉
2.下列影响固体物质溶解性大小的因素是( )
①溶质的多少 ②溶质的性质 ③溶剂的多少 ④溶剂的性质
⑤溶液是否饱和 ⑥是否搅拌 ⑦温度
A.全部 B.②④⑦ C.②④⑤⑦ D.②③④⑤⑥
3.常温下,将盛有硝酸钾饱和溶液的试管插入盛有冰水混合物的烧杯中,如图所示。下列说法正确的是( )
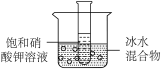
A.试管内溶液中溶质的质量不变 B.试管内溶液总质量不变
C.硝酸钾的溶解度不变 D.试管内水的质量不变
4.20℃时,在盛有100g水的甲、乙两个烧杯中,分别加入30克的A、B两种物质,充分搅拌后,现象如图所示,下列说法正确的是( )
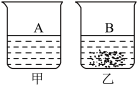
A.烧杯甲中的溶液一定是不饱和溶液
B.烧杯乙中溶液质量是130克
C.烧杯甲中溶液降温过程中,溶液溶质质量分数可能不变
D.温度相同时,A物质的溶解度一定大于B物质
5.下表是不同温度时硝酸钾的溶解度,下列有关说法正确的是( )
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/克 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
A.20℃的硝酸钾饱和溶液一定比60℃的硝酸钾饱和溶液溶质质量分数小
B.20℃时,100克水中溶解的硝酸钾越多溶解度就越大
C.40℃时,100克硝酸钾饱和溶液中含有硝酸钾63.9克
D.100℃时水中溶解的硝酸钾一定比80℃时水中溶解的硝酸钾多
6.一定温度下,对固体甲的溶液进行恒温蒸发,实验记录如图:根据上述实验,得到的错误结论是( )
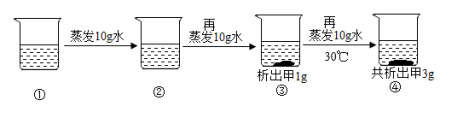
A.③④溶液为饱和溶液 B.④中再加15g水又可以将析出固体完全溶解
C.不能确定固体甲的溶解度随温度的变化情况 D.①~④溶液的溶质质量分数:①<②<③<④
7.如图,这是市面上常见的感冒药,食用前需要将药粉倒入水中充分溶解。下面几个选项中能作为判断溶解后的感冒药溶液是饱和溶液的依据是( )
A.该溶液颜色很深 B.该溶液味道很苦
C.感冒药溶解的很快 D.感冒药固体有剩余
8.把一定量的硝酸铵固体加入装有蒸馏水的烧杯中,不断搅拌,用温度传感器记录溶解过程的温度变化(如图),实验中发现:a点烧杯中固体完全消失,b点有固体出现。由此可知( )

A.硝酸铵固体溶于水是放热过程 B.硝酸铵固体的溶解度随温度升高而增大
C.a点时,该溶液一定是不饱和溶液 D.c点时,烧杯中也一定有固体
9.硫酸镁在工农业以及医疗上有广泛应用,其溶解度如表所示,则下列说法正确的是( )
温度(℃) | 10 | 30 | 50 | 70 | 90 |
溶解度(g) | 27.7 | 39.3 | 49.0 | 54.1 | 51.1 |
A.硫酸镁的溶解度随温度升高而增大
B.10℃时,27.7g硫酸镁和72.3g水可配制成质量分数为27.7%的硫酸镁溶液
C.50℃时,100g的硫酸镁饱和溶液中溶质和溶剂的质量比为49:100
D.70℃时的硫酸镁饱和溶液升温至90℃,溶液的溶质质量分数增大
10.t℃时,根据某物质在不同质量的水中达到饱和状态时所溶解的质量绘制成下图中的斜线。下列说法正确的是( )
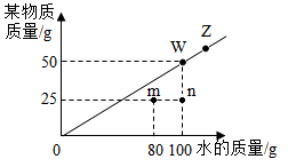
A.该物质的溶解度随温度的升高而增大 B.t℃时该物质的溶解度为50
C.n点表示溶液中溶质的质量分数为25% D.图中4个点表示的溶液中溶质质量分数的关系是:n<m<W=Z
11.高氯酸钾可用作火箭推进剂,它的溶解度随温度升高而增大。如图是有关高氯酸钾溶液的实验操作及变化情况。下列说法正确的是( )
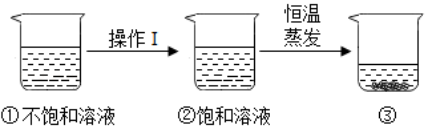
A.操作I一定是加溶质 B.②溶液质量一定小于①溶液质量
C.②与③的溶质质量分数一定相等 D.②中溶解的溶质多,所以溶解性比③强
12.甲、乙两种固体物质的溶解度曲线如图所示,据图判断下列说法正确的是( )
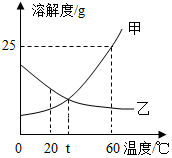
A.甲物质的溶解度大于乙温度
B.20℃时,等质量的甲、乙饱和溶液中甲的溶剂质量比乙小
C.60℃时,甲的饱和溶液的溶质质量分数为25%
D.将60℃时甲、乙的饱和溶液降温至t℃,溶液的溶质质量分数:甲>乙
13.某固体物质的溶解度曲线如图所示,在100g水中加入120g固体,充分搅拌,在不同温度下存在①②③④四种状态。对这四种状态的描述正确的是( )
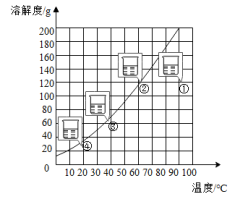
A.四种状态均为饱和溶液 B.状态①降温至10℃,有110g晶体析出
C.质量分数:状态③>状态② D.状态④升温再蒸发掉部分水,质量分数可能与状态①相同
14.在分别盛有100g水的烧杯中分别加入![]() 固体充分溶解(如图所示),已知40℃时
固体充分溶解(如图所示),已知40℃时![]() 的溶解度为63.9g,60℃时
的溶解度为63.9g,60℃时![]() 的溶解度为110g。下列说法错误的是( )
的溶解度为110g。下列说法错误的是( )
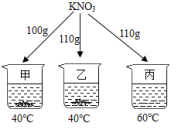
A.甲、乙、丙均为饱和溶液 B.甲、乙溶液的溶质质量分数相等
C.将丙溶液降温到40℃,析出![]() 固体 D.溶液质量的大小关系为甲<乙=丙
固体 D.溶液质量的大小关系为甲<乙=丙
15.温度不变,对100L氯化钠饱和溶液进行如下实验(如图所示)。实验一将烧杯甲中溶液转移出50mL到乙烧杯中。实验二是把5g水和5g氯化钠分别加入在甲、乙烧杯中,则下列结论不正确的是( )
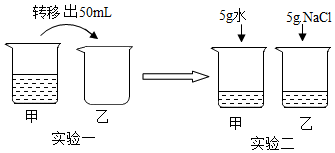
A.实验二后,乙溶液溶质质量分数增大 B.实验一后,甲和乙中溶质质量分数相等
C.实验二后,甲溶液变为不饱和溶液 D.实验二后,甲和乙溶液中溶质质量相等
16.将氢氧化钠固体加入到一定量蒸馏水中,不断搅拌,用温度传感器记录溶解过程中的温度变化,结果如图所示。图中a、c两点观察到溶液中有固体存在,b点固体完全消失。以下分析错误的是( )
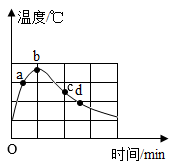
A.氢氧化钠固体溶于水会放热 B.a点时溶液质量分数比b点小
C.b点的溶液一定是饱和溶液 D.d点时的溶解度与c点时不同
17.甲、乙两种固体物质的溶解度曲线如图所示,据图判断下列说法正确的是( )

A.甲物质的溶解度大于乙
B.60℃时,甲的饱和溶液的溶质质量分数为25%
C.20℃时,甲溶液质量分数一定小于乙溶液的质量分数
D.将60℃时甲、乙的饱和溶液降温至t℃,溶液的溶质质量分数:甲>乙
18.现有一瓶溶质质量分数为10%的食盐水,关于该食盐水的说法正确的是( )
A.m质∶m剂=1∶10 B.m质∶m液=1∶10 C.m质∶m液=1∶11 D.m剂∶m液=10∶11
19.下列物质中,属于溶液的是( )
A.生理盐水 B.豆浆 C.蒸馏水 D.血液
20.下列物质中,不属于溶液的是( )
A.食盐水 B.矿泉水 C.蒸馏水 D.冰汽水
21.下列有关溶液和物质的溶解叙述中,合理的是( )
A.均一、稳定的液体一定是溶液 B.不同的物质分散到水中都会形成溶液
C.溶剂的种类不会影响物质的溶解性 D.氢氧化钠固体溶解于水会放出热量
22.下列关于溶液、悬浊液、乳浊液的说法( )
①溶液一定是无色透明的液体;②溶液是纯净物,而浊液是混合物;③溶液是均一稳定的;④浊液对生产有害无利;⑤浊液中分散的都是固体小颗粒;⑥浊液都是不均一、不稳定的;⑦在条件不变的情况下,溶液静置多久都不分层;⑧由水和酒精构成的溶液中,酒精既可作溶质,也可作溶剂。其中正确的是( )
A.①③④⑤⑥⑧ B.②⑤⑥⑧ C.③⑥⑦ D.全正确
23.下列物质:①冰水混合物 ②食用油滴入水中,搅拌 ③白酒 ④钡餐 ⑤铁粉放入水中,搅拌 ⑥油脂放入汽油中,搅拌 ⑦碘酒。其中属于溶液的是______(填序号,下同)属于悬浊液的是______,属于乳浊液的是______。
24.在复习过程中通过绘制思维导图将知识形成一个彼此联系的知识网络,有利于深刻领会知识间的内在联系,实现有效复习。
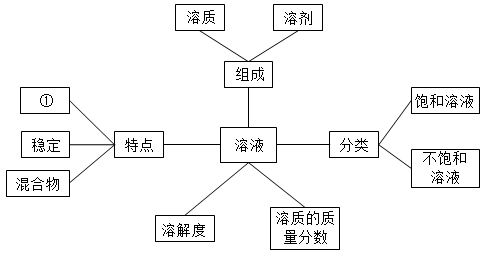
(1)如图是有关溶液的部分思维导图,请在①_________处填上恰当的内容。
(2)根据图中溶液特点,判断下列混合物属于溶液的是_________。
A.蔗糖水B.医用酒精C.肥皂水D.血液








