


【培优导学案】浙教版科学九年级全册:1、常见酸与酸的性质 学案(含解析)
展开常见酸与酸的性质
【回顾】
一、酸的特性
1.盐酸的挥发性与盐酸的浓度有关:浓度越大挥发性越强,稀盐酸也有挥发性。
2.浓硫酸的特性
(1)吸水性:可用于干燥某些酸性或中性的气体,如CO2、H2、N2、NO2、HCl、SO2等;不能干燥碱性气体,如NH3,以及常温下具有还原性的气体,如H2S。
(2)脱水性:能把植物纤维等物质中的氢元素和氧元素“脱出”,结合成水,使一些有机物碳化变黑。
(3)强氧化性:与金属反应时一般不能生成氢气,与碳反应生成CO2、气体污染物SO2。
3.浓硝酸的特性:易挥发;强氧化性,不仅能和活泼金属反应,还能和一些不活泼金属反应,但产生的是氮的氧化物,不会产生氢气。
二、酸的通性
1.使指示剂变色:使紫色石蕊试液变红,使蓝色石蕊试纸变红。
2.酸+某些活泼金属―→盐+氢气。
3.酸+某些金属氧化物―→盐+水。
4.酸+碱―→盐+水。
5.酸+某些盐―→新酸+新盐。
强酸制取弱酸,指的是较强酸(可以是强酸或弱酸)可生成较弱酸。即:
强酸+弱酸盐―→弱酸+强酸盐
(1)盐酸与硝酸银反应:HCl+AgNO3===HNO3+AgCl↓,有白色沉淀生成,加入硝酸,沉淀不溶解。
提示:AgCl是不溶于稀硝酸的白色沉淀,所以可用AgNO3溶液和稀硝酸检验盐酸或氯离子的存在。
(2)硫酸与氯化钡反应:H2SO4+BaCl2===2HCl+BaSO4↓,现象是生成白色沉淀。
提示:BaSO4是不溶于稀硝酸的白色沉淀,因此可以利用BaCl2溶液和稀硝酸检验硫酸或硫酸根离子的存在。
6.除杂问题中试剂的选择
弱酸(或弱酸的酸酐)中含有较强酸(或较强酸的酸酐)杂质,通常选择弱酸所对应的酸式盐,利用强酸制弱酸的原理除去杂质。如下表所示:(酸酐指含氧酸脱去一分子或几分子水,剩下的部分)
物质 | 杂质 | 所选试剂 | 化学方程式 |
CO2 | HCl | 饱和NaHCO3溶液 | NaHCO3+HCl===NaCl+CO2↑+H2O |
![]()
例1 在化学课上,同学们围绕浓硫酸的化学性质进行了如下实验探究:将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀。然后加入适量浓硫酸,迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,并放出有刺激性气味的气体。请回答:
(1)生成的黑色物质(单质)是________(填化学式)。
(2)这种黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的主要污染物之一,这种有刺激性气味的气体是______(填化学式),反应的化学方程式为________________________________________。
(3)根据蔗糖与浓硫酸反应的实验现象,说明浓硫酸具有________(填序号)。
A.酸性 B.吸水性
C.脱水性 D.强氧化性
[答案] (1)C (2)SO2 C+2H2SO4(浓)CO2↑+2SO2↑+2H2O (3)CD
(1)浓硫酸能将蔗糖中的氢、氧元素以水的组成比脱去,最终将蔗糖氧化为碳单质,所以生成的黑色物质是C。
(2)C和浓硫酸继续反应生成二氧化硫、二氧化碳,二氧化硫具有刺激性气味,所以这种有刺激性气味的气体是SO2,发生反应的化学方程式为C+2H2SO4(浓)CO2↑+2SO2↑+2H2O。
(3)浓硫酸将蔗糖中的氢、氧元素以水的组成比脱去,体现了浓硫酸的脱水性;C与浓硫酸反应生成CO2,体现了浓硫酸的强氧化性。
[方法点拨] 两个过程涉及浓硫酸两大性质:①利用浓硫酸的脱水性脱去蔗糖中的氢和氧,此时只剩下碳(即蔗糖碳化变黑了);②因浓硫酸的强氧化性使其可以与碳反应,此时碳被氧化成了二氧化碳气体,浓硫酸被还原成了二氧化硫气体。
例2 如图1-1所示是某同学设计的制取纯净、干燥的CO2气体的装置。
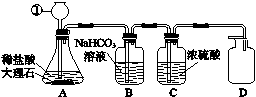
图1-1
回答下列问题。
(1)图中标号①仪器的名称是________________________。
(2)指出图中装置的错误: ________________________________________________。
(3)B中NaHCO3溶液的作用是除掉CO2中混有的少量HCl气体,写出反应的化学方程式:__________________________________________,C中浓硫酸的作用是________________________________________________________________________。
[答案] (1)长颈漏斗 (2)D装置中导气管没有伸至集气瓶底部 (3)NaHCO3+HCl===NaCl+H2O+CO2↑ 干燥CO2
(1)仪器①是长颈漏斗,注意书写时字不要写错。
(2)D装置是采用向上排空气法收集二氧化碳,为了尽量排出集气瓶内的空气而收集到比较纯净的二氧化碳,要把导气管伸至集气瓶底部,因此D装置错误。
(3)利用浓硫酸的吸水性可以干燥二氧化碳。
[方法点拨] 盐酸有挥发性,在制取二氧化碳时会挥发出HCl气体,使二氧化碳中含有HCl、水蒸气杂质,制取纯净、干燥的二氧化碳时要先除去杂质,再干燥。除杂的原则是能除去杂质,但不增加新的杂质,即可以先通过饱和NaHCO3溶液除去HCl,再通过浓硫酸干燥,得到纯净、干燥的二氧化碳气体。
例3 (多选)已知酸性强弱顺序为:H2A>H2B>HA->HB-。下列化学方程式正确的是( )
A.NaHB+H2A===H2B+NaHA
B.Na2B+H2A===H2B+Na2A
C.H2B+Na2A===NaHB+NaHA
D.H2B+NaHA===NaHB+H2A
[答案] AC
强酸可与比它弱的酸对应的盐发生反应,生成强酸的盐和弱酸。由于H2B>HA-,在B的化学方程式的生成物中,H2B的酸性强于HA-,故H2B可与Na2A发生C中的反应,故B错误,而C正确;D中的H2B酸性不如H2A,不能发生弱酸制强酸的反应。
![]()
1.实验室制取氢气时,可选用的试剂或方法是( )
A.锌片和稀硝酸 B.分离空气
C.锌片和稀硫酸 D.A和C都可以
2.如图1-2所示的实验中,小烧杯①和②分别盛什么试剂,片刻后,观察不到烧杯①中液体变成红色( )
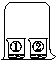
图1-2
A.①石蕊试剂 ②浓盐酸
B.①石蕊试剂 ②浓硝酸
C.①酚酞试剂 ②浓氨水
D.①酚酞试剂 ②浓氢氧化钠溶液
3.将浓硫酸滴在干燥的石蕊试纸上,可观察到试纸( )
A.变红 B.先变红后变黑
C.变黑 D.先变黑后变红
4.一物体(不参加化学反应)悬浮在密度为1.05 g/cm3 的氢氧化钡溶液中,现向此容器(容积足够大)中逐滴加入密度为1.61 g/cm3的硫酸(不溢出杯外),则滴加硫酸的过程中此物体的运动情况是( )
A.下沉
B.上浮
C.先下沉再上浮
D.先上浮再下沉
5.m g a%的烧碱溶液与n g a%的稀硫酸混合后滴入石蕊试液仍为紫色,则m和n的数值关系正确的是( )
A.m=n B.m>n
C.m<n D.无法判断
6.九年级某科学兴趣小组的四位同学非常善于学习,他们对有关知识进行了归纳,其中不正确的是( )
A.在某无色溶液中滴入酚酞试液不变色,则该溶液肯定不呈碱性
B.将少量稀盐酸滴在某固体上产生了气泡,则该固体肯定是金属
C.在某无色溶液中滴入BaCl2溶液产生了不溶于稀硝酸的白色沉淀,这不能说明该溶液中一定含有SO42-
D.在某无色溶液中加入稀盐酸无现象,再加BaCl2溶液,产生了白色沉淀,这能说明该溶液中一定含有SO42-
7.实验室有两瓶失去标签的试剂,其中一瓶是饱和食盐水,一瓶是蒸馏水。下面是老师提供的几种鉴别方法:①做导电性实验,②用pH试纸测试,③用新鲜萝卜进行实验,④用光学显微镜观察,⑤用AgNO3溶液检验。你认为可行的是( )
A.①②③④ B.①③⑤
C.②④⑤ D.①②③④⑤
8.实验室里同学们设计如图1-3所示装置,探究非金属元素性质变化规律。用该装置来证明酸性:HNO3>H2CO3>H2SiO3(不考虑硝酸的挥发性)。已知硅酸(H2SiO3)是一种难溶于水的弱酸,呈白色。在化学反应中,强酸一般能制取弱酸。现有硝酸、碳酸钙、澄清石灰水、硅酸钠溶液,选择所给试剂,A、B、C中盛装的试剂分别为________、________、________。C中实验现象为________________;写出C中发生反应的离子方程式:____________________________________。

图1-3
9.小华发现暖水瓶中有一层淡黄色的水垢。他想探究该地区的水垢中碳酸钙的含量(假设只含1种碳酸盐——碳酸钙,水垢中其他杂质不会产生CO2),于是他收集水垢后经低温烘干进行下列实验:
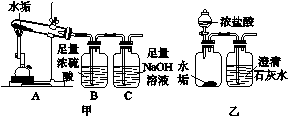
图1-4
(1)取2.5 g水垢按图1-4甲中的A装置在高温条件下充分反应(已知CaCO3CaO+ CO2↑),产生的气体依次通过B、C(NaOH溶液用于吸收CO2)装置,实验后发现C装置增重了0.88 g。通过计算得到水垢中碳酸钙的质量分数为________。
(2)B装置中的浓硫酸是用来吸收反应中产生的水蒸气,这是利用了浓硫酸的________性。
(3)按图乙所示的方法进行实验,结果发现澄清石灰水没有变浑浊,原因是________________________________________________________________________
________________________________________________________________________。
10.实验室要制取一瓶纯净、干燥的二氧化碳气体,请根据以下装置回答下列问题。(二氧化碳在饱和碳酸氢钠溶液中溶解度很小)
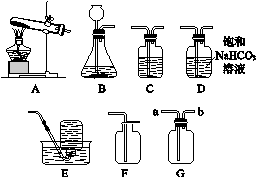
图1-5
(1)发生装置应选________(填写装置的字母代号)。
(2)用F装置而不用E装置收集二氧化碳的原因是________________________________________________________________________。
(3)若用G装置来收集二氧化碳,气体应从________(填“a”或“b”)端进入。
(4)若要用C装置来干燥二氧化碳,C装置中应盛放的物质是________。
(5)D装置通常用来除去二氧化碳中混有的少量氯化氢气体,请写出反应的化学方程式:______________________________________。
(6)实验室要制取一瓶纯净、干燥的二氧化碳气体,整套装置的连接顺序是________________________________________________________________________。
11.某同学通过以下实验验证稀硫酸的部分化学性质:
实验一:Na2CO3+H2SO4;
实验二:Ba(NO3)2+H2SO4;
实验三:NaOH+H2SO4。
将实验一、二、三反应后的所有物质倒入同一洁净的烧杯中,后续实验及现象如下:
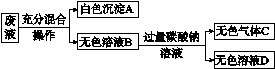
图1-6
(1)白色沉淀A是________。
(2)下列关于无色溶液B成分的猜想,合理的是________。
A.一定有NaNO3,可能含有NaOH
B.一定有NaNO3,可能含有HNO3和H2SO4
C.一定有NaNO3和HNO3,可能含有H2SO4
12.已知硫酸、磷酸、醋酸、硼酸的酸性由强变弱,请根据以下实验事实,作出推断:A.硫酸和磷酸钠反应可制得磷酸;B.磷酸和醋酸钠反应可制得醋酸;C.醋酸和硼酸钠反应可制得硼酸;D.硼酸不能和醋酸钠反应制得醋酸。
(1)由上述实验事实,可以分析得出的结论:一般来说,________酸可以和“含有弱酸根离子的盐”发生反应而生成弱酸,反之________酸不能和“含有强酸根离子的盐”发生反应。
(2)请用上述结论解释,为什么二氧化碳通入氯化钙溶液中无碳酸钙沉淀生成:________________________________________________________________________
________________________________________________________________________。
(3)又已知,醋酸可以和碳酸钠反应生成二氧化碳气体,而硼酸不和碳酸钠反应。请写出碳酸酸性在上述四种酸中的位置:________________________。
13.实验室新购进一批浓硝酸,科学兴趣小组为研究该试剂的保存方法,开展相关探究。请根据要求回答问题。

图1-7
(1)打开盛装浓硝酸的试剂瓶,立即观察到瓶口有白雾产生。据此可知,浓硝酸具有______________(填一条物理性质)。为进一步证明浓硝酸具有该性质,兴趣小组设计如图 1-7所示装置(脱脂棉团因喷有稀氢氧化钠与酚酞混合液而呈红色)进行实验,实验过程中观察到的现象是____________________,发生反应的化学方程式为________________________________________________________________________。
(2)将少量浓硝酸置于试管中,采用强光照射或者稍加热,立即观察到溶液上方有红棕色气体产生。据此现象可推知浓硝酸具有______________________(填一条化学性质)。
(3)通过上述两个实验可知,实验室应如何保存浓硝酸?________________________________________________________________________。
14.把47 g由一种非金属单质和一种氧化物组成的黑色固体混合物隔绝空气加热,充分反应后,称得剩余固体质量为36 g,该固体也是由一种单质和一种氧化物组成的。向此剩余固体中加入100 g稀硫酸恰好完全反应,过滤后所得滤渣呈红色。请回答:
(1)原混合物由____________组成。
(2)原混合物中含有单质多少克?
(3)过滤后所得滤液需要蒸发掉多少克水,才能形成t ℃时的饱和溶液?(t ℃时此溶液中溶质的溶解度为16 g)
答案
1.C
2.D 浓盐酸、浓硝酸易挥发,HCl、HNO3气体的分子不断运动,扩散到盛有紫色石蕊试液的烧杯中,溶于水形成盐酸、硝酸,使紫色石蕊试液变成红色;浓氨水易挥发,NH3分子不断运动,扩散到盛有无色酚酞试液的烧杯中,与水反应形成氨水使无色酚酞试液变成红色。
3.B 浓硫酸具有酸性、脱水性。
4.C 一开始滴入硫酸,硫酸和氢氧化钡反应生成硫酸钡沉淀,使溶液的密度减小,受到的浮力减小,故物体下沉,当滴入的硫酸和氢氧化钡完全反应后,再滴入硫酸,溶液密度逐渐增大,受到的浮力增大,故该物体又逐渐上浮。
5.C 由题干知:m g a%的烧碱溶液与n g a%的稀硫酸混合后滴入石蕊试液仍为紫色,根据“紫色石蕊试液遇酸变红,遇碱变蓝,遇中性溶液不变色”,可知烧碱溶液与稀硫酸恰好完全反应:
2NaOH + H2SO4===Na2SO4+2H2O
80 98
m g×a% n g×a%
=
解得:m=n,所以m<n。
6.B 酚酞遇碱性溶液变红,遇中性和酸性溶液均不变色,所以在某无色溶液中滴入酚酞试液不变色,则该溶液肯定不呈碱性。金属(氢前)与碳酸盐遇盐酸均会生成气体,所以某物质中滴加稀盐酸,生成无色气体,不能证明该固体肯定是金属。某溶液中滴加BaCl2溶液,生成不溶于稀硝酸的白色沉淀,因为氯化钡提供了钡离子与氯离子,所以该白色沉淀可能是硫酸钡,也可能是氯化银,因此不能说明该溶液中一定含有硫酸根离子。在某无色溶液中加入稀盐酸无现象,说明该溶液中不含有碳酸根离子和银离子,再加BaCl2溶液,产生了白色沉淀,能说明该溶液中一定含有硫酸根离子。
7.B
8.硝酸 碳酸钙 硅酸钠溶液 产生白色沉淀 CO2+SiO32-+H2O===H2SiO3↓+CO32-
现有硝酸、碳酸钙、澄清石灰水、硅酸钠溶液,选择试剂用如图所示装置证明酸性:HNO3>H2CO3>H2SiO3。因此先加入硝酸和碳酸钙反应生成二氧化碳,再将二氧化碳通入硅酸钠溶液生成硅酸沉淀,所以A、B、C中盛装的试剂分别为硝酸、碳酸钙、硅酸钠溶液。装置C中发生反应的离子方程式是:CO2+SiO32-+H2O===H2SiO3↓+CO32-;现象为产生白色沉淀。
9.(1)80%
(2)吸水
(3)浓盐酸具有挥发性,产生的沉淀被盐酸迅速溶解
(1)设2.5 g水垢中碳酸钙的质量为x。
CaCO3CaO+CO2↑
100 44
x 0.88 g
= x=2 g
水垢中碳酸钙的质量分数为:×100%=80%。
(2)浓硫酸能够用来吸收反应中产生的水蒸气,说明浓硫酸具有吸水性。
(3)浓盐酸具有挥发性,挥发出的氯化氢和二氧化碳进入石灰水中,氯化氢溶于水形成盐酸,盐酸会使产生的碳酸钙沉淀迅速溶解,所以没有发现澄清石灰水变浑浊。
10.(1)B
(2)二氧化碳的密度比空气大,且二氧化碳能溶于水
(3)a (4)浓硫酸
(5)NaHCO3+HCl===NaCl+H2O+CO2↑
(6)B→D→C→F(或B→D→C→G)
(1)实验室制取二氧化碳用大理石(或石灰石)和稀盐酸,反应不需加热,属于固液常温型,故发生装置选B。
(2)二氧化碳的密度比空气大,所以用向上排空气法收集,二氧化碳能溶于水,故不能用排水法收集。
(3)二氧化碳的密度比空气大,故应从长导管进气,将空气从集气瓶上部排出。
(4)干燥二氧化碳常用液体干燥剂浓硫酸。
(5)氯化氢气体极易溶于水,变为盐酸,碳酸氢钠和盐酸反应生成氯化钠、水和二氧化碳,化学方程式是NaHCO3+HCl===NaCl+H2O+CO2↑。
(6)制取纯净、干燥的CO2时,先除杂,再干燥,用向上排空气法收集。
11.(1)BaSO4
(2)C
12.(1)强 弱
(2)因为CO2对应的酸为碳酸,碳酸酸性比盐酸弱
(3)硫酸、磷酸、醋酸、碳酸、硼酸
13.(1)易挥发的性质 红色脱脂棉团变为白色 HNO3+NaOH===NaNO3+H2O
(2)强光下或受热易分解的性质
(3)密封保存在棕色试剂瓶中,且放置于阴凉处
(1)当打开装有浓硝酸的试剂瓶时,在瓶口立即有白雾产生,说明浓硝酸具有易挥发的物理性质。氢氧化钠显碱性,能使酚酞试液变红,所以脱脂棉显红色,又因为浓硝酸具有挥发性,挥发出的浓硝酸与脱脂棉上的氢氧化钠发生反应,从而中和碱,所以脱脂棉会由红色变为白色。(2)浓硝酸在强光下或受热时因为产生了红棕色气体,有新物质生成,所以发生的是化学变化。从而得出浓硝酸易分解的化学性质。(3)通过实验得出保存浓硝酸的方法:密封保存在棕色试剂瓶中,且放置于阴凉处。
14.(1)碳和氧化铜
解:(2)生成CO2的质量为:47 g-36 g=11 g。
设黑色固体混合物中单质碳的质量为x,参与反应的氧化铜的质量为y。
C+2CuO2Cu+CO2↑
12 160 44
x y 11 g
= x=3 g
= y=40 g
(3)剩余氧化铜的质量为:47 g-3 g-40 g=4 g。
设生成的硫酸铜的质量为z。
CuO+H2SO4===CuSO4+H2O
80 160
4 g z
= z=8 g
因为剩余固体和100 g稀硫酸恰好完全反应,
所以溶液中水的质量为:4 g+100 g-8 g=96 g。
设过滤后所得滤液需要蒸发水的质量为m,才能形成 t ℃时的饱和溶液。
= m=46 g
答:(2)原混合物中含有单质3 g;(3)过滤后所得滤液需要蒸发掉46 g水,才能形成t ℃时的饱和溶液。
【培优导学案】浙教版科学九年级全册:8、有关金属的图像问题、金属性质 学案(含解析): 这是一份【培优导学案】浙教版科学九年级全册:8、有关金属的图像问题、金属性质 学案(含解析),共12页。
【培优导学案】浙教版科学九年级全册:7、酸、碱、盐 学案(含解析): 这是一份【培优导学案】浙教版科学九年级全册:7、酸、碱、盐 学案(含解析),共12页。
【培优导学案】浙教版科学九年级全册:2、常见碱与碱的性质 学案(含解析): 这是一份【培优导学案】浙教版科学九年级全册:2、常见碱与碱的性质 学案(含解析),共12页。













